Vol. 20, núm. 5 septiembre-octubre 2019
De biofilms y otras películas
Patricia M. Valdespino, Martín Merino, Victor M. Valdespino y Silvia Batista CitaResumen
El conocimiento del mundo microbiano cada día crece, sorprendiéndonos y cuestionando los paradigmas de la Biología y la Química. Contrario a lo que solemos pensar, los microbios no viven solos sino en asociación con otros, formando en ocasiones capas tan delgadas como la punta de una aguja. Estas delgadas biopelículas están por todas partes y sus componentes son microscópicos, casi invisibles. Su estructura, diversidad y funciones son tan diversas como desconocidas; es decir, el conocimiento de las biopelículas apenas ha comenzado. Aquí hacemos un recuento de lo que estamos descubriendo y de lo que se vislumbra que está por descubrirse si estudiamos estas películas. Investigaciones recientes han revelado que las biopelículas juegan papeles clave en el equilibrio de los sistemas biológicos, por ejemplo, en los mecanismos de salud-enfermedad, ya que los causantes de las infecciones son biopelículas y no bacterias solitarias, como solíamos pensar. Es hasta ahora que empezamos a contar con los instrumentos y métodos necesarios para saber cuáles microbios están involucrados y qué composición química tienen las películas “babosas” que cubren alimentos y materiales. La participación de los microbios en las biopelículas es un tema creciente que impactará el desarrollo tecnológico en áreas como la biorremediación, la producción de energía y la terraformación o colonización de hábitats inhóspitos.
Palabras clave: biopelículas, microbioma, diversidad microbiana, biología de sistemas, salud-enfermedad, biotecnología.
On biofilms and other films
Abstract
Our knowledge of the microbial world is growing every day, surprising us and challenging the paradigms of Biology and Chemistry. Microbes do not live naturally isolated, but in association with other microbes, often forming films thin as a needle tip. These biofilms are everywhere, but they are microscopic and, therefore, practically invisible. Their structure, variety and functions are as diverse as they are unknown, since we have only begun to understand them. Here, we present an overview of the recent discoveries and promising new ones on biofilm research. Biofilms play key roles in the mechanisms that control health and disease in humans and in ecosystems’ equilibrium. It is only lately that we are beginning to have the instruments and techniques required to identify the type of microbes involved in each biofilm and to understand the chemistry of the slimy films that cover food and other materials. The role of microbes in these biofilms is a growing research area that will impact the future of technological development in areas such as bioremediation, energy production and colonization of extreme environments (such as terraformation).
Keywords: biofilms, microbiome, microbial diversity, systems biology, health-disease, biotechnology.
Introducción
¿Te gustan las películas? Seguro ya has visto éstas: los biofilms (o biopelículas), producciones realizadas completamente por microbios. Los protagonistas de estas películas son diversos microorganismos. Ahora están en los reflectores y en nuestra vida cotidiana porque hasta hace poco sólo éramos capaces de conocer ¡menos de 1% de la diversidad de microbios del planeta! Pero ahora, a partir de la secuenciación del ADN de muestras ambientales, estamos prácticamente redescubriendo el mundo microbiano y sus estrechas relaciones con los animales, las plantas y los ecosistemas (Gallego, 2018).
Bajo ciertas condiciones –por ejemplo, los microambientes fisicoquímicos relacionados al estrés, a cambios de temperatura, a desnutrición del hospedero, etcétera–, los microbios se agrupan formando películas (biopelículas, biotapetes o, en inglés, biofilms), donde cada participante aporta diversas funciones al conjunto (McGraw-Hill, 2017; UAEH, 2019). Por ejemplo, algunas bacterias rompen los compuestos químicos más complejos, favoreciendo así el crecimiento de otras bacterias; o bien, en contraste, algunos microbios producen compuestos que limitan el desarrollo de otros.
Dichas biopelículas son más frecuentes de lo que crees y, de hecho, seguramente fueron las primeras asociaciones de vida en el planeta. Se trata complejos mundos que pueden desarrollarse en capas tan delgadas como la punta de una aguja. Donde solíamos pensar que había un sólo tipo de microbio involucrado, ahora sabemos que hay una amplia colectividad, en la que conviven bacterias y otros microorganismos (arqueas, hongos, protistas, etcétera), de diversas especies. Esto tiene implicaciones muy importantes para entender el funcionamiento de los sistemas vivos.
¿Has visto esta película?

Hay biopelículas a color o incoloras, las hay “buenas”, terroríficas, efímeras, duraderas, simples y complejas; es decir, las hay ¡de todo tipo! Por ejemplo, la fina capa transparente que cubre los dientes de los mamíferos, el moho pardo de las paredes de la ducha, o las lamas verduzcas en las piedras de los ríos, etcétera. Estamos empezando a reconocer los talentos de estos protagonistas; es decir, tanto su vasta diversidad, como el papel que desempeñan los microbios involucrados, lo cual tendrá implicaciones en nuestra vida futura, ya que el “éxito” de los biofilms influye en los mecanismos de salud-enfermedad de organismos y ecosistemas. De hecho, hoy sabemos que las infecciones en nuestro cuerpo están directamente vinculadas con el desarrollo de biopelículas (Meza-Villezcas et al., 2019). Además, pueden esconder claves para futuros desarrollos tecnológicos.
Hoy en día la biopelículas se usan para diversos procesos como el tratamiento de aguas residuales (González-Brambila et al., 2008) o la producción de biocombustibles (Ozkan et al., 2012). Los biofilms también son un factor clave en los mecanismos de salud-enfermedad, por lo que entender sus impactos nos llevará a rediseñar los tratamientos médicos, ya que anteriormente éstos se basaban en contener a un solo microorganismo patógeno (Morones Ramírez, 2009; Meza-Villezcas et al., 2019; UAEH 2019).
Qué película tan babosa

¿Alguna vez has tomado del refrigerador algún alimento, por ejemplo, un pedazo de carne o de pescado que huele muy extraño y se siente baboso? ¡Sí! Como bien lo intuyes, esa capa superficial o película que te parece resbalosa al tacto y que tiene un olor característico (que puede ocasionarte ganas de vomitar) es una biopelícula. Se trata de asociaciones muy complejas y diversas de microbios (bacterias, arqueas, virus y hongos). Pero no te asustes demasiado: no todo lo que tenga que ver con microbios es malo. Recuerda que hay ciertos productos muy necesarios en nuestra dieta que conllevan ingeniería microbiana, como el yogurt, los quesos, los alimentos fermentados, etcétera. Estos productos y sus microbios han acompañado la salud de los humanos desde tiempos milenarios.
Eso sí, como en todas las relaciones, es necesario escuchar y entender para tener una buena convivencia con las biopelículas. De hecho, cotidianamente nos deshacemos de muchas que están en los alimentos simplemente con agua y jabón o con desinfectantes basados en plata coloidal o compuestos clorados; lo cual puede salvarte de una gastroenteritis.
Pero hay otras biopelículas que debes cuidar cotidianamente, pues, ¡te acompañarán toda la vida! Por ejemplo, la biopelícula de la cavidad oral, o las que están asociadas a las mucosas genital y nasal. Es sorprendente que, aunque las biopelículas son genéricamente similares entre personas, en detalle, su composición es única y además cambia con el tiempo. En resumen: ¡no hay dos películas iguales!
¿De qué trata esta película?
Una gran dificultad para estudiar los microbios y su microambiente es que la mayoría de ellos se desarrollan en agrupaciones biodiversas y son organismos invisibles a nuestra vista. Aún con un microscopio con buena resolución, la mayoría de los microbios son muy similares a simple vista y no podemos distinguirlos por su apariencia (ver figura 1). Gracias a novedosos desarrollos tecnológicos e instrumentos recientes, ahora estamos empezando a conocer en detalle la identidad de los “actores microbianos” y la composición química de las biopelículas. ¡Ésta es una era muy emocionante para estudiar los microbios! Así, la secuenciación de nueva generación permite hoy en día entender la identidad y la abundancia de microorganismos en muestras ambientales a partir de su señal genética. De manera similar, novedosos tipos de microscopía acoplada al análisis químico por imagen son también herramientas esenciales para entender de qué tratan estas películas (incluyendo su composición elemental y los factores que las favorecen).
A simple vista, es fácil confundir las biopelículas con otros materiales. Por ejemplo, la baba del nopal, el gel del Aloe vera o el sustancioso caldo de tu abuelita no son productos microbianos, aunque lo parezcan porque tienen una consistencia gelatinosa similar a la de las biopelículas. Esta consistencia resbaladiza o babosa se debe a un componente esencial, al que damos un nombre tan poco específico como Sustancias Poliméricas Extracelulares (EPS por sus siglas en inglés, Extracellular Polymeric Substances). Las EPS son una colección de polímeros (cadenas largas que se forman por la unión de varias subunidades elementales, como las cuentas de un collar), construidos a base de ácidos orgánicos, carbohidratos, proteínas o ácidos nucleicos, entre otros (ver figura 1). Esta mezcla de sustancias constituye en sí misma un microambiente con condiciones apropiadas de humedad, acidez, nutrientes, movilidad, etcétera, para que los microbios realicen sus funciones (como individuos y como comunidad). El grosor de las EPS puede ser tan delgado como decenas de nanómetros hasta centímetros (1 nanómetro equivale a una diez millonésima de un centímetro).
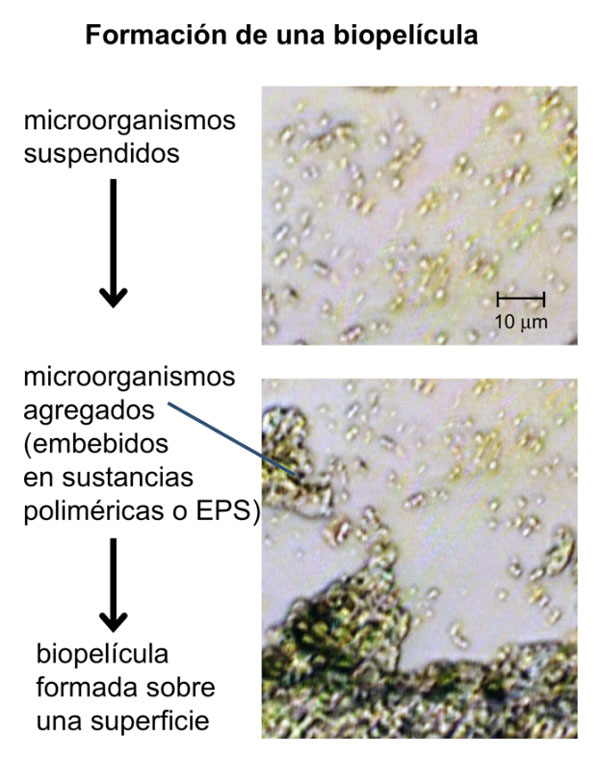
Figura 1. De arriba hacia abajo se muestra la secuencia de la formación de una biopelícula sobre una superficie. Células dispersas se van agregando, embebidas en una matriz polimérica (o EPS) y forman una biopelícula sobre una superficie. En un microscopio normal es difícil distinguir diferencias entre las distintas especies de microorganismos que componen la biopelícula.
Si hay nicho hay bicho
El ambiente dentro de la biopelícula no sólo es diferente a nuestro entorno, sino que además cambia drásticamente; ¿puedes imaginar la existencia de condiciones muy diferentes de humedad, de oxígeno o de acidez/alcalinidad en una capa tan delgada? Si hacemos un acercamiento a una biopelícula que crece en el margen de un río veríamos que su superficie está expuesta a la luz del sol, al flujo del agua, al oxígeno atmosférico. Esta parte de la película es un ambiente propicio para hacer fotosíntesis (fabricar moléculas orgánicas usando luz y CO2). Indudablemente, aquí hay microorganismos fotosintetizadores, capaces de explotar en particular este nicho ecológico (el nicho comprende el microambiente y –a la vez– el rol del organismo que lo puede habitar). Aunque parezca difícil de imaginar, los microorganismos que crecen algo más abajo dentro de la biopelícula se encuentran ya en un ambiente muy distinto, donde, por ejemplo, la luz y el oxígeno ya no están disponibles. Este sería un nicho adecuado para microbios que utilizan para su desarrollo rutas metabólicas que no dependen del oxígeno, como las bacterias fermentadoras. En resumen, como podrás imaginar, la diversidad microambiental coincide con la diversidad biológica (número y tipo de microorganismos) de cada biofilm. Esto tiene implicaciones en su sobrevivencia y la resistencia al cambio ambiental.
Películas buenas y películas malas
Cualquier pequeño sabe que debe lavarse las manos antes de comer porque están llenas de bacterias y ¡eso es muy malo! Ese contacto infantil con el mundo microbiano ha marcado nuestra interacción con éste y naturalmente hemos percibido a los microorganismos como los “malos de la película”, como agentes de enfermedades. Ahora que comenzamos a entenderlos con mayor claridad, sabemos que hay un inmenso mundo microbiano en el ambiente y que algunos de estos microorganismos realizan funciones muy importantes para los ecosistemas, y en general para todas las plantas y los animales (por ejemplo, el microbioma dentro de nosotros). Algunas bacterias son los personajes “buenos” que nos ayudan a vivir; por ejemplo, las bacterias fermentadoras Lactobacillus rhamnosus, Lactobacillus reuteri o Lactobacillus acidophilus, que ya están disponibles comercialmente (como probióticos) y que son auxiliares en trastornos digestivos, del tracto genital-urinario, de la piel, etcétera.
Efectivamente, hay biopelículas “de terror” (como las que crecen en el pollo o en el pescado que tienen muchos meses en el refrigerador), pero hay también biopelículas “buenas”, como los biofilms microbianos en la boca que nos ayudan a procesar los alimentos y defendernos de bacterias patógenas. Cuando visites los márgenes de ríos y lagos, observa las biopelículas verdes o pardas que allí existen, las forman los “productores primarios” (organismos fotosintéticos, el primer eslabón de las redes alimenticias en los ecosistemas). Estas biopelículas pueden también fijar el nitrógeno atmosférico en forma de biomasa o contribuir a degradar contaminantes (como hidrocarburos); asimismo, son importantes para el ecosistema, pero son muy resbalosas, así que ¡procura no pisarlas porque puedes caerte!
Como siempre ocurre en la naturaleza, que tan “buenos” o que tan “malos” son los microbios depende de equilibrios muy sensibles entre el anfitrión y el huésped. ¿Recuerdas el caso de los mineros chilenos que quedaron atrapados en una mina por 70 días? Cuando felizmente los rescataron, uno de los principales problemas de salud que presentaron fue una alteración terrible en la salud de la boca. Y es que ahí viven en cada uno de nosotros de cientos a miles de millones de microorganismos –de más de 600 tipos diferentes–, que nos ayudan a procesar los alimentos (y todas las partículas que entran al organismo por ella (ver Luyo, 2005). La salud de la cavidad oral implica tener una higiene frecuente, pero bajo ciertas circunstancias se pueden alterar las condiciones microambientales del cuerpo y de la boca. Por ejemplo, cuando nos deshidratamos, nos exponemos a fuertes dosis de radiación solar, estamos muy estresados o en tratamiento médico, cuando nos lavamos los dientes excesivamente o cuando nos ocurren accidentes agradables como intercambiar un beso, puede haber consecuencias desde imperceptibles o leves (como inflamación de las encías, manchas o caries en los dientes) hasta alteraciones más graves que pueden implicar lesiones por virus o infecciones (ver Luyo, 2005).

Películas del futuro
Las biopelículas microbianas están actualmente inspirando historias de ciencia ficción y experimentos científicos, ya que diversos procesos o compuestos generados en ellas pueden ser aprovechados en la industria del futuro. Mencionaremos dos casos solo para darte una idea de qué tan diversas pueden ser las aplicaciones de estas delgadas biomáquinas.
1. Las biopelículas son estudiadas y usadas como filtros de contaminantes para sanear el agua de drenajes y de residuos de la agricultura. Ciertos microbios son capaces de transformar aguas contaminadas y llenas de nutrientes en aguas claras y útiles (González-Brambila y López-Isunza, 2008).
2. La especie humana ya está buscando colonizar otros astros como consecuencia del deterioro ambiental que estamos provocando en nuestro planeta. A la fecha consideramos que los actores más poderosos para cambiar los ambientes extraterrestres de hostiles a habitables son los microbios, en especial aquellos asociados a biopelículas, que serán participantes claves en estos procesos denominados terraformación. Ya se ejecutan a bordo de la Estación Espacial Internacional múltiples experimentos buscando las características y estrategias que permitan a los microbios vivir en condiciones de baja presión, baja temperatura, limitación de nutrientes o microgravedad (Qin et al., 2018; NASA News, 2019).
Actores secundarios
Como sucede en las películas, algunas veces los actores secundarios se roban la escena; en este caso, los organismos más pequeños o que no conocemos bien pueden tener una relevancia brutal y definir el éxito de toda la biopelícula. Un ejemplo muy claro son los microbios que habitan las zonas polares. Allí, los microorganismos se asocian y se recubren con una película que ellos mismos producen, la cual les permite sobrevivir en condiciones extremas de baja temperatura, alta radiación ultravioleta y ciclos de congelamiento-descongelamiento. Algunas bacterias pueden producir polímeros, parecidos a plásticos, pero de origen microbiano, que son materiales muy resistentes que permiten a los microbios sobrevivir en estos ambientes crueles. También se ha detectado que algunos de estos microbios pueden degradar moléculas que son tóxicas o difíciles de procesar para la mayoría de los organismos, como los hidrocarburos (Ruberto et al., 2009).

Conclusiones
Son los conjuntos de microbios asociados, que frecuentemente forman biopelículas, los que regulan los equilibrios de los sistemas naturales o las infecciones de plantas y animales (no se trata de microorganismos individuales). El entendimiento de las interacciones microbianas en estas películas, así como la interacción con su entorno, serán fundamentales en las siguientes décadas para beneficio de la humanidad y de los sistemas naturales.
Quizá en este punto ya estarás convencido de que este mundo “invisible a nuestros ojos” tiene repercusiones muy importantes para nuestra vida y para nuestro planeta. Para conocer más, acércate a las exposiciones, museos y recursos digitales dedicados al mundo microbiano, por ejemplo, Comicbacterias. Pero si no tienes tanto tiempo para salir a buscarlas, puedes también ponerte unos guantes, buscar una lupa y explorar el moho en tu bañera o tu charco más cercano, seguro te sorprenderás. ¡Ah, y no olvides buscar ese pedazo de queso que tienes olvidado en tu nevera!
Referencias
- Gallego, A. [dirección y producción] (18 de septiembre, 2018). Matilde, la holobionte. El bosque interior. Podcast recuperado de: http://www.rtve.es/alacarta/audios/el-bosque-interior/bosque-interior-matilde-holobionte-18-09-18/4743224/.
- González-Brambila, M. y López-Isunza, F. (2008). Membrane-attached biofilm reactor under different flow rate conditions in the treatment of a synthetic wastewater. Revista Mexicana de Ingeniería Química, 7(3), 183-193.
- iTunes U-UAEH. (2019). Bacterias Formadoras de Biofilm . Recuperado de: https://youtu.be/u7IQQSHL8OQ.
- Luyo, A. G. P. (2005) La biopelícula: una nueva visión de la placa dental. Revista Estomatológica Herediana, 15(1), 82-85. Recuperado de: http://www.redalyc.org/articulo.oa?id=421539343016.
- McGraw-Hill Animations. (6 de junio de 2017) Biofilms formation . Recuperado de: https://youtu.be/ZYG5LzgQ-s8.
- Meza-Villezcas A., Gallego-Hernández A. L., Yildiz F. H., Jaime-Acuña O. E., Raymond-Herrera O. y Huerta-Saquero A. (2019). Effect of antimicrobial nanocomposites on Vibrio cholerae lifestyles: Pellicle biofilm, planktonic and surface-attached biofilm. PLoS One, 14(6): e0217869. DOI: https://doi.org/10.1371/journal.pone.0217869.
- Morones Ramírez, R. (2017). El uso de la Plata en los antibióticos del futuro. Revista Digital Universitaria, 10, núm. 10, octubre. http://www.revista.unam.mx/vol.10/num10/art69/art69.pdf.
- NASA News. (2018). Recuperado de: https://www.nasa.gov/mission_pages/station/research/news/microorganisms.html.
- Ozkan, A., Kinney, K., Katz, L., & Berberoglu, H. (2012). Reduction of water and energy requirement of algae cultivation using an algae biofilm photobioreactor. Bioresource technology, 114, 542-548. DOI: https://doi.org/10.1016/j.biortech.2012.03.055.
- Peruzzo N. y Rodríguez Juele, A. (s.f.). Comic bacterias. Bacterias: La historia más pequeña jamás contada. Recuperado de: https://www.comicbacterias.com/.
- Qin, Y., Fu, Y., Chen, H., Liu, H., y Sun, Y. (2018). Microgravity effect on endophytic bacteria communities of Triticum aestivum. Acta Astronautica, 143, 297-301. DOI: https://doi.org/10.1016/j.actaastro.2017.11.008.
- Ruberto, L., Dias, R., Lo Balbo, A., Vazquez, S. C., Hernandez, E. A., y Mac Cormack, W. P. (2009). Influence of nutrients addition and bioaugmentation on the hydrocarbon biodegradation of a chronically contaminated Antarctic soil. Journal of applied microbiology, 106(4), 1101-1110. DOI: https://doi.org/10.1111/j.1365-2672.2008.04073.x.
Recepción: 12/02/2019. Aprobación: 27/06/2019.
Vol. 20, núm. 5 septiembre-octubre 2019
Rata de Magdalena: un importante mamífero mexicano
Fernando A. Cervantes Reza y Pamela Montaño Sosa CitaResumen
La rata de Magdalena (Xenomys nelsoni) es una especie de roedor endémico de México, de importancia ecológica, evolutiva y en conservación. Desafortunadamente, es poco conocida y se encuentra en peligro de extinción. Habita únicamente en las selvas secas de la vertiente del Pacífico mexicano en Jalisco y Colima, y últimamente se le ha registrado sólo en la Reserva de la Biósfera Chamela-Cuixmala. Es un mamífero de hábitos arborícolas, solitario, nocturno, que se alimenta principalmente de hojas, yemas y frutos. En la actualidad, se efectúan estudios sobre su distribución geográfica, morfología y genética molecular para dar a conocer su existencia y características principales; así como contribuir en acciones para su conservación.
Palabras clave: rata de Magdalena, Cricetidae, Rodentia, endémico, selva seca, vertiente del Pacífico mexicana.
Magdalena rat: an important mexican mammal, little known and at risk of extinction
Abstract
The Magdalena Rat (Xenomys nelsoni) is a species of rodent endemic to Mexico, of ecological, evolutionary and conservation importance. Unfortunately, it is little known and threatened with extinction. It only inhabits the dry jungles of the Mexican Pacific slope in Jalisco and Colima and lately it has only been reported in the Chamela-Cuixmala Biosphere Reserve. It is a mammal of arboreal habits, solitary, nocturnal, which feeds mainly on leaves, buds and fruits. Currently, studies are being carried out on its geographical distribution, morphology and molecular genetics, in order to make its existence and main characteristics known, as well as to contribute with actions for its conservation.
Keywords: Magdalena rat, Cricetidae, Rodentia, endemic, dry forest, Mexican Pacific slope.
Introducción
El roedor Xenomys nelsoni o rata de Magdalena, es una especie distintiva de mamífero, que, desafortunadamente, es poco o nada conocida en su ambiente natural (ver figura 1). Existen diversos motivos por los cuales debemos conocer a esta especie: sólo existe en una pequeña región de México, está asociada a las continuamente perturbadas selvas secas (bosques tropicales caducifolios) del Pacífico mexicano y, lamentablemente, se encuentra en una de las categorías de riesgo de extinción reconocidas por el gobierno mexicano. Asimismo, los biólogos han reportado que se trata de un mamífero emblemático que, aunque de tamaño pequeño y difícilmente visible en su hábitat natural, es de gran importancia ecológica, biogeográfica y evolutiva. Además, debemos conocer a la rata de Magdalena porque, como otras especies amenazadas de México como el jaguar, el tapir, el berrendo y el lobo mexicano, también contribuye a la sumatoria de especies que colocan a México como un país con uno de los niveles más elevados de biodiversidad. La rata de Magdalena es, por lo tanto, una especie más de nuestra fauna silvestre que debe ser conocida por académicos, estudiantes, comunidades locales, organizaciones no gubernamentales y los distintos niveles de gobierno, para contribuir en acciones para su conservación.
¿Quién es, entonces, Xenomys nelsoni?, ¿cómo es y en dónde habita?, ¿cuáles son los factores que amenazan su supervivencia?, ¿qué podemos hacer al respecto? Lo expondremos a continuación.

Figura 1. Ejemplar macho adulto de la rata de Magdalena (Xenomys nelsoni) registrado en una selva seca (bosque tropical caducifolio) de la región de la costa de Chamela, Jalisco, México, en marzo de 2005 (Cervantes, Ramos, Vargas y Montaño, 2019a).
Xenomys nelsoni pertenece al orden Rodentia, uno de los grupos de mamíferos más abundantes del mundo en cuanto a número de individuos y de especies (casi 2 300; Tzab y Macswiney, 2014: 12). Asimismo, con excepción del continente australiano, los roedores se encuentran en casi todas partes del mundo y habitan prácticamente en todo tipo de hábitat natural conocido. De acuerdo con esto, los roedores en México suman poco menos de 50% de las especies conocidas de mamíferos silvestres (casi 550) y se les encuentra tanto en ecosistemas templados como tropicales. Sin embargo, existen especies de roedores endémicas de México, esto es, las que sólo se encuentran dentro de los límites geográficos del país. Las áreas geográficas que se distinguen por su alto número de este tipo de especies son las selvas secas (bosques tropicales caducifolios) del occidente, que cubren la vertiente del Pacífico mexicano (ver figura 2; Ceballos y Martínez, 2010: 123). En esta región podemos encontrar diversas especies de los ocho géneros de roedores endémicos que hay en México, entre los cuales destaca Xenomys, el cual contiene solamente una especie (ver figura 3).
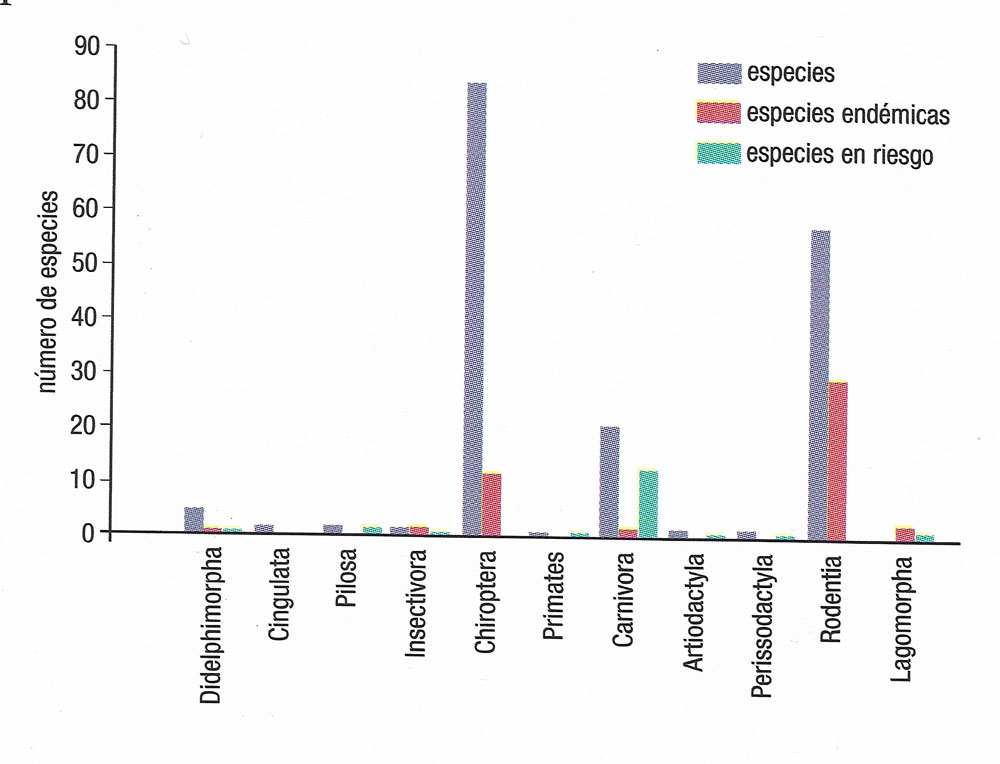
Figura 2. Riqueza de especies de mamíferos de las selvas secas mexicanas, incluyendo la fracción de especies que habitan sólo en México y la proporción de taxa en alguna categoría de riesgo de extinción (imagen tomada de Ceballos y Martínez, 2010: 123).

Figura 3. Vista dorsal comparativa de pieles de ejemplares de colección científica de algunos roedores endémicos (excepto Neotoma albigula), con presencia en la vertiente del Pacífico mexicano. De arriba hacia abajo: Nelsonia goldmani, Neotoma albigula, Xenomys nelsoni y Hodomys alleni (Cervantes y Hernández, 2016a).
Distribución geográfica
La rata de Magdalena (Xenomys nelsoni) sólo se puede encontrar en una zona relativamente pequeña de la costa tropical de los estados de Jalisco y Colima (ver figura 4; Ceballos y Martínez, 2010: 125). Los biólogos han reportado su presencia sólo en tres áreas: Armería y Pueblo Juárez (Colima), así como en Chamela (Jalisco). Afortunadamente, esta última área forma parte de la Reserva de la Biosfera Chamela-Cuixmala (RBCC), en el municipio de la Huerta, aproximadamente a 120 km al norte de Manzanillo, Colima, entre el margen norte del río Cuitzmala y el arroyo Chamela.
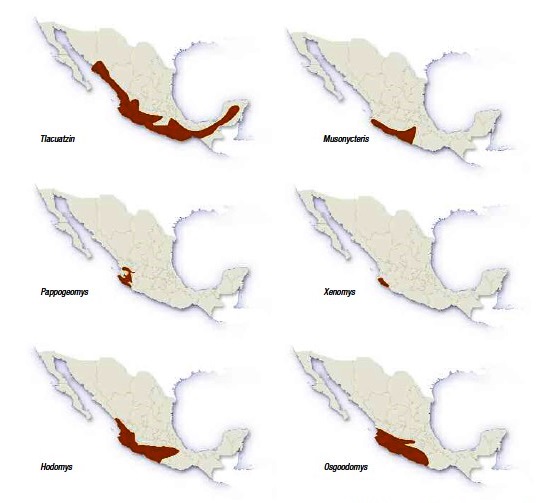
Figura 4. Distribución geográfica de algunas especies de mamíferos pequeños endémicos de las selvas secas mexicanas, incluyendo la rata de Magdalena (Xenomys nelsoni). Imagen tomada de Ceballos y Martínez, 2010: 125.
Dicha especie tiene una de las distribuciones geográficas más pequeñas de todos los mamíferos de México. Biológicamente es interesante que las áreas de distribución de las especies endémicas de las selvas secas son menores que el promedio de todos los mamíferos de México (Ceballos y Martínez, 2010: 128). Sin embargo, esta condición representa una situación difícil para la conservación de la biodiversidad pues hay que proteger, aunque pequeñas, muchas áreas dispersas y sin corredores para su conexión.
Clima y hábitat
Xenomys nelsoni habita en la selva baja caducifolia o selva seca, donde las especies arbóreas normalmente miden entre 5 y 10 m (ver figura 5A). Este ambiente se caracteriza por una fuerte estacionalidad climática, donde la época húmeda se concentra prácticamente en cuatro meses, de junio a septiembre, y el resto del año la mayoría de los árboles pierden sus hojas por un período de cinco a siete meses (ver figura 5B; Hayden, Greene y Quesada, 2010: 238).
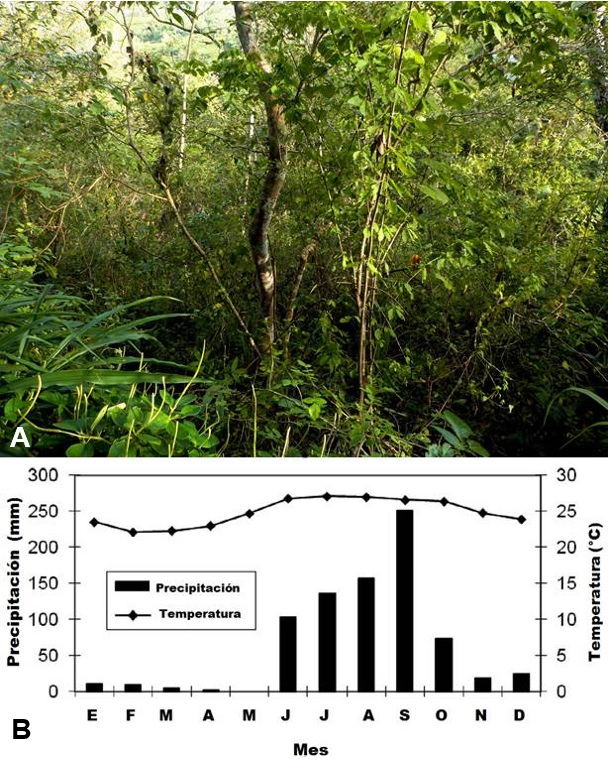
Figura 5. A) Vista de la selva seca (bosque tropical caducifolio) de las cercanías de la población El Tuito, Municipio Cabo Corrientes, Jalisco, sitio probable de la presencia de la Rata de Magdalena (Xenomys nelsoni; fotografía de M. López Zamora). B) Marcha mensual del clima de los alrededores de Chamela, Jalisco, región donde más se ha registrado la presencia de X. nelsoni en su habitat natural (imagen tomada y modificada de Hayden et al. 2010: 238).
Es notable que numerosas especies de árboles nunca presenten hojas y flores simultáneamente, produciendo abundantes flores durante la sequía (Bullock y Solís, 1990: 27). Los biólogos han registrado la presencia de individuos de la rata de Magdalena, por lo general, en áreas con una alta densidad de árboles y con follaje denso y cerrado, principalmente en las copas de los árboles. En particular, han detectado su presencia en árboles de anona (Annona reticulata), palo mulato (Bursera simaruba) y hule (Castilla elastica; Schaldach, 1960: 4).
Características generales
La apariencia de la rata de Magdalena (Xenomys nelsoni) es similar a la de otras especies de rata. La longitud, en adultos, de su cuerpo y cola juntos es de 250 a 350 mm (Miranda, 2002: 439; ver figura 6). El color del pelaje del dorso varía de canela-marrón a amarillo claro-marrón y es pálido en la cabeza y brillante sobre las caderas; muchos pelos tienen puntas negras. Las partes inferiores son de color blanco cremoso (Ceballos y Miranda, 2000: 185); las orejas son redondeadas y miden de 20 a 24 mm de longitud. Una de sus características distintivas son las manchas blancas que tiene arriba de cada ojo y detrás y en la base de cada oreja. La cola es peluda, sin escamas y casi del mismo tamaño que el resto del cuerpo (145-175 mm). Su peso varía de 90 a 130 g en los adultos, mientras que en los subadultos de alrededor de 65 g y los jóvenes de 40 g.

Figura 6. Rata de Magdalena (Xenomys nelsoni), que muestra la fisionomía típica de roedor. Los tonos de color y su combinación, así como sus manchas particulares la hace muy distintiva a la vista (Cervantes et al. 2019b).
Excepto por el tamaño y el peso, no se conocen otras diferencias entre sexos o categorías de edad. El cráneo de este roedor es característico, donde destaca el hueso timpánico (que contiene a los oídos medio e interno) relativamente grande e inflado, con su eje longitudinal casi paralelo al eje del cráneo; el borde supraorbital es levantado y prominente (ver figura 7A). Además, la superficie del molar inferior 3 (el más posterior de la mandíbula) tiene una forma diagnóstica en forma de “S” (ver figura 7B). Las medidas craneales de adultos, al combinar datos de ambos sexos, son: longitud mayor del cráneo, 40.5-44.6 mm; longitud condilobasal, 35.3-39.6 mm; ancho cigomático 20.2-21.9 mm; longitud de los nasales 14.1-15.9 mm; y longitud de la hilera superior de dientes 8.0-9.0 mm (Ceballos y Miranda, 2000: 185).
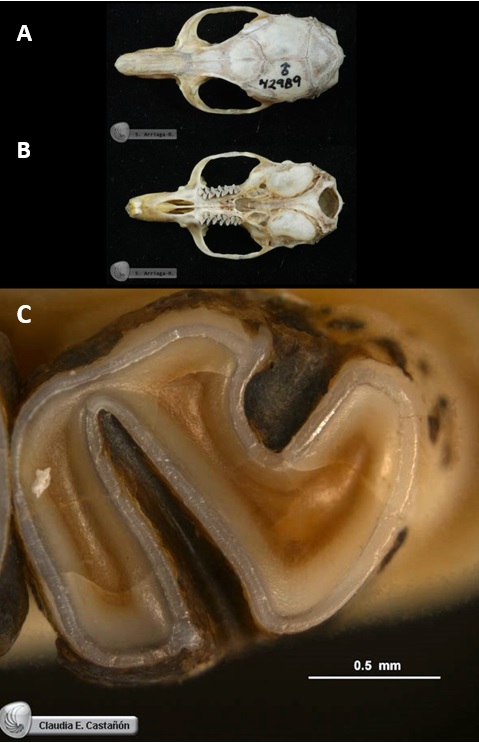
Figura 7. Cráneo y pieza dental de ejemplares adultos de colección científica de la rata de Magdalena (Xenomys nelsoni). A) Vista dorsal donde se aprecia el borde supraorbital prominente sobre cada una de las órbitas oculares (Cervantes y Hernández, 2010a). B) Vista ventral que muestra las bulas timpánicas típicas que alojan a cada uno de los oídos de este roedor (Cervantes et al., 2010b). C) Acercamiento de la vista superior del molar inferior 3 de la mandíbula derecha, que muestra el patrón de esmalte diagnóstico de la especie (Cervantes, Castañón, Sánchez, Vargas y Hortelano, 2016).
Crecimiento, reproducción, alimentación, comportamiento
Xenomys nelsoni es un roedor de hábitos principalmente arborícolas (ver figura 8A). Si bien ha sido capturado en trampas dispuestas sobre la superficie del suelo, los biólogos consideran que la mayor parte del tiempo la pasa entre el follaje de los árboles, a una altura de entre 1 y 4 metros. Este mamífero utiliza huecos y oquedades en las ramas y tronco de los árboles como refugio, así como enramadas y conglomerados de follaje. Se desconoce el impacto que tiene la época seca del año cuando disminuye considerablemente el follaje de los árboles.

Figura 8. A) La rata de Magdalena (Xenomys nelsoni) se ha especializado en vivir principalmente en la copa de los árboles de las selvas secas de la vertiente del Pacífico mexicano, aprovechando huecos y oquedades como refugio y sitio de nidificación (fotografía de Gustavo Zaragoza). B) Como la mayoría de los roedores, es una especie de hábitos nocturnos (fotografía de Diana Fuentes R.).
Como la mayoría de los roedores, la rata de Magdalena es de hábitos nocturnos; en ese horario busca su alimento y lleva al cabo actividades de exploración de su territorio (ver figura 8B). Se ha reportado que se encuentra activa de 1 a 1.5 horas después de la oscuridad y hasta la medianoche (Schaldach, 1960: 4). Hasta donde se sabe, es una especie cuyos individuos adultos son solitarios, no forman agrupaciones o colonias. Acostumbran orinar y defecar en letrinas que hacen sobre horquetas y cavidades de los árboles.
Las observaciones de campo indican que su temporada de reproducción es desde el final de la estación seca y durante la temporada de lluvias, lo que comprende finales de mayo hasta noviembre. Estos roedores construyen nidos en forma de esfera entre las ramas de los árboles con hojas, ramitas, pasto y fibras vegetales de plantas como el árbol de la ceiba (Ceiba pentandra; Mendoza, 1997). En cada parto nacen una o dos crías, ciegas, sin pelo, de tonalidad rosada y pesan alrededor de 5 g (Ceballos y Miranda, 2000: 185). En una ocasión –22-29 de mayo de 1970– se encontró un nido con dos hembras jóvenes que midieron y pesaron, respectivamente, 140 y 141 mm de longitud total y 17.1 y 18.1 g (López-Forment, Sánchez y Villa, 1971: 103). De manera similar, otro par de crías (hembra y macho) de una selva seca de las cercanías de Chamela, Jalisco, que fueron encontradas en el estómago de su depredador –la culebra ratonera: Senticolis triaspis (Hernández, Rodríguez y Jaramillo, 2018)– midieron 171 mm de longitud total y 20 g de peso, y 160 mm y 19 g, respectivamente (ver figura 9).

Figura 9. Crías de rata de Magdalena encontradas en el estómago de su depredador, el 18 de octubre de 2016 y convertidas en ejemplares de colección para su preservación y estudio científico (Cervantes, Vargas, Montaño y Montes de Oca, 2019c). Se incluye un ejemplar hembra adulta para motivos de comparación colectada el 1 de noviembre de 2004. Los tres ejemplares proceden de una selva seca (bosque tropical caducifolio) del estado de Jalisco.
Como especie presa, la rata de Magdalena es de importancia ecológica pues, al igual que la mayoría de los roedores, representa uno de los alimentos principales de diversos reptiles, aves y mamíferos de su ecosistema, lo que ayuda a mantener un equilibrio armónico entre la presencia de animales presa y los depredadores que los consumen.
Xenomys nelsoni no presenta dientes caninos y sus incisivos son de crecimiento continuo, por lo que necesita roer constantemente para gastarlos. Por sus hábitos alimentarios los roedores juegan un papel importante en las comunidades naturales, ya que son de los principales consumidores de plántulas, así como depredadores y dispersores de semillas. Su alimentación es principalmente a base de hojas, yemas y frutos, pero también puede complementarla con insectos y otros invertebrados (Ceballos y Miranda, 2000: 185).
En el área de Chamela, Jalisco, la rata de Magdalena comparte su hábitat con otras especies de roedor. Entre ellos se cuenta la rata arborícola vespertina (Nyctomys sumichrasti), la semiarborícola rata arrocera (Osgoodomys banderanus), el ratón pantanero (Peromyscus perfulvus); y roedores terrestres como el ratón espinoso pintado (Liomys pictus), del que se distingue por su mayor tamaño; en contraste, es de menor tamaño que la rata Hodomys alleni. Por lo tanto, X. nelsoni es parte de una rica e interesante comunidad de roedores en las selvas secas.
Relaciones de parentesco filogenético y genética
Los escasos estudios que existen sobre X. nelsoni se refieren principalmente a datos ecológicos y a temas generales sobre la especie; poco se sabe sobre su origen, historia evolutiva y relaciones de parentesco con otros roedores de su familia (Cricetidae). Sin embargo, estudios comparativos de las estructuras reproductivas entre roedores han permitido saber que X. nelsoni está emparentada cercanamente con ratas de bosque, roedores de los géneros Hodomys, Nelsonia y Neotoma, y que forma parte del grupo de especies neotomino-peromyscino. Incluso, se ha dicho que los caracteres únicos de la morfología de Xenomys y Hodomys, en particular de las estructuras reproductivas masculinas, sugieren que el origen de este par de géneros se coloca cerca del ancestro común del numeroso conjunto de especies del género Neotoma, de importante presencia en México (Carleton, 1980: 130). Esta información contribuye de manera importante al conocimiento del origen y evolución de los roedores mexicanos.
No obstante, otros estudios mostraron que Xenomys podría estar más cercano a roedores del género Peromyscus que a Neotoma. El estudio del material genético de la herencia (DNA) de X. nelsoni reveló que este mamífero tiene un número de cromosomas diploide (2n) de 48 (ver figiura 10A). Destaca que comparte con el ratón de los arbustos (Peromyscus boylii) la condición birrámea (un brazo de cada lado del centro del cromosoma) del cromosoma 1, similar al cariotipo de otras especies del género Peromyscus. Esto indica que comparte una ascendencia común con P. boylii en un linaje que posteriormente fue divergente de otros cricétidos (Haiduk, Sánchez y Baker, 1988: 400); por lo tanto, estaría más cercanamente emparentado a Peromyscus que a Neotoma.
Finalmente, ensayos moleculares de secuenciación de genes mitocondriales y nucleares y su análisis filogenético concluyeron que Xenomys está más estrechamente emparentado con Hodomys alleni y el resto de ratas de bosque (Longhofer y Bradley, 2006: 965; ver figura10B).
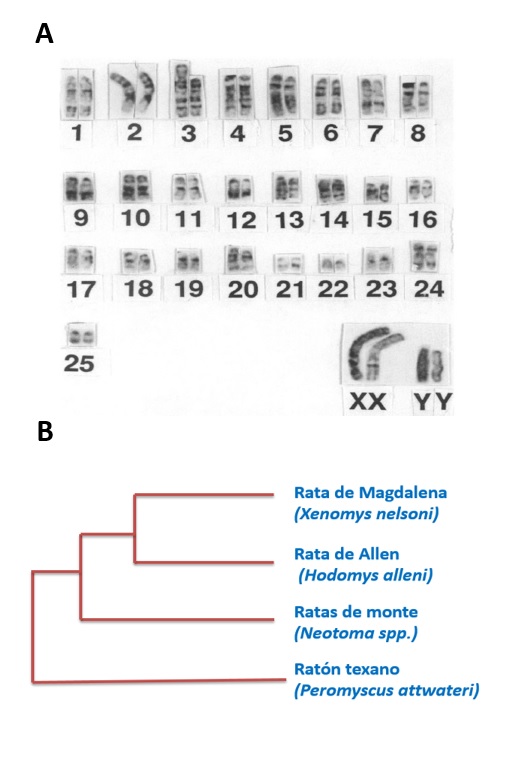
Figura 10. A) Comparación de los cromosomas con bandas G de Peromyscus boylii y X. nelsoni. En cada par de cromosomas el de la izquierda es de P. boylii mientras que el de la derecha es de X. nelsoni (imagen tomada de Haiduk et al., 1988: 400). B) Dendrograma que indica las relaciones de parentesco filogenético de la rata de Magdalena (Xenomys nelsoni; modificado de Longhofer y Bradley, 2006: 965).
Colecciones biológicas
En la Colección Nacional de Mamíferos (CNMA) del Instituto de Biología, UNAM, actualmente se encuentran varios ejemplares de Xenomys nelsoni preparados en forma convencional para estudio científico. Esto incluye pieles, cráneos, esqueletos y tejidos frescos congelados de ejemplares de cada sexo, de distintas categorías de edad (crías, jóvenes, adultos jóvenes, adultos viejos); ninguna otra colección mexicana contiene ejemplares de este roedor. Estos individuos preservados provienen solamente de la región de Chamela, Jalisco (ver figura 11); haciendo visible que no hay ejemplares disponibles en México de la otra zona donde ha sido registrado, ni reportes recientes publicados de su presencia. Sin embargo, se tiene conocimiento de la existencia de 59 ejemplares de este mamífero depositados en colecciones biológicas norteamericanas (Enciclovida, 2019). Sin duda, esta representación científica debería ser un aliciente para promover la atención a este roedor, al menos, entre la comunidad académica.

Figura 11. Ejemplar hembra de la rata de Magdalena (Xenomys nelsoni) preservado en forma convencional (piel, esqueleto y tejidos congelados), para su estudio científico y custodiado por la Colección Nacional de Mamíferos del Instituto de Biología, UNAM (Cervantes et al., 2016b).
Los ejemplares de colección son evidencias científicas que documentan la biodiversidad. Por lo tanto, son muy valiosos ya que muestran las características de la especie, sus registros de presencia en tiempo y espacio, y el tipo de vegetación a la que se encuentran asociados. Los datos derivados de estos ejemplares son de vital importancia para el conocimiento íntegro de la especie en cuestión y sin esta fuente de información resultaría muy difícil elaborar propuestas completas para su conservación.
Categoría de riesgo de extinción y conservación
El gobierno de México considera que la rata de Magdalena se encuentra en la categoría de riesgo de extinción “Amenazada” (Vázquez, 2018). De la misma manera, el organismo internacional International Union for the Conservation of Nature (IUCN) coloca a este roedor en su “lista roja” como “Endangered” (en peligro de extinción; Vázquez, 2018). Su principal amenaza es la destrucción de los bosques tropicales caducifolios o selvas secas (Ceballos y Martínez, 2010: 467), particularmente por el efecto de la fragmentación y pérdida de hábitat debido a la deforestación para la agricultura y el desarrollo (ver figura 12). Gran parte de las selvas secas donde existe X. nelsoni se han convertido en plantaciones de cítricos, palmera y plátano, así como áreas de desarrollo para el turismo. Las dos localidades de Colima donde había sido registrada esta especie se han visto gravemente perturbadas, y no se sabe si la rata de Magdalena hoy en día existe allí. Su hábitat en la costa de Jalisco está protegido sólo por la Reserva de la Biosfera Chamela-Cuixmala (Ceballos y Miranda, 2000: 185). Sin duda, es necesario buscar la presencia de este roedor en un área más grande que en la que se le ha registrado actualmente, pues es probable que exista en lugares remotos aún inexplorados. Sin duda, se requieren estudios detallados con validación de campo de modelado de nicho ecológico que conduzcan a la identificación de nuevos registros de su presencia.

Figura 12. La sobrevivencia de la rata de Magdalena (Xenomys nelsoni) en su ambiente natural depende totalmente de la estructura y función apropiadas del ecosistema del bosque tropical caducifolio, donde la presencia del follaje nutrido de los árboles es un elemento indispensable de las selvas secas (fotografía de G. Ceballos, tomada del Banco de Imágenes de la CONABIO).
Actualmente, biólogos del Instituto de Biología de la UNAM se encuentran investigando diversos aspectos de la historia natural, morfología, genética y evolución de este interesante roedor endémico de México. Sus esfuerzos involucran conocer detalles sobre su tamaño y forma; su estructura craneal y poscraneal. Asimismo, examinan molecularmente muestras de tejidos de individuos de distintas localidades para su identificación molecular; y comparan la variación genética entre grupos de individuos (ver figura 13). Con evidencias morfológicas y genéticas se busca conocer el origen evolutivo de la especie y entender sus relaciones de parentesco con otras especies afines de roedores. Los resultados generados y la difusión de los mismos seguramente contribuirán a su conocimiento integral y a planear acciones para su conservación.

Figura 13. Los resultados del estudio del material genético de la rata de Magdalena (Xenomys nelsoni) en el proyecto internacional Código de Barras de la Vida, en el que participa el Instituto de Biología, UNAM, permitirán distinguir a cada individuo, su sexo y a caracterizar genéticamente a la población a la que pertenece, así como estimar sus niveles de variación genética para motivos de conservación. Las 5 secuencias parciales de la molécula de la herencia (fragmento 370-400 de 550 pares de bases nucleotídicas de ADN) mostradas corresponden al gen mitocondrial Citocromo Oxidasa subunidad I, información central para la elaboración del Código de Barras de ADN.
Sin embargo, es necesario que un mayor número de personas participen en la divulgación de la existencia y conocimiento de este mamífero pequeño único de México y de importancia en la estructura y función de las selvas secas; sobre todo, difundir información sobre el riesgo de extinción en que se encuentra. Afortunadamente, la presencia de esta especie en un área natural protegida como Reserva de la Biosfera, ya es una condición favorable para la protección de sus poblaciones al promover la disponibilidad de su hábitat en condiciones naturales inalteradas de las selvas secas.
Conclusiones
La rata de Magdalena (X. nelsoni) es una especie única de México, de relevancia para el ecosistema en el que habita. Desafortunadamente se trata de una especie en riesgo de desaparición. Por lo tanto, se debe fomentar su estudio y efectuar acciones para que sea del conocimiento de la sociedad. Es necesario que comunidades locales, académicos y estudiantes, organizaciones no gubernamentales y los sectores del gobierno interactúen y diseñen a la brevedad acciones orientadas a la conservación de este mamífero. En consecuencia, las expectativas para la supervivencia de este interesante mamífero dependerán de los esfuerzos que se inviertan en su conocimiento y conservación.
Agradecimientos
Dedicamos esta contribución con respeto y admiración al Dr. Jorge Humberto Vega Rivera, amigo y colega, por su brillante y significativa labor en beneficio de la Estación de Biología Chamela (EBC) del Instituto de Biología, UNAM. Su intenso trabajo e inquebrantable actitud universitaria al frente de esa área natural protegida impactaron favorablemente el estudio y protección de la biodiversidad de la región, la formación académica de numerosos estudiantes y la divulgación del conocimiento sobre las selvas secas. Agradecemos la ayuda de Susana Guzmán Gómez para subir información e imágenes al portal IREKANI.
Referencias
- Bullock, S. H. y Solís, A. (1990). Phenology of canopy trees of a tropical deciduous forest in Mexico. México. Biotropica, 22(1), 22-35.
- Carleton, M. D. (1980). Phylogenetic relationships in neotomine peromyscine rodents (Muroidea) and a reappraisal of the dichotomy within New World Cricetinae. Miscellaneous Publications Museum of Zoology, University of Michigan, 157, 1-146. Recuperado de: https://deepblue.lib.umich.edu/bitstream/handle/2027.42/56401/MP157.pdf?sequence=1&isAllowed=y.
- Ceballos, G., y Miranda, A. (2000). A field guide to the mammals from the Jalisco coast. Fundación Ecológica de Cuixmala-UNAM. Recuperado de: http://www.ecologia-unam.com.mx/wp-content/uploads/2016/02/2000-Gu%C3%ADa-de-Campo-de-los-Mam%C3%ADferos-de-la-Costa-de-Jalisco.pdf.
- Ceballos, G., Martínez, L., García, A., Espinoza, E., Bezaury, J. y Dirzo, R. (2010). Mamíferos. En Ceballos, G. y Martínez, L. (eds.), Diversidad, amenazas y áreas prioritarias para la conservación de las Selvas Secas del Pacífico de México (pp. 119-144). México, D.F.: Fondo de Cultura Económica y Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
- Cervantes, F. A. y Arriaga, S. (2010a). Cráneo de la rata arborícola Xenomys nelsoni [vista dorsal]. En Irekani, registro no. 8634, Instituto de Biología, UNAM. Recuperado de: http://unibio.unam.mx/irekani/handle/123456789/12687?proyecto=Irekani.
- Cervantes, F. A. y Arriaga S., (2010b). Cráneo de la rata arborícola Xenomys nelsoni [vista ventral]. En Irekani, registro no. 8635, Instituto de Biología, UNAM. Recuperado de: http://unibio.unam.mx/irekani/handle/123456789/12681?proyecto=Irekani.
- Cervantes, F. A. y Hernández R., (2016a). Vista dorsal comparativa de pieles de ejemplares de museo de roedores de la tribu Neotomini, familia Cricetidae. En Irekani, registro no. 12091, Instituto de Biología, UNAM. Recuperado de: http://unibio.unam.mx/irekani/handle/123456789/70419?proyecto=Irekani.
- Cervantes, F. A. y Hernández, R. (2016b). Piel de un ejemplar de museo de la rata de Magdalena Xenomys nelsoni. En Irekani, registro no. 12101, Instituto de Biología, UNAM. Recuperado de: http://unibio.unam.mx/irekani/handle/123456789/70423?proyecto=Irekani.
- Cervantes, F. A., Castañón, C., Sánchez, J., Vargas, J. y Hortelano, Y. (2016). Tercer molar inferior derecho de un ejemplar adulto de la rata de Magdalena Xenomys nelsoni. En Irekani, registro no. 11911, Instituto de Biología, UNAM. Recuperado de http://unibio.unam.mx/irekani/handle/123456789/37949?proyecto=Irekani.
- Cervantes, F. A., Ramos, K., Vargas, J. y Montaño, P. (2019a). Ejemplar macho de la Rata de Magdalena (Xenomys nelsoni) en cautiverio. En Irekani, registro no. 12622, Instituto de Biología, UNAM. Recuperado de: http://unibio.unam.mx/irekani/handle/123456789/71436?proyecto=Irekani.
- Cervantes, F. A., Ramos, K., Vargas, J. y Montaño, P. (2019b). Ejemplar macho de la Rata de Magdalena (Xenomys nelsoni) capturado durante el verano. En Irekani, registro no. 12623, Instituto de Biología, UNAM. Recuperado de: http://unibio.unam.mx/irekani/handle/123456789/71437?proyecto=Irekani.
- Cervantes, F. A., Vargas, J., Montaño, P. y Montes de Oca, I. (2019c). Crías y hembra adulta de la rata de Magdalena (Xenomys nelsoni). En Irekani, registro no. 12624, Instituto de Biología, UNAM. Recuperado de: http://unibio.unam.mx/irekani/handle/123456789/71435?proyecto=Irekani.
- Enciclovida. (2019). Rata de Magdalena (Xenomys nelsoni) Recuperado de: http://enciclovida.mx/especies/34397-xenomys-nelsoni.
- Haiduk, M., Sánchez C. y Baker, R. (1988). Phylogenetic relationships of Nyctomys and Xenomys to other cricetine genera based on data from G-banded chromosomes. En Southwestern Naturalist 33(4), 397–403.
- Hayden, B., Greene, D. F. y Quesada, M. (2010). A field experiment to determine the effect of dry-season precipitation on annual ring formation and leaf phenology in a seasonally dry tropical forest. En Journal of Tropical Ecology, 26(2), 237-242.
- Hernández, P., Rodríguez, A. y Jaramillo, J. (2018). Depredación del roedor Xenomys nelsoni por la serpiente Senticolis triaspis en la región de Chamela, Jalisco, México. XIV Congreso Nacional de Mastozoología, Universidad Autónoma de Yucatán y Asociación Mexicana de Mastozoología. Mérida, Yucatán.
- López-Forment C. W., Sánchez, C. y Villa, B. (1971). Algunos mamíferos de la región de Chamela, Jalisco, México [Anales del Instituto de Biología. Universidad Nacional Autónoma de México]. Serie Zoología, 42(1), 99-106.
- Longhofer, L. K. y Bradley, R. 2006. Molecular Systematics of the genus Neotoma based on DNA sequences from intron 2 of the alcohol dehydrogenase gene. Journal of Mammalogy, 87(5), 961–970.
- Mendoza, A. (1997). Heterogeneidad ambiental, dinámica de poblaciones y estructura de comunidades de pequeños mamíferos en una selva tropical caducifolia [tesis de Maestría, Facultad de Ciencias, UNAM].
- Noguera, F., Vega, J., García, A. y Quesada, A. (2002). Xenomys nelsoni Merriam 1892. En Noguera, F. A., Vega Rivera, J. H., García Aldrete. A. N. y Quesada Avendaño, M. (eds.), Historia Natural de Chamela (p. 439). México, D. F.: Instituto de Biología e Instituto de Ecología, UNAM.
- Schaldach, W. (1960). Xenomys nelsoni Merriam, sus relaciones y sus hábitos. Revista de la Sociedad Mexicana de Historia Natural, 21(2), 425–434.
- Tzab Hernández, L. A. y Macswiney González, M. C. (2014). Roedores ¿plagas indeseables o animales útiles? CONABIO. Biodiversitas, 115:12-16.
- Vázquez, E. (2018). Xenomys nelsoni. The IUCN Red List of Threatened Species 2018. Recuperado de: https://www.iucnredlist.org/search?query=xenomys%20nelsoni&searchType=species.
Recepción: 27/03/2019. Aprobación: 03/07/2019.
Vol. 20, núm. 5 septiembre-octubre 2019
El desarrollo sustentable en las instituciones de educación superior: un verdadero desafío
Ana Catalina Bohne García, Mónica Bruckmann Maynetto y Adrián Martínez González CitaResumen
El objetivo del presente artículo es reflexionar sobre los alcances de la crisis socioambiental que enfrentamos hoy en día y la necesidad de impulsar el desarrollo sustentable como alternativa de modelo a seguir para atenuar sus efectos devastadores, mediante la contribución de las instituciones de educación superior (IES). Para ello, se analiza el papel que juegan las IES en la consecución de los objetivos de desarrollo sustentables (ODS), a fin de enfatizar algunas ideas clave para su mejor comprensión. Se concluye con una serie de recomendaciones para avanzar en este tema.
Palabras clave: desarrollo sustentable, instituciones de educación superior, crisis ambiental, desafíos de la educación superior.
Sustainable development at higher education institutions: a true challenge
Abstract
The main goal of this article is to consider the extent of the socio and environmental crisis that we confront today and the need to boost and follow sustainable development as an alternative model to diminish its devastating effects, through the contribution of higher education institutions. To accomplish this, in this paper we analyze the role that institutions have in the pursuit of sustainable development objectives; as to emphasize some key ideas and improve the understanding of sustainable development. Finally, to move forward on this subject, we conclude with a set of recommendations, with the intention to be used by institutions.
Keywords: sustainable development, higher education institutions, environmental crisis, challenges of higher education.
Introducción
La problemática que entraña la crisis socioambiental a la que nos enfrentamos en la actualidad es muy compleja, pues comprende daños al entorno ambiental, social y económico, pilares interdependientes y sinérgicos del desarrollo sustentable. Dicha crisis se inició a partir de la era de la industrialización, en el siglo XVIII, cuando la nueva tecnología impulsó distintos patrones de producción y consumo, que implicaron la sobreexplotación de recursos naturales, principalmente en los países subdesarrollados, a quienes les fue asignado el papel de productores de materias primas (Sachs, 2015).
Dicha sobreexplotación de recursos trajo consigo la emisión de gases contaminantes que, a su vez, provocó la destrucción de la capa de ozono de la atmósfera, el efecto invernadero, la acidificación de océanos, mares y ríos, la destrucción de los hábitats de las especies animales, la desertificación y agotamiento de suelos, la deforestación de bosques y selvas, y la pérdida de diversas especies (en este momento algunas de ellas se encuentran en peligro de extinción), entre otros muchos efectos. Asimismo, los nuevos patrones de consumo generaron enormes cantidades de basura y desechos tóxicos, algunos potencialmente mortales para el ser humano (Sachs, 2015).
La falta de concientización sobre ciertas conductas nocivas –por ejemplo, el desperdicio de energía, agua y alimentos, así como la intensificación de las actitudes individualistas que buscan la satisfacción de intereses propios, sin tomar en cuenta las necesidades de nuestros congéneres y mucho menos de las generaciones futuras– han influido de manera determinante en la crisis por la que atravesamos. Esto repercute en mayor pobreza, desnutrición y miseria de los grupos vulnerables, así como crecientes brechas de desigualdad y conflictos que amenazan la paz mundial (Sachs, 2015).
Los principales factores que han generado la crisis mencionada, según Sachs (2015), son los siguientes:
a. Adopción del modelo económico neoliberal
Dicho modelo ha provocado desórdenes de todo tipo a nivel mundial: ambiental, económico, político y social, entre los que destacan el agotamiento de recursos naturales, el cambio climático, la degradación del medio ambiente, la desigualdad social y diversas formas de delincuencia y corrupción (Estenssoro, 2014).
b. Crecimiento demográfico sin control
Se estima que alrededor de 1750, cuando dio principio la revolución industrial, en todo el planeta había 800 millones de personas aproximadamente, cifra que en la actualidad se aproxima a los 8 000 millones de habitantes y sigue creciendo sin control. De seguir con la misma tendencia, para mediados de este siglo se alcanzarán 9 000 millones, lo que significa que las necesidades del género humano serán de tal magnitud que, muy probablemente, aumentarán los problemas, sobre todo por la escasez de agua y alimentos (Sachs, 2015).
c. Falta de voluntad política
Hasta ahora no se observa que exista voluntad por parte de los gobiernos de los distintos países para frenar el desarrollo del modelo, el cual prosigue su curso, infiltrándose en todos los sectores de la economía, a través de condiciones impuestas por el Fondo Monetario Internacional (FMI) y el Banco Mundial (BM), tales como el condicionamiento para renegociar la deuda externa, efectuar nuevas inversiones o acceder a financiamiento internacional (Estenssoro, 2014).
Una alternativa de solución: el desarrollo sustentable
Al igual que en casi todos los países del mundo, México se encuentra ante un verdadero desafío. Sin duda, el más importante de todos los tiempos: alcanzar una nueva forma de progreso. Por ello, el desarrollo sustentable emerge como una alternativa posible, pero ¿qué se entiende por desarrollo sustentable?
Para comprender qué es y cómo surge este concepto, conviene revisar sus su origen y evolución. En 1962, la bióloga marina Rachel Carson, en su obra La Primavera Silenciosa, dio a conocer el daño que los pesticidas y plaguicidas estaban causando en la salud de los individuos. Este aviso de alerta detonó la necesidad de concientizar a la humanidad sobre la urgente necesidad de proteger el medio ambiente (Carson,1962). Diez años después, se realizó el primer encuentro sobre el tema de la educación ambiental, en Estocolmo, en la Conferencia de las Naciones Unidas sobre el Medio Ambiente Humano; evento que captó la atención mundial sobre la crisis ambiental (Bravo, 2012).
Asimismo, en 1974, un grupo notable de científicos reunidos en el Club de Roma, Salzburgo, Austria, alertó a la humanidad sobre los problemas ambientales y ofreció algunas soluciones, desde la perspectiva de los países que en ese entonces conformaban el primer mundo. Para ello, editaron el documento Los límites del crecimiento, en el que dieron a conocer los resultados a los que habían llegado (Estenssoro, 2014).
Fue hasta 1987, cuando la Comisión Mundial de Medio Ambiente y Desarrollo logró el consenso entre científicos y políticos y se emitió Nuestro Futuro Común, difundido con el nombre de Informe Brundtland (Estenssoro, 2014). En dicho documento se definió el término desarrollo sustentable, mismo que ha sido ampliamente aceptado a nivel mundial. Dicho concepto, que aún se encuentra en evolución, se expresa de la siguiente manera: “El desarrollo sustentable es el desarrollo que satisface las necesidades de la generación presente, sin comprometer la capacidad de las generaciones futuras para satisfacer sus propias necesidades”. Al analizar esta definición se puede observar un sentido ético, al pensar en las generaciones futuras, y uno ecológico, al aludir a la naturaleza y referirse a la necesidad de mantener la capacidad de recuperación del ecosistema mundial.
Como una forma de complementar el concepto, Pérez (2009) menciona que el nuevo planteamiento del desarrollo implica una verdadera transformación de la sociedad, donde se contemplen los valores fundamentales referidos a la preservación ambiental, equidad en la distribución de los ingresos, igualdad de oportunidades, justicia y seguridad. El desarrollo sustentable comprende no sólo el cuidado del medio ambiente, sino el crecimiento económico competitivo y una distribución más justa de la riqueza, así como la consideración de los derechos humanos, por lo que, de manera esquemática, se puede apreciar como la intersección de tres dimensiones.
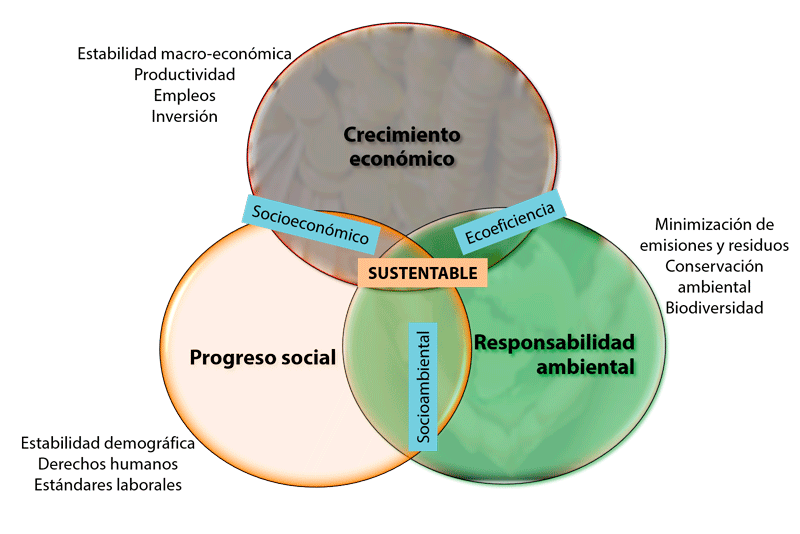
Figura 1. Dimensiones del desarrollo sustentable. Elaboración propia a partir de Munasinghe y Cruz (1995: 8).
Más adelante, en 1998, se llevó a cabo la celebración de la Conferencia Mundial sobre la Educación Superior para el Siglo XXI, en la ciudad de París, donde se hizo un reconocimiento de la importancia estratégica de la educación superior para atender la crisis ambiental (Tünnermann, 2010). Desde esa fecha hasta nuestros días se han desarrollado múltiples reuniones en torno al desarrollo sustentable; sobresalen dos. En lo referente a educación ambiental, la de Johannesburgo, Sudáfrica, en la que se declaró el Decenio de Naciones Unidas para el Desarrollo Sustentable 2005-2014 y se promovió la elaboración de planes de acción para orientar el desarrollo sustentable en las instituciones de educación superior. Y la relativa a la Agenda Global de la ONU, realizada en 2015, donde se establecieron los ODS como eje del cambio del mundo entero a través de sus 17 objetivos y 169 metas a alcanzar para el año 2030. De esta manera, cada institución estaría comprometida, a su vez, a contribuir en la consecución de este gran reto mediante acciones muy concretas. La figura 2 proporciona una mirada general de la evolución histórica del desarrollo sustentable y sus principales hitos en el período 1962-2015.
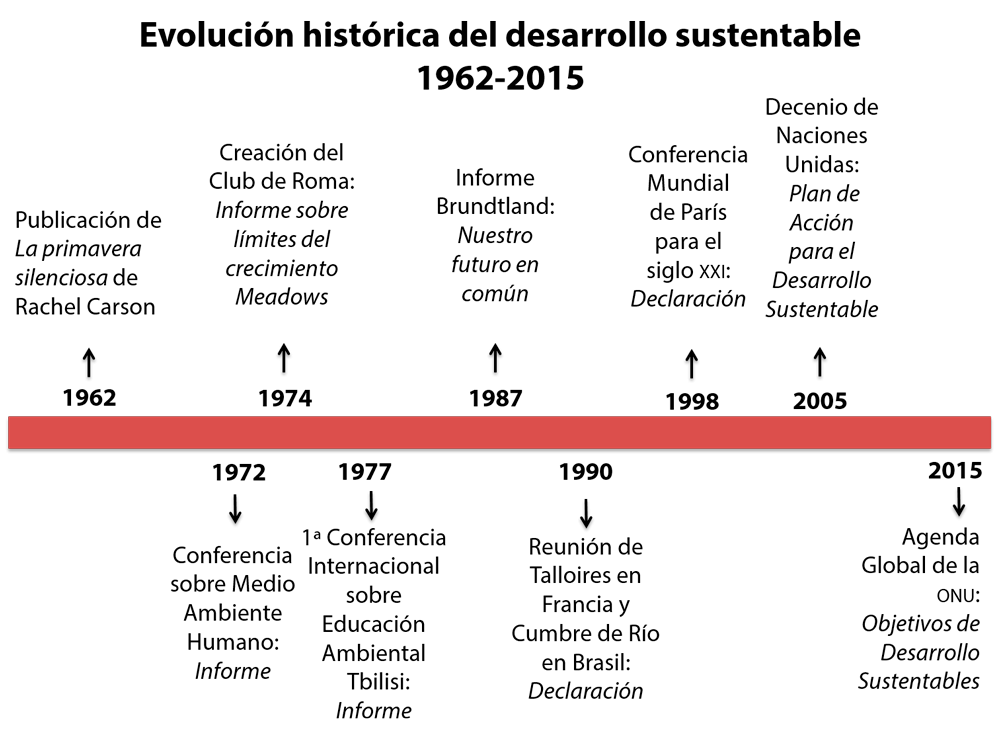
Figura 2. Evolución histórica del desarrollo sustentable. Fuente: elaboración propia con base en los documentos citados.
Las acciones con miras a detener la degradación que la industrialización del mundo moderno ha propiciado son muy diversas y van desde reuniones cumbre a nivel mundial hasta regionales, abarcando la firma de convenios internacionales, donde los países se han comprometido a asumir conductas para prevenir los efectos dañinos de la contaminación. Sin embargo, en los hechos se observa la falta de voluntad política para realizar acciones concretas. Lo anterior refleja una incapacidad de política económica, que se traduce en planeaciones a corto plazo que no consideran al desarrollo sustentable con alta prioridad. Ante esta situación, el desarrollo sustentable es una alternativa para alcanzar un mundo mejor, donde no sólo haya prosperidad económica para todos, sino que se respete la naturaleza y los derechos humanos.
Papel central de las instituciones de educación superior
En este contexto, las instituciones de educación superior (IES) juegan un papel central, pues constituyen un sector estratégico para el desarrollo de las sociedades. Tradicionalmente, las IES se han destacado por su importante contribución al desarrollo sustentable en lo relativo a su dimensión social, mediante sus funciones sustantivas, a saber:
1. La formación integral de los estudiantes como:
- Profesionales y futuros líderes que llevarán a cabo la transformación del país hacia la sustentabilidad.
- Ciudadanos participativos en la realización de acciones de carácter sustentable.
- Personas con principios y valores interesados en la transformación de la sociedad a través de una nueva cultura basada en lo sustentable.
2. La generación y transmisión de nuevos conocimientos científicos y tecnológicos a ser utilizados como:
- Palancas del desarrollo que impactarán en la construcción del proyecto de nación sustentable al que se aspira.
3. Extensión y difusión de la cultura como:
- Responsables ante el Estado por la vinculación con los sectores privado y social para el desarrollo de proyectos conjuntos de carácter sustentable en favor de las comunidades.
- Beneficios de una nueva cultura sustentable a la sociedad.
Actualmente, su actuación sustentable se encuentra enmarcada en la Agenda de la ONU 2030. El objetivo número cuatro de los ODS, “Educación y calidad” está orientado a garantizar una educación inclusiva y de calidad y promover oportunidades de aprendizaje durante toda la vida para todos, contemplando, dentro de sus acciones, el acceso a la educación superior de calidad, la equidad de género, la educación para el desarrollo sustentable y un mayor número de profesionales de la docencia.
Pero ¿qué están haciendo las IES para contribuir a un mundo mejor?
La respuesta que han dado las IES para transitar hacia la sustentabilidad se aprecia de manera formal en su misión, visión y funciones –tanto sustantivas como de apoyo–; no sólo en todas las áreas de conocimiento –científico, tecnológico, artístico, y humanístico–, sino en sus procesos educativos –desarrollo curricular, enseñanza-aprendizaje, formación de profesores e investigadores–, y en todos los niveles de formación –licenciatura, posgrado, educación continua, así como en la investigación y en la extensión universitaria–. Desde la perspectiva de la Administración, las IES han ido integrando la visión del desarrollo sustentable en todo su quehacer educativo, desde la planeación, organización, dirección y control de sus actividades, hasta la implementación de nuevas prácticas sustentables como parte de sus operaciones diarias (Bravo, 2012).
En el caso de la Universidad Nacional Autónoma de México (UNAM), desde 1991 se puso en marcha el Programa Universitario de Medio Ambiente (PUMA), con el propósito de reducir el impacto sustentable y formar profesionistas comprometidos con el medio ambiente, mediante diversos ejes temáticos. Dicho proyecto actualmente se conoce como Programa Universitario de Estrategias para la Sustentabilidad (PUES), el cual consiste básicamente en identificar la infraestructura y equipamiento de los inmuebles en todas las entidades académicas a fin de recopilar información sobre el consumo de energía, agua y manejo de residuos en aulas, oficinas, laboratorios, pasillos y otros espacios; así como captar datos reales sobre los hábitos de consumo relacionados con los bienes y útiles de oficina, limpieza y emisiones producidas por los automotores. Dicha información permite obtener un diagnóstico como punto de partida para encauzar acciones hacia compras orgánicas, no contaminantes, reciclables, mantenimiento de áreas verdes, gestión sustentable del tránsito y administración de riesgos y contingencias ambientales.
Asimismo, en 2011, la UNAM implementó el Programa Universitario de Estudios del Desarrollo (PUED), enfocado a la búsqueda de soluciones a los grandes problemas de carácter económico y social de nuestro país, dando prioridad al desarrollo humano igualitario y sustentable. Este programa reviste gran importancia, pues mediante formulaciones y discusiones de un grupo de investigadores contribuye a la generación de proyectos alternativos para el desarrollo y aporta nuevos contenidos al proyecto de país al que aspiramos los mexicanos en un entorno globalizador como el actual.
Importancia de un modelo de evaluación
Las acciones, sin embargo, son insuficientes, ya que existen grandes retos en la educación superior en México, a los que deben responder las IES, pero desde una posición humanista que implique alcanzar un mundo sustentable. De ahí la gran importancia de introducir un modelo de evaluación de la efectividad de las IES que permita conocer la situación que priva a la fecha, en su contribución al desarrollo sustentable, y recomendar las acciones concretas a seguir. Dicho modelo debe considerar el contexto global de los ODS conforme los establece la ONU (2016), el Plan Nacional de Desarrollo del país, los programas sectoriales respectivos y los planes institucionales de las IES. Además, requiere integrar el desarrollo sustentable en las tres funciones sustantivas de las IES y en su propia gestión interna desde la perspectiva de la administración sustentable, bajo el enfoque de sistemas, como se muestra en la figura 3.
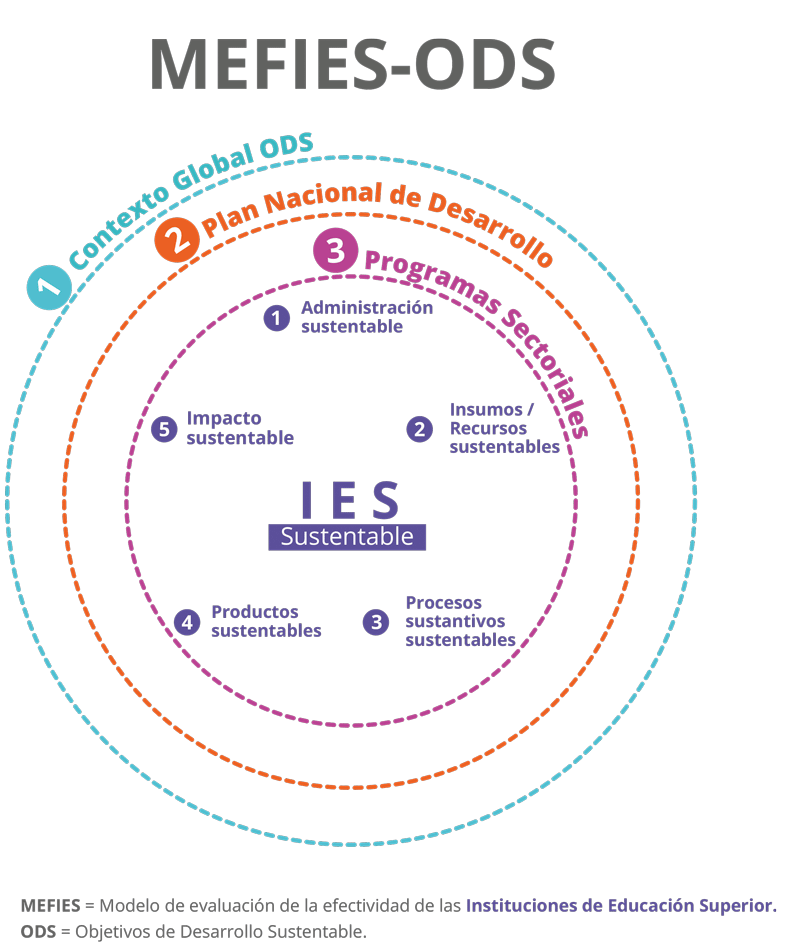
Figura 3. Modelo de Evaluación de la Efectividad de las Instituciones de Educación Superior (MEFIES) que considera el contexto de los Objetivos de Desarrollo Sustentable (ODS) de acuerdo con la ONU.
Conclusiones y recomendaciones
En la actualidad, las IES están más conscientes de las amenazas que pesan sobre su medio ambiente natural y humano. No obstante, a pesar del sinnúmero de reuniones internacionales, convenios y tratados celebrados, así como los múltiples y variados esfuerzos realizados, no cuentan aún con los medios necesarios para resolver la problemática existente. Esto hace imperativo enfocarse y acelerar el ritmo de trabajo de cada una de las partes involucradas para detener los efectos devastadores de la crisis socioambiental sobre nuestro planeta.
Ante la magnitud de dicha problemática, se hace necesario repensar el modelo de crecimiento y progreso ideal para la humanidad, donde los recursos se utilicen de manera eficiente y equitativa. Tal alternativa se encuentra aún en un estado teórico embrionario, a pesar de que a lo largo de casi medio siglo se ha avanzado en la conceptualización del desarrollo sustentable y se han realizado acciones importantes a nivel mundial, nacional y local. El proceso ha sido lento por las dificultades existentes para lograr consenso entre los actores involucrados –quienes poseen intereses opuestos–, por lo que se requiere promover estudios inter y transdisciplinarios sobre el desarrollo sustentable, a fin de contar con un cuerpo teórico que permita explicar e interpretar este fenómeno de carácter complejo.
Las IES enfrentan desafíos muy importantes para estar a la altura de las exigencias del mundo moderno, pero deben hacerles frente sin perder su origen y esencia eminentemente social, de búsqueda de la verdad sin condiciones, sin espíritu de lucro. En este sentido, los ODS de la Agenda 2030 de la ONU se deben establecer como eje fundamental del trabajo a realizar en esta materia, en pre y posgrado.
Atendiendo a lo establecido en las políticas gubernamentales y los lineamientos específicos emitidos en el sector, las IES están realizando esfuerzos muy importantes mediante la adecuación de sus estructuras, planes y programas, así como de procesos educativos, investigación y prácticas de gestión.
No obstante, falta mucho por hacer, pues el impacto logrado es significativamente menor y más lento que el deterioro ecológico; en tanto que la problemática económica y social a la que nos enfrentamos continúa sin mejora sustancial, impidiéndose alcanzar una sustentabilidad integral. Es por ello que se propone fortalecer las redes interuniversitarias y la vinculación con otras asociaciones e instituciones del sector público, privado y social para extender las acciones en la materia e impactar en la sociedad, fomentando proyectos comunitarios y alianzas con organismos para apoyar la creación y aplicación de políticas públicas que incluyan la sustentabilidad.
Se requiere partir de una autoevaluación integral, considerando las tres esferas de la sustentabilidad: económica, social y ambiental. Dicha evaluación debe señalar las áreas de oportunidad de las IES para incorporarlas como metas y acciones en los planes institucionales y darles un estrecho seguimiento para mejorar continuamente en beneficio del ser humano y de su permanencia como especie en este planeta.
Referencias
- Bravo, M. T. (2012). La UNAM y sus procesos de ambientalización curricular. Revista Mexicana de Investigación Educativa, 17(55), octubre-diciembre, 1119-1146.
- Carson R. L. (1962). Silent Spring. Boston, Nueva York: Mariner Books-Houghton Mifflin Harcourt.
- Estenssoro F. (2014). Historia del debate ambiental en la política mundial 1945-1992. La perspectiva latinoamericana. Santiago de Chile: Lom Ediciones.
- Munasinghe, M. y Cruz, W. (1995). Economywide policies and the environment: lessons from experience (english). World Bank environment paper; no. 10. Washington, D.C.: The World Bank. Recuperado de: http://documents.worldbank.org/curated/en/331501468765917402/Economywide-policies-and-the-environment-lessons-from-experience.
- Pérez, D. (2009). Eco – desarrollo y sustentabilidad. Hacia un modelo teórico que promueva alianzas estratégicas entre la universidad y el sector productivo. Sapiens. Revista Universitaria de Investigación, 10(1), junio.
- Sachs, J. D. (2015). The Age of Sustainable Development. Nueva York: Columbia University Press.
- Tünnermann, C. (2010). Conferencias regionales y mundiales sobre educación superior de la UNESCO y su impacto en la educación superior de América Latina. Unión de Universidades de América Latina y el Caribe. Universidades, 47, septiembre-diciembre, 31-46. Recuperado de: http://www.redalyc.org/articulo.oa?id=37318570005.
- Universidad Nacional Autónoma de México (UNAM) (s. f.). Programa Universitario de Estrategias para la Sustentabilidad (PUES). Recuperado de: http://132.248.61.12/.
- Universidad Nacional Autónoma de México (UNAM) (s. f.). Programa Universitario de Estudios del Desarrollo (PUED). Recuperado de: http://www.pued.unam.mx/.
Recepción: 27/05/2019. Aprobación: 09/07/2019
Vol. 20, núm. 5 septiembre-octubre 2019
Resistencia a antibióticos: cuando nuestro armamento se torna ineficiente
Carlos Alberto Lobato Tapia CitaResumen
Prácticamente todos hemos necesitado de la administración de algún antibiótico para recuperarnos de cierta infección. Estas sustancias han sido vanagloriadas desde el inicio de su descubrimiento, con ellas nuestra esperanza de vida se ha incrementado de manera significativa y difícilmente nos podríamos imaginar el curso de la humanidad sin su presencia. Sin embargo, no todo es miel sobre hojuelas y, en muchos casos, los que en un principio eran nuestros aliados, actualmente están dejando de ser útiles contra muchas especies bacterianas. Esta situación se ha generado por ciertos mecanismos de resistencia en las bacterias, básicamente debido a la mutación de algunos de sus genes y su transferencia entre ellas. Si la tendencia continúa y no hacemos algo, nos quedaremos sin armas para defendernos de los microorganismos que nos afectan, ¡regresando a las condiciones en las que nos encontrábamos hace casi 70 años!, con una esperanza de vida menor y elevadas probabilidades de padecer epidemias que en estos días aún podemos controlar. En este artículo se presentan una descripción de la situación, los mecanismos que causan la resistencia, así como algunas recomendaciones de la Organización Mundial de la Salud (OMS), todo ello con la finalidad de hacer conciencia sobre el uso de antibióticos con un fundamento claro.
Palabras clave: resistencia a antibióticos, bacterias, genes resistentes.
Antibiotic resistance: when our armament becomes obsolete
Abstract
Practically we all have needed the administration of an antibiotic to recover from an infection. These substances have been so praised since the beginning of their discovery; with them our life expectancy has increased significantly and we could hardly imagine the course of humanity without them. However, not everything is hunky-dory and, in many cases, what were originally our allies are currently becoming non-useful against many bacterial species. This situation has been generated by some resistance mechanisms in bacteria, caused by the mutation of some of their genes and its transfer among them. If this trend continues and we do nothing about it, we will run out of weapons to defend ourselves against the microorganisms that affect us, returning to the conditions in which we were almost 70 years ago! with a lower life expectancy and high probabilities of suffering epidemics that in these days we can still control. In this article we provide a description of the situation, the mechanisms that cause resistance, as well as some World Health Organization (WHO) recommendations; all with the purpose to make conscience about the use of antibiotics with a clear fundament.
Keywords: antibiotic resistance, bacteria, resistant genes.
Introducción
Empecemos definiendo qué son los antibióticos. La OMS los define como aquellos medicamentos utilizados para prevenir y tratar las infecciones bacterianas (OMS, 2018). El descubrimiento de estos compuestos se ha considerado, por mucho tiempo, como uno de los logros médicos más importantes del siglo XX, pues gracias a ellos se han salvado millones de vidas y además permiten la realización de procedimientos médicos, que de otra manera serían complicados o imposibles, como las cirugías y quimioterapias contra el cáncer (OMS, 2018; WHO, 2017).
El primer compuesto catalogado como antibiótico fue el obtenido por Paul Ehrlich en 1910, conocido con el nombre de Salvarsán, un tratamiento para la sífilis, enfermedad causada por una bacteria de tipo espiroqueta (Treponema pallidum). Y aunque demostró buena eficacia, también presentó una elevada toxicidad, seguramente debido a que su composición presenta átomos de arsénico (Lloyd, Morgan, Nicholson, y Ronimus, 2005). Aunado al descubrimiento de Ehrlich y al uso de sulfas en los fármacos, se sintetizó, por científicos de la empresa farmacéutica Bayer, otro antibiótico denominado Prontosil. Sin embargo, posteriormente se demostró que Prontosil era el precursor de una sustancia que en realidad causaba el efecto, la sulfonamida, el cual, ya era bastante utilizada en la industria del tinte varios años atrás, impidiéndose, por lo tanto, patentar su registro. Este hecho trajo consigo su producción y uso en masa, favoreciendo así, desde esos momentos, la generación de resistencia por parte de los microorganismos (Aminov, 2010).
Seguido de estos dos hallazgos, en 1929 Alexander Fleming reporta en sus cultivos de estafilococos (grupo de bacterias de las cuales varias son patógenas) el crecimiento de un moho, hongo del género Penicillium (similar al que nos encontramos en alimentos como el pan o tortillas después de varios días) y alrededor de éste se mostraba un espacio sin crecimiento de bacterias, espacio conocido como “halo de inhibición” (ver figura 1). Manifestándose, entonces, que dicho moho posee alguna sustancia que impide el crecimiento de las bacterias. Además, Fleming observó que no sólo inhibía el crecimiento de bacterias del género estafilococo, sino de muchas otras bacterias de importancia clínica (Fleming, 1929).
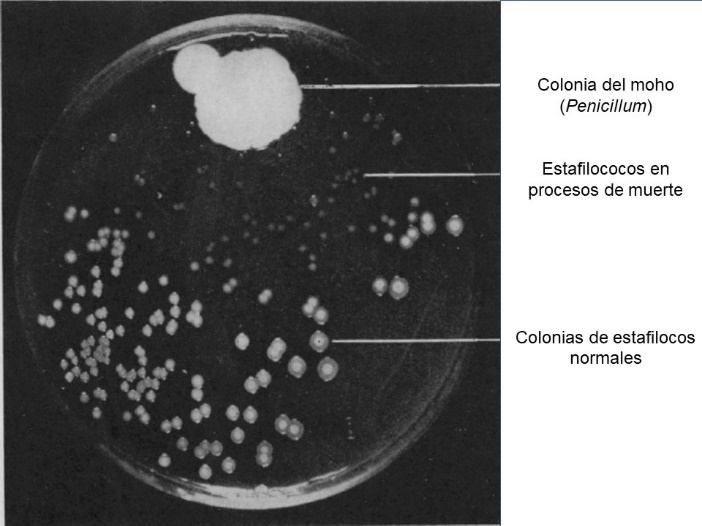
Figura 1. Fotografía del cultivo de bacterias de Fleming, contaminado con un moho del género Penicillium.
Casi 10 años después, dos científicos de la Universidad de Oxford, Howard Florey y Ernest Chain, consiguen aislar del moho el compuesto responsable de la destrucción bacteriana en los cultivos de Fleming, la penicilina (Kardos y Demain, 2013). Iniciando así, la era de los antibióticos, desarrollándose nuevas y mejores sustancias en las siguientes dos décadas, como la estreptomicina (contra la tuberculosis y bacterias gran negativas sensibles), cloranfenicol (tratamiento para infecciones externas del ojo), tetraciclina (usado para actinomicosis, infecciones del tracto genitourinario, faringitis, neumonía, otitis media aguda y sinusitis, entre otras), vancomicina (contra cocos y bacilos grampositivos así como contra enterococos), quinolona (se emplean en infecciones del tracto urinario, enfermedades de transmisión sexual, osteomielitis crónica, infecciones del tracto respiratorio e infecciones sistémicas graves), entre otras (Katzung, 2015; Saga y Yamaguchi, 2009).
Mecanismos de resistencia a antibióticos
Pero cuál es el problema si se ha demostrado que estos compuestos son eficaces y su objetivo es aliviar o prevenir enfermedades infecciosas. La situación va de la mano con la evolución, y las bacterias (como todos los organismos) también evolucionan, en este caso, para sobrevivir del daño que les causan los antibióticos, originándose lo que conocemos como resistencia a los antibióticos. Dicha resistencia la podemos definir como la reducción en la efectividad de un fármaco para curar o mejorar los síntomas de una enfermedad (Peet, 2010).
Cabe aclarar que, al hablar de resistencia a antibióticos, nos referimos a que las bacterias son las resistentes a antibióticos y no nosotros, es decir, las resistentes al antibiótico son ellas. Las causas de volverse menos susceptibles a los antibióticos radican, como se mencionó, en su naturaleza evolutiva y con ello, la de adaptarse. Sin embargo, contrario a lo que pudiera entenderse, dicha adaptación es meramente azarosa, y no implica que las bacterias sean conscientes de ello o que lo propicien. Simplemente, son mutaciones genéticas aleatorias que les han permitido sobrevivir, como ocurre con todos los seres vivos. En especies como la nuestra, los cambios se aprecian muy poco, ya que de una generación a otra hay muchos años y las observamos sólo por los restos fósiles que se van encontrando. En cambio, en las bacterias, al tener una tasa de reproducción bastante elevada (una bacteria de Escherichia coli se divide cada 30 minutos aproximadamente, originando varios billones de bacterias en menos de 24 horas), sus modificaciones son visibles en un corto período de tiempo. Estas modificaciones, originadas por mutaciones aleatorias, pueden ser favorables o perjudiciales y solamente persistirán aquellas especies que tienen las mutaciones favorables (Alberts et al., 2002). Así, aquellas bacterias que no presentan la mutación benéfica (resistencia a antibióticos) morirán, pero aquellas que sí cuentan con esa mutación sobrevivirán y su descendencia continuará con esa característica.
Dichas mutaciones genéticas han originado procesos que permiten evadir la acción de los antibióticos en las bacterias, como los siguientes (ver figura 2):
- Elaboración de enzimas capaces de degradar los antibióticos.
- Modificar estructuras celulares, de tal forma que los antibióticos no puedan ingresar en ellas y realizar su función.
- Producción de bombas de salida, que devuelven el antibiótico hacia el exterior de la célula.
- Alterar la forma del sitio donde el antibiótico tendría que unirse, impidiendo así su unión y efecto (Oromí, 2014; Tafur y Villegas, 2008).
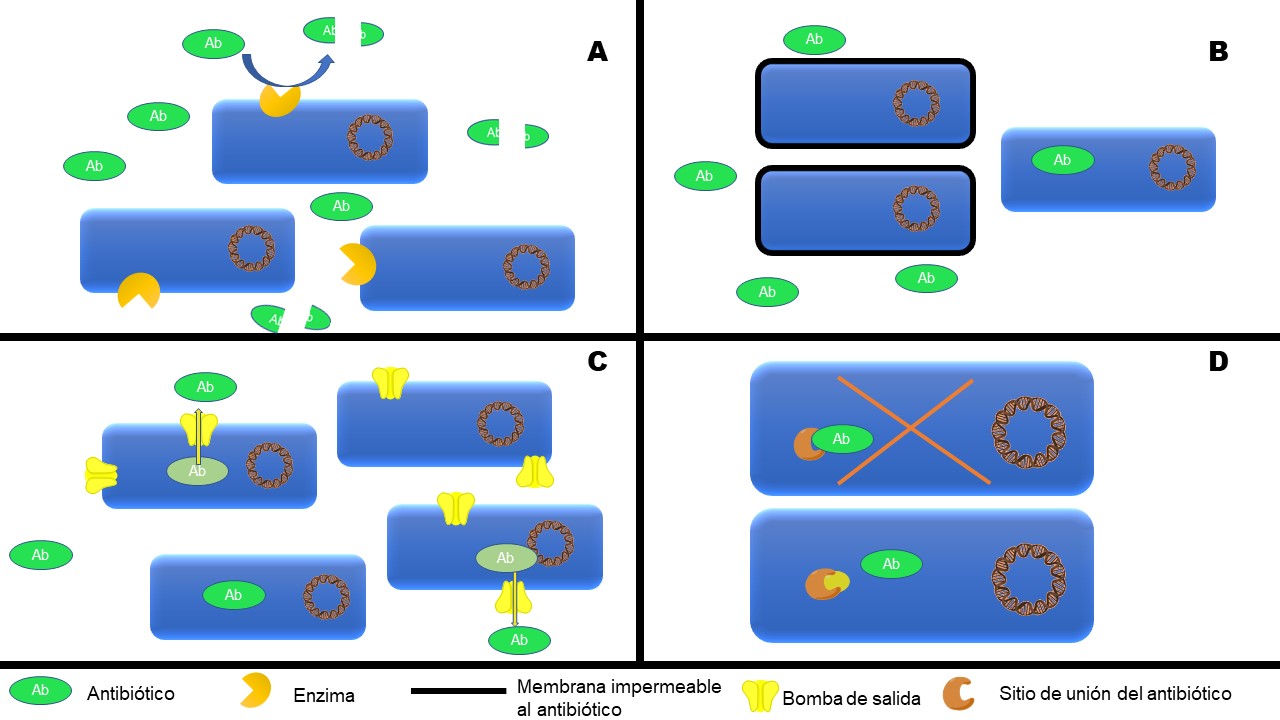
Figura 2. Mecanismos de resistencia a antibióticos. A) Elaboración de enzimas. B) Modificación estructural. C) Bombas de salida. D) Alteración del sitio de unión del antibiótico.
Estos genes “resistentes” son seleccionados en unas cuantas bacterias expuestas a los antibióticos y se ubican en compartimentos pequeños y alejados del resto del material genético, llamados plásmidos –pequeñas moléculas de Ácido Desoxirribonucleico (ADN) circular, independientes del cromosoma bacteriano–, por lo que esos fragmentos génicos son más fáciles de difundirse de una bacteria a otra. Esta situación favorece el intercambio de los genes entre diferentes bacterias, permitiendo que bacterias que no eran resistentes, ahora lo sean. Hay diferentes formas en que las bacterias transfieren esa información (ver figura 3), algunos de los procesos de transferencia que se conocen hasta el momento son:
Transducción. Mecanismo llevado a cabo por bacteriófagos (virus que infectan bacterias), los cuales además de insertar su material genético, también pueden llevar algunos genes de otras bacterias.
Conjugación bacteriana. La transferencia de los genes ocurre por contacto directo de bacteria a bacteria y el material genético pasa a través de una especie de puente que conecta a ambas.
Transformación. Este proceso comprende la captación de ADN libre en el medio extracelular hacia la bacteria, seguida de la integración en su material genético y su posterior expresión (utilización).
Agentes de trasferencia génica. Son partículas parecidas a los bacteriófagos que transportan fragmentos génicos de la célula que los libera o produce, éstos salen de la célula y se internalizan en otra (Sánchez, Muñoz, y Gutiérrez, 2012; von Wintersdorff et al., 2016).
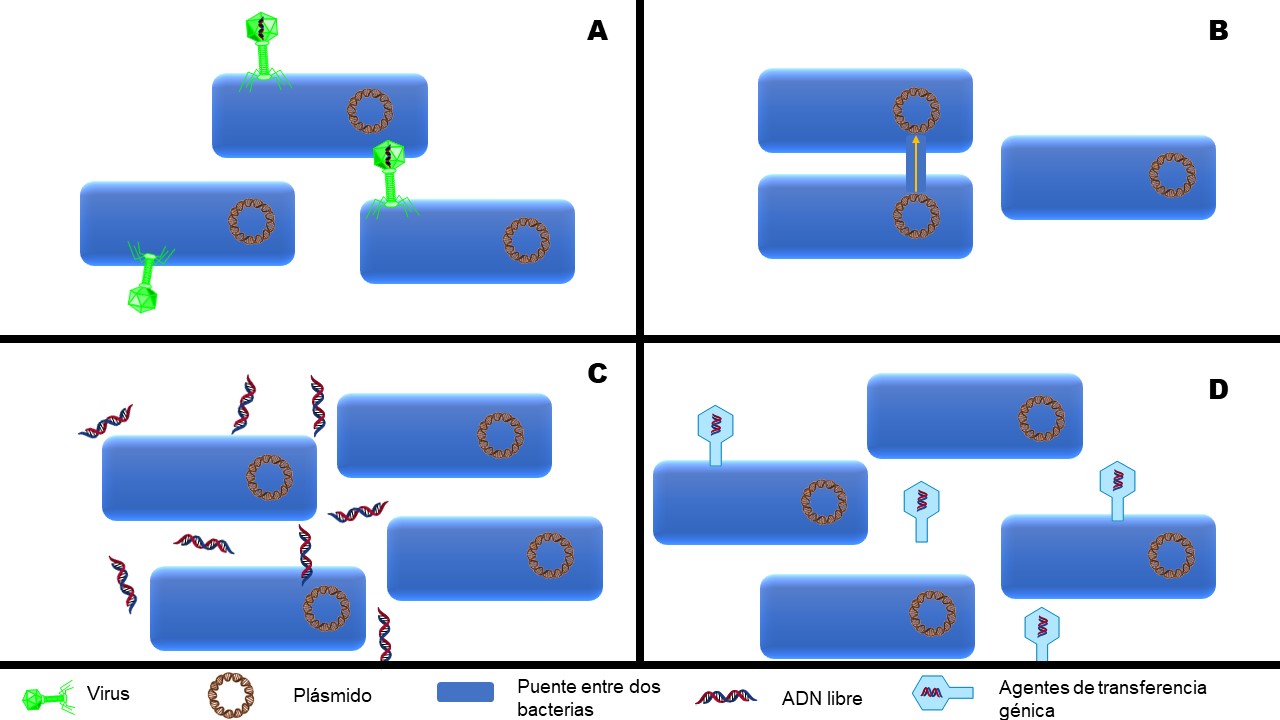
Figura 3. Mecanismos de transferencia de genes resistentes. A) Transducción. B) Conjugación bacteriana. C) Transformación. D) Agentes de trasferencia génica.
Uso indiscriminado de antibióticos
Está de sobra mencionar que los antibióticos nos han ayudado como especie a extender nuestras expectativas de vida, permitiendo recuperarnos de enfermedades infecciosas que, sin ellos, acabarían con nuestras vidas fácilmente. Sin embargo, eso nos ha llevado a su uso exagerado e indiscriminado. Esta razón parece ser la causa de que ahora dichas sustancias comiencen a ser inefectivas ante pequeñas variaciones de los mismos microorganismos, que antes caían inmediatamente ante su poder. Lo más sorprendente es que, desde 1949, Fleming ya advertía del peligro que pudiera traer el uso exagerado de antibióticos (Fleming, 1945).
Así, los antibióticos se usan sin ninguna restricción, se recetan prácticamente por todo tipo de personas, pasando desde los padres que deciden administrarlos a sus hijos sin una valoración médica, cuando nos automedicamos y acudimos a la farmacia, con los vecinos o amigos en busca de algún antibiótico para mejorar algún malestar corporal, e incluso prescritos por médicos para tratar un catarro, cuando su origen es viral (Gérvas, 2000).
Por otro lado, los antibióticos no se emplean únicamente para atender enfermedades en seres humanos, también se utilizan para tratarlas en animales. Por ejemplo, si tu mascota tiene alguna infección de origen bacteriano, lo más probable es que el veterinario le administre antibióticos. Sin embargo, su uso no se enfoca únicamente al tratamiento de mascotas, sino que va más allá, empleándose para tratar enfermedades infecciosas que aquejan a aquellos animales destinados a consumirse como alimento (ganado vacuno, porcino, bovino, peces, etcétera).
Asimismo, se utilizan para prevenir la propagación de enfermedades e incluso para promover un crecimiento más rápido en los animales, aplicando bajas concentraciones de antibióticos, y aunque este último uso se empieza a prohibir en varios países, sigue practicándose en muchos otros (Food and Agriculture Organization [FAO], 2017; Ventola, 2015). El problema ocurre cuando los antibióticos son excretados y llegan a diferentes sitios, propagándose por el medio ambiente, generando así una mayor exposición con los microorganismos e incrementando la probabilidad de originar resistencia a antibióticos.
La participación de la microbiota en la resistencia a antibióticos
La facilidad de compartir información es crucial en la propagación de la resistencia a antibióticos, causando que cada vez más se encuentren variedades bacterianas resistentes (cepas) que antes no lo eran (Sánchez et al., 2012). ¿Y cómo afecta esa situación en conjunto con el uso indiscriminado de los antibióticos? Ocurre que al no completar un tratamiento favorecemos que algunas bacterias sobrevivientes, con mutaciones que las hacen resistentes a antibióticos, las transfieran a bacterias vecinas, mediante los procesos de transferencia que se describieron anteriormente.
Además, otro aspecto importante, y que tal vez ni nos imaginamos que ocurre, es la existencia de miles de millones de microorganismos (incluyendo bacterias) que viven dentro de nosotros y que influyen en nuestro desarrollo, fisiología, inmunidad y nutrición, formando parte de lo que conocemos como microbiota. De manera general, estos microorganismos (como los lactobacilos) habitan en sitios con tejido mucoso de nuestro cuerpo y una de sus funciones es impedir el crecimiento de microorganismos patógenos, bloqueando posibles infecciones (Vergara et al.2014).
Los antibióticos no distinguen a las bacterias patógenas de las bacterias buenas, por lo que éstas también son susceptibles al ataque de dichas sustancias y, por ende, también de desarrollar mutaciones que favorecen la aparición de genes resistentes a los antibióticos. Así, se ha demostrado que nuestra microbiota, una vez expuesta a los antibióticos, es una fuente importante de genes resistentes y un reservorio potencial para que bacterias patógenas se vuelvan más resistentes (Baron, Diene, y Rolain, 2018). Lo que ocurre tanto en una infección, como cuando se toman antibióticos y no es necesario, es la aparición de bacterias resistentes, propias de nuestra microbiota, con la capacidad latente de transferir esa resistencia a bacterias patógenas.
Más allá de la resistencia a antibióticos
Como un aspecto adicional y, por si fuera poco, las bacterias no sólo generan resistencia a antibióticos, sino que ésta también se ha desarrollado contra los antisépticos y desinfectantes, productos ampliamente comercializados y utilizados tanto en el hogar como en hospitales, centros de salud y laboratorios para evitar la propagación de patógenos. Pero, nuevamente, su uso exagerado y en situaciones innecesarias ha favorecido la aparición de variantes bacterianas resistentes también a ellos (Cabrera, Gómez y Zúñiga, 2007).
Por otro lado, existe un desinterés de la industria farmacéutica en desarrollar nuevos antibióticos, pues al poco tiempo surgen variedades bacterianas resistentes para el nuevo fármaco y, en algunos casos, se sigue prefiriendo el uso de antibióticos previos, por su eficacia y economía. Todo ello genera pocas ganancias para la industria, por lo que la inversión ya no es redituable. Finalmente, la obtención de nuevos antibióticos y su aprobación ante los órganos regulatorios correspondientes se ha tornado más difícil para las compañías, lo que las desalienta. De esta manera, como se menciona anteriormente, la industria ha desatendido el desarrollo de este nuevo tipo de productos (Ventola, 2015), dejándonos así sin nuevas armas contra las bacterias resistentes y con alta capacidad infectiva.
Recomendaciones a nivel mundial
Debido a todo lo anterior, es clara la preocupación de los organismos de salud, por lo que la OMS declara que la resistencia a antibióticos es hoy una de las mayores amenazas para la salud mundial, la seguridad alimentaria y el desarrollo, pudiendo afectar a cualquier persona independientemente de su edad o el país en el que viva. Así, se incrementa cada vez más el número de infecciones difíciles de tratar debido a la ineficacia de los antibióticos (OMS, 2018).
Ante esta situación crítica, la OMS ha propuesto algunas estrategias claves para prevenir y controlar la propagación de resistencia a antibióticos tales como usar y prescribir antibióticos sólo cuando sean necesarios, no utilizar aquellos que hayan sobrado, cuidar los aspectos básicos de higiene como el lavado de manos y la preparación higiénica de los alimentos, favorecer la prevención de enfermedades infecciosas antes de usar antibióticos, reportar la resistencia de alguna bacteria, así como generar y atender las campañas sobre el buen uso de los antibióticos. La parte agrícola también debe favorecer la higiene para prevenir enfermedades y el uso correcto de antibióticos, al no administrarlos como preventivos ni para el crecimiento del ganado (OMS, 2018).
Por otro lado, el plan de acción de la FAO se basa en desarrollar una capacidad para la vigilancia y el seguimiento de la resistencia a antibióticos en la alimentación y agricultura, promover buenas prácticas en los sistemas alimentarios y agrícolas, basándose en el uso prudente de los antibióticos y, finalmente, concientizar a la población y productores acerca de la resistencia a antibióticos, así como de las amenazas relacionadas (FAO, 2017).
Conclusión
Es claro que estamos ante un problema grave de salud pública. Si bien a la fecha no parece afectarnos tanto o al menos no se percibe a simple vista, si continúa y no tomamos cartas en el asunto, tanto como profesionales de salud y consumidores, puede llegar a escalas alarmantes, a tal grado de llegar a un momento donde infecciones “leves”, que hoy podemos controlar con antibióticos, puedan llegar a ocasionar daños severos e incluso la muerte, ya que no tendríamos con que atacarlos.
Así, con acciones concientizadas –evitar su uso inapropiado, seguir nuestro tratamiento, no tirarlos a la basura corriente y evitar lo más posible su empleo en animales– podemos favorecer que continúe la efectividad de los antibióticos con los que contamos, impidiendo la propagación de bacterias resistentes. Por otro lado, las universidades y centros de investigación deben propiciar el desarrollo de nuevos y mejores antibióticos, e incluso generar alternativas más eficientes a éstos.
Ligas de interés
- ¿Sabía que puede haber “superbacterias” en los alimentos?
- Resistencia a los antibióticos. Datos y cifras
- OMS. Antibióticos: Manéjalos con cuidado
- Los Antibióticos No Son Siempre La Solución
Referencias
- Alberts, B., Johnson, A., Lewis, J., Raff, M. y Walter, P. (2002). Molecular Biology of the Cell (4th ed.). Nueva York, NY: Garland Science.
- Aminov, R. I. (2010). A brief history of the antibiotic era: Lessons learned and challenges for the future. Frontiers in Microbiology 1, 134. DOI: https://doi.org/10.3389/fmicb.2010.00134.
- Baron, S. A., Diene, S. M. y Rolain, J. M. (2018). Human microbiomes and antibiotic resistance. Human Microbiome Journal, 10, diciembre 2018, 43-52 DOI: https://doi.org/10.1016/j.humic.2018.08.005.
- Cabrera, C. E., Gómez, R. F. y Zúñiga, A. E. (2007). La resistencia de bacterias a antibióticos, antisépticos y desinfectantes una manifestación de los mecanismos de supervivencia y adaptación. Colombia Médica, 38(2), abril-junio. Recuperado de: http://www.scielo.org.co/pdf/cm/v38n2/v38n2a07.pdf.
- Fleming, Alexander (1929). On the antibacterial action of cultures of a Penicillium, with special reference to their use in the isolation of B. influenzae. Reviews of Infectious Diseases, 2(1), 129-139. DOI: https://doi.org/10.1093/clinids/2.1.129.
- Fleming, Alexander (1945). Penicillin [Nobel Lecture]. Recuperado de: https://www.nobelprize.org/uploads/2018/06/fleming-lecture.pdf.
- Food and Agriculture Organization (FAO). (2017). Antimicrobial resistance in food and agriculture. Recuperdado de: http://www.fao.org/3/a-i7138e.pdf.
- Gérvas, J. (2000). La resistencia a los antibióticos, un problema de salud pública. Atención Primaria, 25(8), 589–596.
- Kardos, N. y Demain, A. L. (2013). Ernst Chain: A great man of science. Applied Microbiology and Biotechnology, 97(15), 6613–6622. DOI: https://doi.org/10.1007/s00253-013-5017-4.
- Katzung, B. G. (2015). Basic and Clinical Pharmacology (14a ed.). Nueva York, NY: McGraw-Hill Education/Medical.
- Lloyd, N. C., Morgan, H. W., Nicholson, B. K. y Ronimus, R. S. (2005). The composition of Ehrlich’s Salvarsan: Resolution of a century-old debate. Angew. Chem. Int., 44, 941–944. DOI: https://doi.org/10.1002/anie.200461471.
- Organización Mundial de la Salud (OMS) (2018). Resistencia a los antibióticos. Recuperado de: https://www.who.int/es/news-room/fact-sheets/detail/resistencia-a-los-antibi%C3%B3ticos.
- Oromí, J. (2014). Resistencia bacteriana a los antibióticos [editorial]. Medicina Integral, 36(10). Recuperado de: https://www.elsevier.es/es-revista-medicina-integral-63-articulo-resistencia-bacteriana-los-antibioticos-10022180.
- Peet, N. P. (2010). Drug resistance: a growing problem. Drug Discovery Today, 15 (15–16), 583-586. DOI: https://doi.org/10.1016/j.drudis.2010.04.002.
- Saga, T. y Yamaguchi, K. (2009). History of antimicrobial agents and resistant bacteria. Japan Medical Association Journal, 52(2), 103-108. Recuperado de: http://www.med.or.jp/english/pdf/2009_02/103_108.pdf.
- Sánchez, P., Muñoz, R. y Gutiérrez, N. (2012). Resistencia bacteriana a los antibióticos: mecanismos de transferencia. Spei Domus, 8(17), 31-37. Recuperado de: https://revistas.ucc.edu.co/index.php/sp/article/view/94.
- Tafur, D. y Villegas, V. (2008). Mecanismos de resistencia a los antibióticos en bacterias Gram negativas. Asociación Colombiana de Infectología, 12(3), 217-226. Recuperado de: http://www.sld.cu/galerias/pdf/sitios/apua-cuba/mecanismos_de_resistencia_a_los_antibioticos_en_bacterias_gram_negativas.pdf.
- Ventola, C. L. (2015). The antibiotic resistance crisis: part 1: causes and threats. P & T: a peer-reviewed journal for formulary management, 40(4), 277–283. Recuperado de: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4378521/.
- Vergara, D. M., Ferrer, I. C., Ortega Annló, E. y González Sánchez, M. E. (2014). Probióticos: más allá de la salud intestinal. Nutr Hosp., 30(Supl. 2), 63-67.
- von Wintersdorff, C. J. H., Penders, J., van Niekerk, J. M., Mills, N. D., Majumder, S., van Alphen, L. B., … Wolffs, P. F. G. (2016). Dissemination of Antimicrobial Resistance in Microbial Ecosystems through Horizontal Gene Transfer. Frontiers in Microbiology, 7, 173. DOI: https://doi.org/10.3389/fmicb.2016.00173.
- World Health Organization. (2017). Antibacterial agents in clinical development: an analysis of the antibacterial clinical development pipeline. Recuperado de: https://www.who.int/medicines/areas/rational_use/antibacterial_agents_clinical_development/en/.
Recepción: 17/07/19. Aprobación: 11/09/19.




