Revista Digital Universitaria ISSN: 1607 - 6079 | Publicación mensual
1 de diciembre de 2014 vol.15, No.12
• TEMA DEL MES •
Enzimas: aceleradores de reacciones químicas en las células y en la industria
Introducción
Si pudiéramos describir nuestra existencia en términos de reacciones químicas, usaríamos la palabra “autocatalítica”. A cada instante, dentro de nuestro organismo ocurren cientos de reacciones químicas necesarias para la vida, que deben ocurrir en una escala de tiempo razonable. Por ejemplo, todos hemos escuchado que los carbohidratos (o azúcares) tienen muchas calorías y que nos dan mucha energía. En efecto, un azúcar muy simple, como la glucosa, nos puede proporcionar una gran cantidad de energía al oxidarse o “quemarse” hasta formar dióxido de carbono (CO2) y agua (H2O); puede producir hasta 3.8 kcal/g de glucosa, ¡lo que equivale a la energía suficiente para mantener encendida una pequeña lámpara de 1 watt durante más de un mes! Entonces, ¿por qué no vemos que el azúcar de mesa se transforma violentamente en CO2 y H2O al estar en contacto con el aire, liberando energía? La razón es que a temperatura ambiente, esta transformación ocurre a una velocidad muy baja. Nuestro cuerpo, para poder extraer la energía de los azúcares en un tiempo útil (es decir, que nos mantenga vivos, pestañeando, caminando, pensando o leyendo este artículo), utiliza catalizadores que aceleran esa misma reacción y provocan que ocurra miles de veces más rápido. Los catalizadores de los seres vivos son las enzimas, proteínas que nuestro propio cuerpo produce. De ahí lo de autocatalítico.Una célula relativamente simple, como la bacteria Escherichia coli, puede producir más de 4 mil proteínas diferentes. Después del agua, las proteínas son las moléculas más abundantes dentro de las células (~15% de la masa de una bacteria). Una célula es una colección de miles de moléculas en constante movimiento y organizadas en estructuras específicas. Esta colección incluye a las proteínas, ácidos nucleicos, polisacáridos, lípidos, metabolitos y pequeños iones, como sodio, potasio y magnesio. Una animación que muestra la variedad de procesos que ocurren en todo momento dentro de una célula se puede ver en el siguiente video:
Expelled - Cell Animation. The Interior of a Cell animation from the movie "Expelled: No Intelligence Allowed" by Ben Stein
Las enzimas tienen una enorme variedad de funciones dentro de la célula: degradan azúcares, sintetizan grasas y aminoácidos, copian fielmente la información genética, participan en el reconocimiento y transmisión de señales del exterior y se encargan de degradar subproductos tóxicos para la célula, entre muchas otras funciones vitales. La identidad y el estado fisiológico de un ser vivo está determinado por la colección de enzimas que estén funcionando con precisión de cirujano y con la velocidad de un rayo en un momento dado dentro de las células. Así, a lo largo de millones de años de evolución, la naturaleza ha desarrollado una gran diversidad de enzimas para mantener el complejo fenómeno de la vida.
¿Qué tan eficientes son las enzimas? ¿Cómo funcionan?
Como mencionamos, nuestras células producen muchísimas enzimas, puesto que hay cientos de transformaciones químicas que deben ocurrir rápidamente. Una de las más rápidas que existen en la naturaleza se llama anhidrasa carbónica, que cataliza la reacción de dióxido de carbono con agua para formar ácido carbónico (H2CO3). Este proceso es sumamente importante, ya que regula el pH de la sangre, fundamental para la supervivencia de las células. La reacción mencionada ocurre en escalas de tiempo que podemos imaginar fácilmente: en ausencia de esta enzima, se produciría una molécula de ácido carbónico cada segundo. Aunque nos parezca rápido, a esta velocidad la supervivencia de las células se vería comprometida, ya que el tiempo de la reacción resulta ser demasiado lento como para mantener un pH estable que permita que las funciones celulares se lleven a cabo adecuadamente. Es por esto que la reacción debe ocurrir más rápidamente. La anhidrasa carbónica puede acelerar la misma hasta llegar a una velocidad de aproximadamente 1x106/s. Esto significa que en presencia de una molécula de enzima, ¡se producen cerca de un millón de moléculas de ácido carbónico cada segundo! El cálculo más elemental nos permite concluir que la enzima acelera la velocidad de reacción por lo menos un millón de veces.Existen varias maneras de medir qué tan eficiente es una enzima. La más simple es determinar qué tan rápidamente ocurre la reacción en términos de cuántas moléculas de sustrato se transforman por segundo, como en el ejemplo de la anhidrasa carbónica. Cuando comparamos qué tan velozmente va una reacción catalizada vs en ausencia de la enzima, podemos apreciar la eficiencia de las enzimas como aceleradoras de reacciones. Otra manera es considerar el tiempo necesario para que ocurra la reacción. La enzima más eficiente que se conoce a la fecha cataliza la descarboxilación de un sustrato denominado oritidina 5’-fosfato (OMP, por sus siglas en inglés), y es llamada OMP decarboxilasa. La reacción no catalizada tarda 78 millones de años en ocurrir. Afortunadamente, la enzima OMP descarboxilasa acelera la reacción 1017 veces, por lo que ésta ocurre en tan sólo 25 milésimas de segundo. Esta reacción es muy importante, puesto que forma parte de la cadena de producción del núcleotido uridina monofosfato, uno de los 4 componentes del ácido ribonucleico (RNA, por sus siglas en inglés).
¿Cómo hacen este trabajo las enzimas? Recordemos que las enzimas son proteínas, polímeros de aminoácidos que tienen una estructura tridimensional definida. Su actividad, que incluye interactuar con el sustrato, depende de su estructura tridimensional. Si ésta se modifica, la capacidad catalítica puede verse perjudicada. Para entender mejor cómo se pliega o dobla en el espacio una proteína, se han desarrollado herramientas computacionales que permiten simular este fenómeno. La simulación del plegamiento de una proteína pequeña puede verse en el siguiente video:
Six Microseconds of Protein Folding
Ahora, ¿qué guía o determina el plegamiento de una proteína? Las proteínas se pliegan elegantemente dependiendo de la secuencia de aminoácidos (llamados residuos de aminoácidos toda vez que forman parte de una proteína) que las componen y forman entre sus dobleces y curvas ciertas cavidades o sitios con afinidad hacia diferentes moléculas. Para el caso de las enzimas, es en estos sitios en donde ocurre la reacción química. A continuación, un video muy bien logrado en que se observa una simulación de la interacción entre proteínas y moléculas pequeñas:
Scientific Animations and Visual Effects by Schrödinger
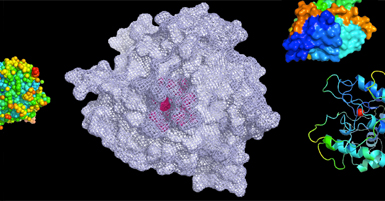
Cada vez que un grupo de científicos determina la estructura tridimensional de una proteína, ésta se deposita en una página web llamada “Banco de Datos de Proteínas” (PDB, por sus siglas en inglés). De este sitio seleccionamos una galería de enzimas que se muestra en la siguiente figura, resaltando lo sofisticado y bello de algunos de los plegamientos conocidos a la fecha (Figura 1). Todas estas maravillosas vistas de las proteínas se las debemos a los avances en biología estructural, que es una ciencia relativamente joven, como mencionaremos en la siguiente sección.
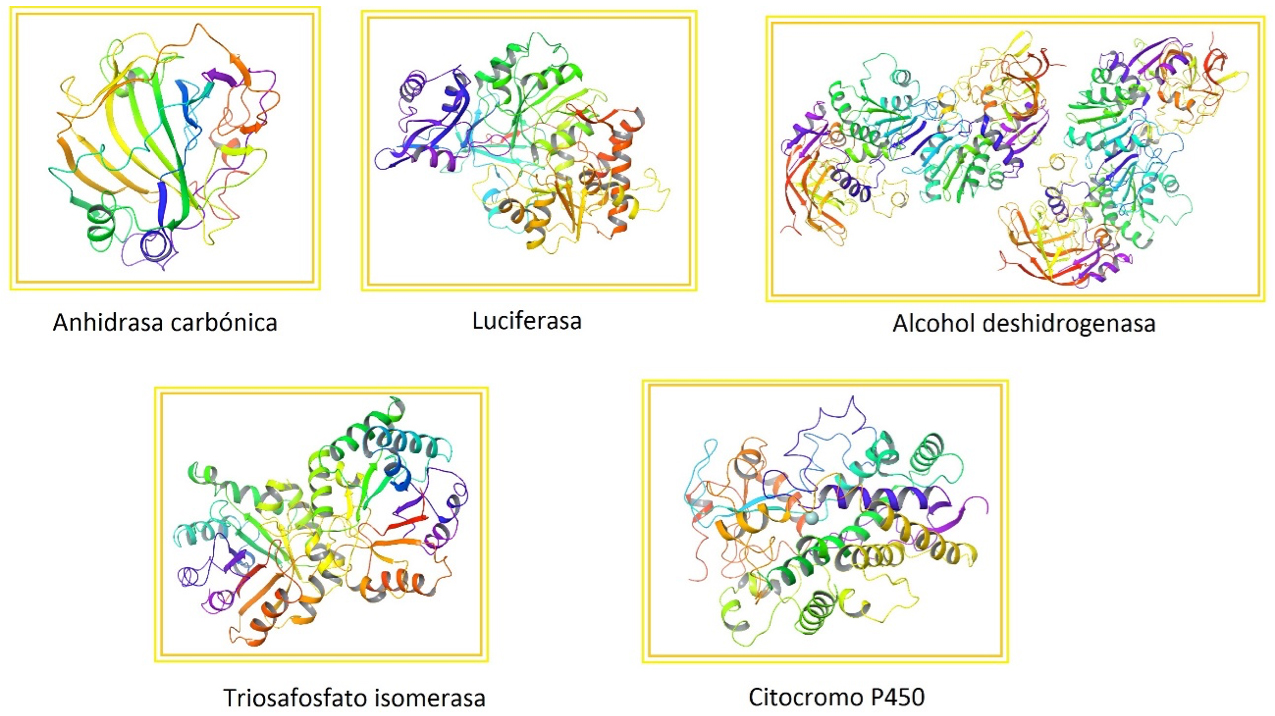
Figura 1. Galería de enzimas. La anhidrasa carbónica mantiene el pH de nuestra sangre (PDB 1CA2). La luciferasa fue aislada de una medusa y también es responsable de la bioluminiscencia en las luciérnagas (PDB 2D1S). La alcohol deshidrogenasa degrada el alcohol que ingerimos, se produce en el hígado (PDB 1AGN). La triosafosfato isomerasa es importante en el metabolismo de los azúcares (PDB 2YPI). El citocromo P450 modifica algunos fármacos y compuestos tóxicos que ingresan a nuestro organismo (PDB 1W0E). Obtenidos del PDB (http://www.rcsb.org/pdb/home/home.do).
Los mecanismos enzimáticos que aceleran una reacción son muy diversos. Dos de los más simples e intuitivos son el de “aproximación” y “orientación”. Como en toda reacción química, los reactantes deben colisionar entre sí con suficiente energía y con la orientación adecuada para que los enlaces entre las moléculas se rompan o se formen. Puesto que estas colisiones ocurren completamente al azar, no todas ellas son productivas, es decir, que no todas desencadenan una reacción química. Como se mencionó antes, las enzimas tienen cavidades que pueden acomodar a los sustratos para que reaccionen entre sí. Éstas conforman el “sitio activo” de la enzima. En este sitio se encuentran residuos de aminoácidos específicos que permiten la interacción con los sustratos y que facilitan el rompimiento y la formación de nuevos enlaces.
 | Algunas enzimas incluyen metales en su estructura (por ejemplo, iones de hierro, cobre y zinc, entre otros) que pueden participar en el proceso catalítico. | |
 | ||
¿Qué son las enzimas?, aprendiendo química.
Otra característica muy importante de las enzimas es su especificidad, es decir, qué tan bien pueden reconocer a un sustrato –y solo a ese sustrato–, en presencia de otras moléculas. Esta capacidad de discriminar entre cientos de moléculas diferentes es otra de las razones por las que la estructura tridimensional de las enzimas es clave en su funcionalidad. Si la estructura del sitio activo fuera demasiado flexible y dinámica, la afinidad por el sustrato sería muy baja y la reacción no procedería tan rápido. En este sentido, uno de los retos de la ingeniería de proteínas es comprender el plegamiento de las mismas, con miras a saber cómo manipular la estabilidad de la estructura y mejorarla. Puesto que las enzimas son proteínas diseñadas por la evolución para funcionar en condiciones muy acotadas dentro de las células (i.e., 30-37°C, presión atmosférica o medio acuoso), cuando se quieren utilizar en otras condiciones de reacción (temperaturas altas, medios con solventes orgánicos o con agitación mecánica) tienden a perder su estructura y, por lo tanto, su actividad.
¿Cómo se descubrieron las enzimas?
Hace apenas un siglo, los científicos descubrieron que las enzimas eran proteínas y comenzaron a entender cómo funcionaban; sin embargo, es desde hace cientos o miles de años que tenemos contacto con ellas y las aprovechamos en nuestro beneficio. Uno de los ejemplos más ilustrativos es la quimosina, que se encuentra en los estómagos de ciertos rumiantes. Ésta es una proteasa, es decir, una enzima que cataliza la degradación de otras proteínas mediante el rompimiento del enlace que une a los residuos de aminoácidos que las conforman. Según la historia, en el Egipto de hace más de dos mil años se sabía que al almacenar leche en vísceras o estómagos secos de animales se formaba un sólido blanquecino o cuajo, que al prensarse para eliminar el suero daba lugar al queso fresco. | La primera patente sobre un proceso enzimático es de esta misma época: en 1894, Takamine patentó una enzima a la que llamó “diastasa”, producida por un hongo y que actualmente sigue en el mercado. | |
 | ||
Figura 2. Quimosina de origen bovino (PDB 4AUC, obtenida del PDB http://www.rcsb.org/pdb/home/home.do) interactuando con un inhibidor (pepstatina A, en esferas rojas) que se une al sitio activo de la enzima.
La historia del estudio de las enzimas a nivel molecular es bastante reciente. En la época de Hansen, los científicos ya intuían que había “algo” dentro de las células que jugaba un papel importante en las transformaciones químicas que allí se producían. Los estudiosos llamaron “fermentos” a estas sustancias. Inclusive Berzelius, químico sueco, propuso en 1835 que los fermentos tenían un papel catalítico. Sin embargo, se pensaba que estos únicamente funcionaban debido a la presencia de células vivas, las cuales les conferían una “fuerza vital” que los hacía activos. No fue sino hasta 1897, que se demostró concluyentemente que los fermentos o extractos celulares, en ausencia de células vivas, catalizaban reacciones. Este descubrimiento se lo debemos a Eduard Buchner, un científico alemán, quien fue galardonado con el Premio Nobel de Química en 1907 por demostrar que los extractos de levadura, sin células, pueden catalizar una fermentación alcohólica, esto es, la transformación de azúcares en alcohol. Buchner sugirió que los fermentos debían ser de naturaleza proteica 1.
En 1926, James B. Sumner, científico estadounidense, purificó y cristalizó por primera vez una enzima, la ureasa, con lo que demostró que era una proteína y comprobó la idea de Buchner. Por sus hallazgos, Sumner recibió el Premio Nobel de Química en 1946 junto con John H. Northrop y W.M. Stanley, científicos también estadounidenses, quienes en 1930 purificaron otras enzimas2. Más tarde, abonando al despegue de la biología estructural, el científico David Chilton Phillips determinó en 1965 y por primera vez la estructura tridimensional de la enzima lisozima, mediante el patrón de difracción de rayos X de un cristal de la enzima. Esto representó un avance enorme, ya que a través de esta técnica es posible conocer a detalle la estructura molecular de las enzimas y, a partir de ella, generar hipótesis sobre cómo funcionan, diseñar cambios en residuos específicos para manipular sus propiedades (eficiencia catalítica, especificidad o estabilidad, entre otras), o simular sus movimientos y su interacción con otras moléculas.
Aquella fue, sin duda, una época emocionante, tanto desde el punto de vista científico como tecnológico. En 1913 se publicó el ahora clásico artículo de Michaelis y Menten, en el que se propone un modelo para explicar el comportamiento cinético de las enzimas. Este modelo, matemáticamente muy sencillo, describe cómo se incrementa la velocidad de una reacción catalizada enzimáticamente a medida que aumenta la concentración del sustrato. La velocidad se acerca a un máximo, en el que se supone que los sitios activos se encuentran saturados y por tanto la reacción no puede proceder a mayor velocidad. En la siguiente dirección se puede consultar una versión comentada del artículo que acaba de cumplir cien años: http://academics.wellesley.edu/Biology/Concepts/Html/initialvelocity.html. Cabe mencionar que la inmensa mayoría de las enzimas tienen un comportamiento cinético cercano a este modelo o poseen variantes del mismo. De hecho, es el modelo básico que se enseña en la actualidad en los cursos de enzimología de todo el mundo. De manera que, como puede apreciarse, a principios del siglo pasado, la mesa ya estaba puesta para comprender a fondo el funcionamiento de las enzimas.
1 Para averiguar más sobre este científico, puede consultar la página de los Premio Nobel (http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1907/)
2 Más información sobre este premio se puede encontrar en: http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1946/
¿Cómo se pueden aprovechar las enzimas?
Las enzimas no sólo funcionan en el interior de las células, sino que es posible extraerlas de los organismos y utilizarlas de diferentes maneras y en contextos diferentes, como lo demostró Buchner. Además, tienen aplicaciones en diferentes áreas, que van desde la preparación de alimentos y bebidas, hasta la síntesis de farmacéuticos y otros compuestos importantes en la industria química. En este número se revisan varios ejemplos interesantes sobre qué tan lejos han llegado las enzimas en términos biotecnológicos, ya que están presentes (literalmente) en muchísimas de las actividades cotidianas que realizamos. Por ejemplo, cada vez que lavamos la ropa utilizamos enzimas, ya que éstas son uno de los ingredientes de los detergentes granulados y líquidos que se venden actualmente en todo el mundo.
Imagen: Karunasanghvi, consultada en: http://pixabay.com/es/detergente-cuchara-blanco-wash-460472/ El papel de estas enzimas, como las amilasas, proteasas y lipasas, consiste en degradar carbohidratos complejos, restos de proteínas y restos de grasas, respectivamente. Otro caso son las pruebas rápidas de embarazo que están basadas en un “ensayo de inmunoabsorción ligado a enzima” (enzyme-linked inmunosorbent assay, ELISA, por sus siglas en inglés), el cual utiliza una enzima llamada peroxidasa, acoplada a un anticuerpo, que permite amplificar la señal cuando el anticuerpo se une a su molécula blanco. De esta manera, una pequeña cantidad de la molécula blanco puede detectarse, inclusive visualmente. En algunos casos, también nos beneficiamos indirectamente de las enzimas. Por ejemplo, el efecto deslavado de la mezclilla se consigue utilizando un tratamiento con la enzima lacasa, que es capaz de desteñir la tela debido a que cataliza la conversión de moléculas de colorante en otras moléculas, que ya no tienen color. Y como estos, hay decenas de ejemplos.
Todas estas aplicaciones tecnológicas no serían posibles sin la producción de las enzimas a gran escala y bajo costo. La ingeniería genética ha sido fundamental en este aspecto. Gracias a esta herramienta, es posible extraer de un organismo el gen (formado por ácido desoxirribonucleico, DNA por sus siglas en inglés) que codifica para una enzima específica e introducirlo en el material genético de otro organismo.
 | La ingeniería genética ha sido fundamental en este aspecto. Gracias a esta herramienta, es posible extraer de un organismo el gen (formado por ácido desoxirribonucleico, DNA por sus siglas en inglés) que codifica para una enzima específica e introducirlo en el material genético de otro organismo. | |
 | ||
Además de esta popular bacteria, es posible expresar o producir proteínas de muchos seres vivos en hongos, como la levadura del pan Saccharomyces cerevisiae o incluso en células de insecto. Mientras que a mediados del siglo XX (ca. 1960) cerca del 70% de las enzimas comerciales se obtenían de plantas y de órganos animales, en la actualidad el 90% proviene de microorganismos y la mayoría de las enzimas de uso industrial (más del 50%) se producen de forma recombinante (ILLANES, 2010).
 | Uno de los primeros casos de una proteína de interés producida con la tecnología recombinante es la insulina, una hormona de naturaleza proteica que se utiliza en el tratamiento de la diabetes. | |
 | ||
Conclusión
Las enzimas son catalizadores poderosos, manipulables y amigables con el ambiente. En la actualidad y gracias a los avances en distintos campos de la ciencia, las enzimas se utilizan en aplicaciones tradicionales, como la industria alimentaria, comida para ganado, detergentes, textiles y curtiduría, y también en otras áreas que incluyen a la farmacéutica, la de diagnóstico y la química fina. En este número presentamos aplicaciones bien conocidas de las enzimas (algunas milenarias), así como aplicaciones potenciales o en desarrollo. Con estos artículos pretendemos proporcionar un vistazo al quehacer de los biotecnólogos que trabajan en sus laboratorios para comprender y mejorar estas sorprendentes macromoléculas.Bibliografía
COHEN SN, Chang ACY, Boyer HW & Helling RB. “Construction of biologically functional bacterial plasmids in vitro” Proceedings of the National Academy of Science USA, 1973, 70, 3240–3244.----- Andrés Illanes (editor). Enzyme Biocatalysis: Principles and applications. Springer, 2010.
GOEDDEL et al. “Expression in Escherichia coli of chemically synthesized genes for human insulin”. Proceedings of the National Academy of Science USA, 1979, 76, 106–110.
JOHNSON KA & Goody RS. “The original Michaelis constant: translation of the 1913 Michaelis-Menten paper”. Biochemistry,2011, 50, 8264-8269.
COMENTARIOS
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
2013 Esta obra está bajo una licencia de Creative Commons