Revista Digital Universitaria ISSN: 1607 - 6079 | Publicación mensual
1 de enero de 2015 vol.16, No.1
• TEMA DEL MES •
Estructura, función y organización de las proteínas. Un homenaje al Dr. Armando Gómez Puyou.
Introducción
En 1959 Armando y yo comenzamos una colaboración con Antonio Peña en el laboratorio de Bioquímica de la Facultad de Medicina, decididos a trabajar en el campo de la bioenergética, del que se conocían muchos aspectos importantes pero que aún había muchas preguntas interesantes por contestar.
Armando Gómez Puyou y Marietta Tuena de Gómez en su laboratorio del Instituto de Fisiología Celular, UNAM.
La bioenergética es una rama especializada de la bioquímica que estudia los procesos de transducción de energía en los seres vivos. Incluye muchos procesos metabólicos que resultan en la absorción, almacenamiento y la utilización de la energía a nivel celular, subcelular y molecular. El ejemplo más frecuente y mejor conocido de estos procesos es el de la síntesis del ATP (adenosín trifosfato), que es la molécula acarreadora universal de la energía en todas las especies; es decir, el ATP es el tipo de cambio en términos energéticos para todos los seres vivos. Se podría decir que el ATP es el dólar o el euro de los seres vivos dado que es la moneda energética universal, de tal manera que el mantenimiento de las funciones vitales como lo son la biosíntesis de proteínas, ADN, ARN, nucleótidos, aminoácidos, duplicación celular, motilidad y transporte, entre otras, le “cuesta” a las células muchas moléculas de ATP. La ventaja que tiene, es que a diferencia del dólar o del euro, éste nunca se va a devaluar.
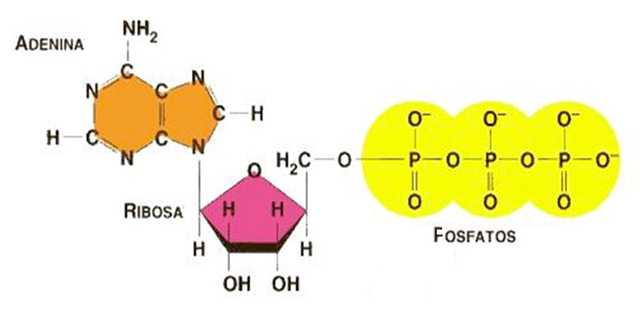
Figura 1. Estructura del ATP. La parte adenina se muestra en naranja y la ribosa en rosa, mientras que los tres fosfatos que le dan el nombre de adenosín-trifosfato se muestran en amarillo. En la reacción exergónica de hidrólisis del ATP se libera el último fosfato (Pi) (ATP+H20èADP+Pi), lo cual impulsa la mayoría de las reacciones y funciones vitales de todos los seres vivos.
La molécula del ATP es un nucleótido libre, y como todo nucleótido está formado por una base nitrogenada, en este caso la adenina, un azúcar (la ribosa) y tres grupos fosfato en unión éster (Figura 1), que en las condiciones normales de la célula se encuentran ionizados, presentando una carga negativa que usualmente es neutralizada por iones Mg2+. El ATP es un acarreador de energía ya que su hidrólisis es una reacción exergónica, es decir, al liberarse al fosfato final para formar ADP y Pi, se libera energía susceptible de transformarse en trabajo químico, osmótico o mecánico, entre otros, lo cual impulsa la mayoría de los procesos celulares vitales que son en general endergónicos. Por definición estos últimos absorben energía libre y necesitan alguna reacción exergónica (como la hidrólisis del ATP) que los impulse por medio de mecanismos de acoplamiento energético. El término acoplamiento en bioenergética quiere decir que una reacción endergónica absorbe la energía liberada de otra exergónica por un mecanismo particular de acoplamiento. En todas las forma de vida y en todas las células, la mayoría de los procesos vitales son endergónicos y se acoplan a la hidrólisis del ATP o al consumo de otra molécula que almacene energía libre al acumularse dentro de las células.
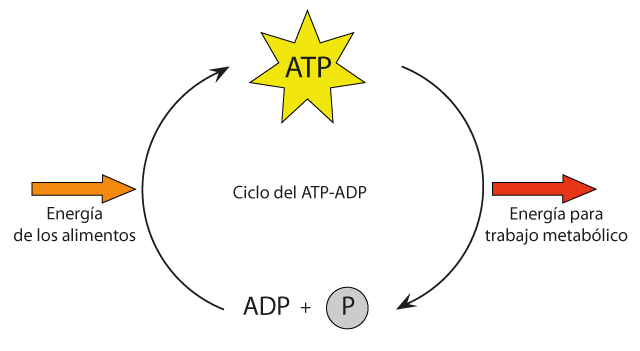
Figura 2. Ciclo del ATP. La energía proveniente de los alimentos (o de la luz, en el caso de los organismos fotosintéticos) se transforma mediante reacciones acopladas para impulsar la condensación de ADP y fosfato inorgánico (Pi) y así acumular grandes cantidades de ATP intracelular, el cual es hidrolizado de nuevo hacia ADP y Pi para impulsar todas las reacciones vitales y trabajo mecánico y osmótico necesario para la vida en todas sus formas.
La tendencia natural del ATP a hidrolizarse en el tercer fosfato para formar ADP y fosfato inorgánico (Pi) se conoce bien, dado que in vitro esta reacción hidrolítica, al llegar al equilibrio, tiene un cociente de ATP/ADP de aproximadamente 10-7. Es decir que en equilibrio hay 10 millones de moléculas de ADP por cada molécula de ATP, lo que implica que la mayoría del ATP está hidrolizado.
Por el contrario, en condiciones fisiológicas, las células están forzadas a mantener una alta relación ATP/ADP de al menos 1000, muy lejos de las condiciones del equilibrio donde la mayoría del ATP se hidroliza. Para ello, las células absorben energía de fuentes primarias, como son nutrientes (azúcares o grasas, por ejemplo) o la luz solar (organismos fotosíntéticos) para transformarlos por los procesos bioenergéticos en altas concentraciones de ATP, el cual, al acumularse en las células en una relación aproximada de mil moléculas de ATP por cada ADP, puede impulsar la mayoría de las reacciones vitales celulares, dado que la hidrólisis del ATP será espontánea (exergónica) y liberará con facilidad la energía necesaria impulsar la vida (Figura 2). Dicho de otra forma, se ha calculado, por ejemplo, que un ser humano promedio en estado de reposo tiene que sintetizar diariamente al rededor de 65 Kg de ATP (su propio peso en ATP) para mantener sus funciones vitales y consumo de energía a diario.
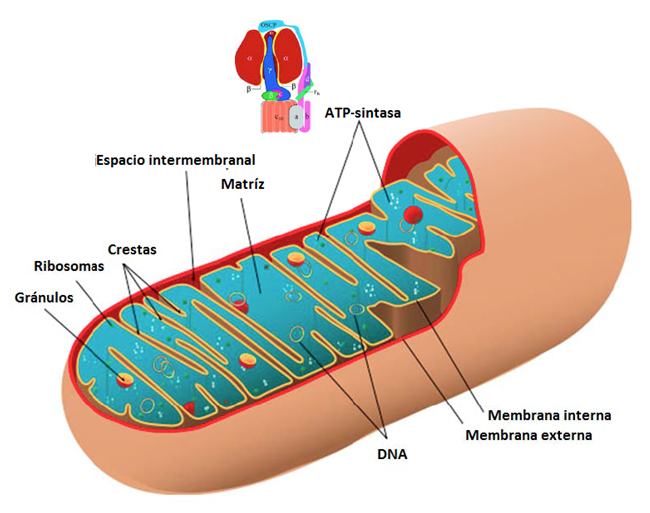
Figura 3. Componentes estructurales de las mitocondrias. Se muestra una representación esquemática en 3D, reconstruida artísticamente de las imágenes de microscopía electrónica –en 2D, de la forma ortodoxa de las mitocondrias. En azul se muestra la matriz mitocondrial conteniendo las enzimas del ciclo de Krebs (Figura 4), el ADN mitocondrial, los ribosomas mitocondriales y demás metabolitos en un medio acuoso. La membrana interna se muestra formando sinuosidades llamadas crestas mitocondriales, y es en esta membrana donde se encuentran los complejos respiratorios y la ATP sintasa (aumentada en el esquema superior). Las crestas aumentan la superficie membranal disponible para sintetizar ATP.
Las células sintetizan la mayoría de ATP (90%) Para poder acumular las altas cantidades que necesitan a través del proceso llamado fosforilación oxidativa. La enzima que realiza esta síntesis es la F1F0-ATP sintasa o complejo V respiratorio (adicional a los otros 4 complejos respiratorios I-IV que consumen el oxígeno de la respiración) (Figura 5). Este proceso clave en el movimiento de energía dentro de la célula se realiza en el interior de un organelo existente en el citoplasma de las células, denominado mitocondria (del griego mitos [hilos] y chondros [gránulos] o “gránulos en forma de hilos” por su morfología vista por microscopía electrónica) (Figura 3), responsable de suministrar la mayor parte de la energía necesaria para la actividad celular, esto procede al consumir la energía de sustratos oxidables por medio de la respiración mitocondrial que ocurre en las crestas (Figuras 3 y 5).
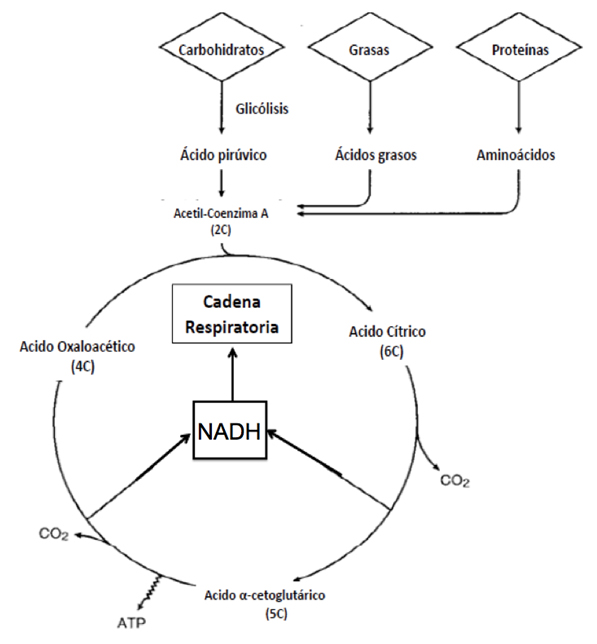
Figura 4. Ciclo de Krebs. Se ilustra una secuencia de reacciones conocida como Ciclo de Krebs. En la matriz mitocondrial, el Acetil Coenzima A (una molécula de sólo dos carbones) inicia el ciclo al condensarse con una molécula de cuatro carbones, el ácido oxaloacético, para generar una molécula de seis carbones, el ácido cítrico. Con cada vuelta del ciclo se pierden dos carbones de la molécula de ácido cítrico, que se transforman en CO2. Igualmente, se sintetiza una molécula de ATP por fosforilación directa a nivel del sustrato y se regenera el ácido oxaloacético, la molécula de cuatro carbones. También se genera energía redox (NADH) por acción de las enzimas del tipo deshidrogenasa presentes en el ciclo, que alimentan a la cadena respiratoria y la ATP sintasa de la membrana interna mitocondrial (Figura 5).
Estructuralmente, la mitocondria está rodeada de dos membranas claramente diferentes en sus funciones: la externa de permeabilidad no selectiva y la interna que es semi-permeable o de permeabilidad limitada, para moléculas con cargas tanto negativas (aniones) como positivas (cationes), proteínas y otros metabolitos. La membrana interna mitocondrial presenta una estructura compleja muy sinuosa, es decir, con varios dobleces y estructuras tubulares (como los dedos de un guante) que se conocen como crestas mitocondriales (Figura 3) en las que se encuentran las estructuras responsables de la fosforilación oxidativa, es decir, la cadena respiratoria y la F1F0-ATP sintasa. La función de las crestas es aumentar la superficie membranal en donde pueda ocurrir la fosforilación oxidativa, esto es similar a los dobleces de las membranas en las nefronas del riñón donde aumenta la superficie disponible para el transporte de iones y agua de la orina, o a las membranas alveolares de los pulmones donde se aumenta la superficie membranal disponible para el intercambio vital de oxígeno/CO2 durante la respiración.
Es decir, a mayor número de crestas, mayor superficie que contiene los complejos respiratorios y la ATP sintasa para sintetizar al ATP. El espacio entre ambas membranas (interna y externa) se conoce como espacio intermembranal. La membrana interna limita la matriz mitocondrial en la que, mediante un mecanismo conocido como beta oxidación, las enzimas específicas oxidan ácidos grasos así como piruvato proveniente de la glicólisis, además de los aminoácidos, produciendo acetil Coenzima A (Figura 4).
Es justamente la mitocondria el lugar en el que se consume el oxígeno de los organismos aerobios a través de varios acarreadores de electrones y translocadores de protones (H+), es decir, las mitocondrias funcionan como los pulmones celulares, y la pregunta central de la bioenergética mitocondrial es cómo se acopla esta respiración con la síntesis del ATP a partir de ADP y Pi (Figuras 3 y 5). En los primeros años del estudio de la respiración y fosforilación oxidativa, las mitocondrias se veían como cajas negras donde se consumía oxígeno y sustratos oxidables durante la respiración, y “mágicamente” se producía ATP a partir de ADP y Pi, de tal modo que se desconocía el mecanismo de acoplamiento entre la respiración y la síntesis del ATP. Para resolver esta pregunta se formularon varias hipótesis como se explica más adelante.
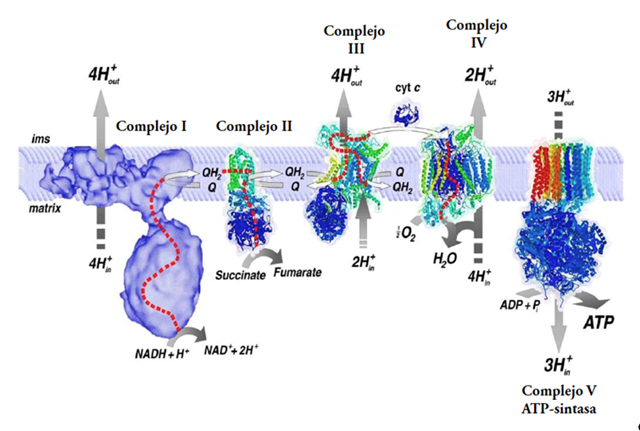
Figura 5. Componentes de la fosforilación oxidativa. Los complejos respiratorios I y II oxidan sustratos provenientes del ciclo de Krebs (Figura 4) como lo son el NADH y el succinato, para generar una corriente de electrones a lo largo de la membrana que culmina en el consumo de oxígeno por el complejo IV y la formación de agua. Durante la respiración, los complejos I, III y IV bombean protones a través de la membrana interna mitocondrial hacia el espacio intermembranal, los cuales son transportados de regreso a la matriz mitocondrial por la ATP sintasa (o complejo V). Este flujo de protones es lo que impulsa la síntesis del ATP durante la fosforilación oxidativa de acuerdo con la teoría quimiosmótica de Peter Mitchell.
Valoración experimental de la fosforilación oxidativa en mitocondrias
Con todos estos antecedentes relacionados con los componentes estructurales de la fosforilación oxidativa y sus funciones, surgieron en 1959 nuevas preguntas sobre mecanismos de la mitocondria que dieron lugar al inicio de una colaboración entre el Dr. Antonio Peña y nuestro grupo, para resolver una pregunta clave en el proceso que se lleva a cabo en la mitocondria: ¿Cómo se acopla el transporte de electrones con la síntesis de ATP?Para dar respuesta experimental a esta pregunta, se elaboraron tres hipótesis:
1. La hipótesis química, en la que se postulaba la existencia de moléculas intermediarias o acarreadores de energía (X~P) que conectaban la energía de la cadena de electrones con la ATP sintasa (Figura 6A).
2. La hipótesis quimiosmótica propuesta por Peter Mitchell, quien negaba la existencia de los intermediarios de energía y postulaba que el evento primario en la transformación de la energía era la generación de una diferencia de concentración protones, (H+) y de cargas hacia el espacio intermembranal durante la respiración, que establecía respectivamente una diferencia de pH y de carga (ΔpH y Δψ) que sumadas dan la fuerza protón motriz (ΔμH+), utilizada por la ATP sintasa para sintetizar el ATP en el proceso de fosforilación oxidativa (Figura 5 y 6A).
3. Finalmente, la hipótesis conformacional estaba basada en los cambios de volumen mitocondrial observados durante el funcionamiento de la cadena respiratoria y la síntesis de ATP acoplada a ésta (Figura 6B). Estos cambios conllevan diferentes tipos de trabajo:a. Químico, en la síntesis de ATP,
b. Osmótico, dada la entrada y salida de iones y agua
c. Mecánico o conformacional, en la estructura de las membranas mitocondriales. Los cambios observados son rápidos y dramáticos, y corresponden al paso desde la conformación ortodoxa a la condensada (Figura 6B).
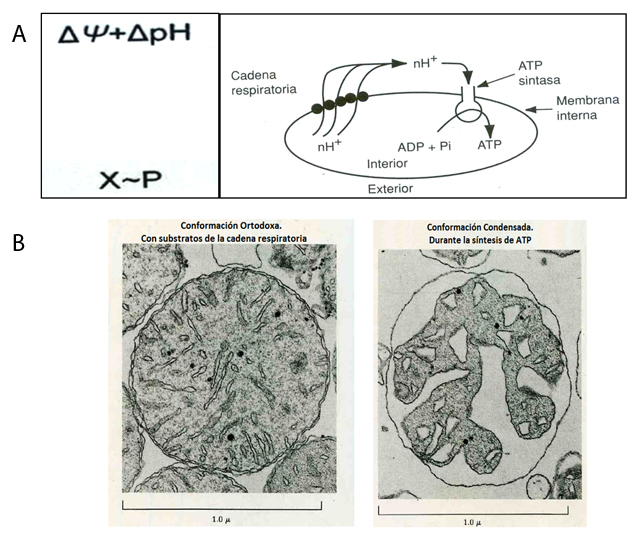
Figura 6. Ilustración de las tres teorías con las que se pretendía explicar el mecanismo de la fosforilación oxidativa. A) Teorías quimiosmótica y química (X~P). La primera postula que la fuerza protón motriz (ΔμH+) es el mecanismo de acoplamiento entre la respiración mitocondrial y la fosforilación oxidativa (Figura 5), esta energía tiene dos fuerzas transmembranales: un gradiente eléctrico (Δμ) y uno químico (ΔpH), las cuales, al sumarse, dan la energía disponible para sintetizar el ATP; la segunda hipótesis quedó atrás, y postulaba la existencia de un intermediario fosforilado (X~P) hipotético que acoplaba la respiración con la síntesis del ATP, tal intermediario nunca fue encontrado experimentalmente (dado que no existía) y en su lugar se forma el gradiente de protones a través de las membranas transductoras de energía (ΔμH+). B) Hipótesis conformacional. Cambios conformacionales de las mitocondrias en ausencia de ADP pero con sustratos de la cadena respiratoria (izquierda, forma ortodoxa) y en presencia de ADP, durante la síntesis del ATP (derecha, forma condensada).
En estos eventos la prioridad era definir cuál de los tres constituía el factor esencial, necesario para dar lugar a los demás: ¿el acoplamiento químico, el quimiosmótico o el mecanoquímico?
Los numerosos datos experimentales obtenidos confirmaban ampliamente la teoría quimiosmótica, aquella que postulaba que el evento primario era la formación del gradiente de H+, una de las ideas más revolucionarias e importantes en el campo de la bioenergética (Figura 5). La relevancia de este mecanismo a nivel biológico radica en que la teoría quimiosmótica de Mitchell no sólo es válida para la fosforilación oxidativa mitocondrial (Figura 5), sino también para todas las denominadas “membranas transductoras de energía”, las cuales incluyen a las membranas internas de los cloroplastos o tilacoides, durante la fotosíntesis, y a las membranas plasmáticas de bacterias respiratorias o fotosintéticas.
En todas estas membranas hay varios complejos transportadores de electrones que bombean protones hacia el lado positivo de la membrana respectiva para impulsar la síntesis del ATP por la ATP sintasa por un mecanismo similar al de la Figura 5. Las membranas bacterianas abarcan todos los organismos unicelulares procarióticos, mientras que las mitocondrias se encuentran en todos los eucariontes respiratorios, y los cloroplastos en todas la algas y plantas fotosintéticas, lo cual implica que la teoría quimiosmótica es universal y explica el mecanismo central de la fosforilación oxidativa bacteriana y mitocondrial, así como la fotofosforilación fotosintética, es decir la parte central de la bioenergética en todos los seres vivos. De ahí viene la gran relevancia de la teoría quimiosmótica.
Surgimiento de nuevas interrogantes
En el mismo contexto surgieron nuevas preguntas, particularmente sobre cuál era el papel de las membranas interna y externa en las funciones de las mitocondrias. Se deseaba saber si eran parte activa en los procesos metabólicos o si actuaban como una simple barrera entre el citoplasma y el interior de la mitocondria. Nos abocamos a responder esta pregunta de 1960 a 1969, tratando de descifrar, particularmente, el papel de la membrana interna en la fosforilación oxidativa.Publicamos trabajos en los que estudiamos los efectos inhibitorios de los iones sodio (Na+) y potasio (K+) sobre la síntesis del ATP, la dependencia de la respiración con la cadena de electrones en presencia o ausencia de estos iones, así como su efecto en la hidrólisis reversible del ATP por la ATP sintasa y en el hinchamiento mitocondrial en respuesta osmótica a los cambios en concentraciones de iones Na+ y K+. Todos estos resultados llevaban a plantear la posible existencia de un sistema de transporte de los cationes a través de la membrana, sistema que utilizaba alternativamente la energía para sintetizar el ATP o para transportar los iones. Observamos, por ejemplo, que el transporte de los iones sodio o potasio (ambos positivos) se acompañaba de aniones como el fosfato (Pi2-). Junto con otros, estos trabajos mostraron evidencia de la dependencia de la fosforilación oxidativa respecto al gradiente eléctrico Δψ, y por lo tanto gracias a estos resultados se podía justificar la hipótesis quimiosmótica en la que se establece que el transporte de cationes y aniones utiliza la diferencia de carga y de pH generada por los protones (H+) para sintetizar indistintamente el ATP o para transportar los iones. En resumen, estos trabajos contribuyeron a confirmar ampliamente la teoría quimiosmótica para explicar el funcionamiento de la fosforilación oxidativa en la mitocondria.
Como todo investigador en formación suele constatar al iniciarse en esta tarea, la investigación generalmente tiene como resultado el surgimiento de nuevas preguntas. En este caso, algunas de las más interesantes fueron:
1. ¿Existen proteínas transportadoras de iones (K+, Na+, Ca2+, fosfato, ADP, ATP y otros) en la membrana interna de las mitocondrias?Se conocía el efecto de algunos antibióticos conocidos como ionóforos que artificialmente conducían iones a través de la membrana mitocondrial. En 1964, Moore y Pressman describieron el efecto de la Valinomicina, que, añadida a las mitocondrias, conducía el potasio a través de la membrana interna mitocondrial utilizando la energía generada por la oxidación de sustratos de la cadena de transporte de electrones o la energía de la hidrólisis del ATP, comportándose como se esperaba que lo hiciera un posible acarreador natural.
2. ¿Están estas proteínas integradas a la membrana? Si fuese el caso, dado que los componentes principales de las membranas son fosfolípidos, seguramente se trataría de proteínas hidrofóbicas, insolubles en medios acuosos: purificarlas y caracterizarlas requería nuevas técnicas.
3. Si se tratase de proteínas transportadoras a través de una membrana, ¿cómo medir su actividad de transporte?
Tuvieron que pasar 42 años desde estas primeras observaciones para la caracterización del transportador de K+ de la membrana mitocondrial que actúa como un antiportador (proteína transmembranal que transporta dos sustratos diferentes en direcciones contrarias a través de la membrana) H+/K+ y que sirve para mantener el volumen mitocondrial. El intercambiador puede transportar litio, sodio, rubidio y cesio. Se ha aislado y su actividad ha sido medida en liposomas.
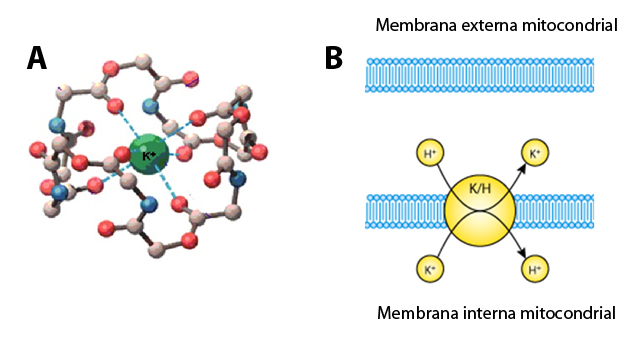
Figura 7. Modelos de la valinomicina y del intercambiador K+/H+ de membrana interna mitocondrial. A) La valinomicina es un transportador selectivo por K+ formado por un péptido cíclico que funciona como antibiótico al romper los gradientes iónicos normales en los microcorganismos. Se muestra el ión K+ en verde coordinado selectivamente por cinco oxígenos centrales de la valinomicina (rojo). B) Representación esquemática de un antiportador K+/H+. Se muestra el transporte simultáneo y en sentido opuesto de K+ y de H+ que cataliza este transportador en la membrana interna mitocondrial.
En la década de los sesenta no había técnicas establecidas para purificar proteínas de membrana para contestar estas preguntas. Tampoco existían modelos de membranas para probar su función. Hoy, por ejemplo, se dispone de los liposomas, vesículas formadas por bicapas de fosfolípidos que se extraen de las membranas mitocondriales.
A partir de nuestros trabajos relacionados con el transporte de K+ realizados en aquella década, en los que proponíamos la existencia de posibles sistemas de transporte que utilizaban indistintamente la energía necesaria para la síntesis del ATP, decidimos tratar de contestar esas preguntas durante nuestro primer año sabático en el laboratorio del Dr. Albert Lehninger1, de la Universidad de Johns Hopkins en la ciudad de Baltimore en 1970.
En el laboratorio del Dr. Lehninger se tenía gran experiencia en el estudio de los efectos del calcio (Ca2+) y su entrada al interior de la mitocondria. Lo más sobresaliente de sus observaciones era que se acumulaba Ca2+ y simultáneamente entraba fosfato (Pi2-), requerido para la respiración en las mitocondrias. Existía una relación estricta entre el consumo de oxígeno y el transporte de Ca2+, a saber, cinco átomos de calcio (2+) por cinco de fosfato (2-) por cada NADH oxidado en la cadena respiratoria. Este transporte se acompañaba de salida de H+. Durante el mismo se inhibía totalmente la síntesis del ATP, tal como habíamos observado con el K+.
Dada la experiencia en el transporte de calcio en el grupo del Dr. Lehninger, nos propusimos aislar y caracterizar el posible acarreador de Ca2+ de las membranas mitocondriales de hígado de rata. En retrospectiva, no pudimos haber escogido peor molécula acarreada ya que el calcio es un tenaz contaminante del agua, el aire, las paredes, el material de trabajo y los reactivos.
Como no teníamos la posibilidad de medir el transporte directamente, había que aislar la proteína acarreadora. El proyecto significaba un reto que requirió probar una gran cantidad de medios para solubilizar las proteínas extraídas a partir de las membranas internas mitocondriales (partículas submitocondriales) para posteriormente aislar la proteína acarreadora del resto, siguiendo su presencia bajo el supuesto de que debería ser una proteína poco soluble en agua y que fijara calcio con muy alta afinidad.
Durante ese año logramos aislar una proteína que fijaba el Ca2+ con muy alta afinidad a concentraciones nanomolares (10-9 M). Simultáneamente, el grupo del Dr. Carafoli en Zurich, aisló otra proteína con las mismas características. Ante este hecho, decidimos publicar nuestros hallazgos y los del grupo del Dr. Carafoli en la misma revista.
Continuamos, debido a que los resultados habían sido alentadores, durante una estancia corta en el laboratorio del Dr. Carafoli en Zurich y a través de sus frecuentes visitas a nuestro laboratorio en México. Con la cooperación entusiasta de la Dra. Marina Gavilanes Ruiz (Facultad de Química, UNAM), ampliamos nuestras observaciones sobre los efectos desacoplantes del calcio en la fosforilación oxidativa, mismas que sentaron las bases de la utilización del gradiente quimiósmotico postulado por Mitchell para el transporte de calcio en las membranas mitocondriales.
La historia de la purificación y caracterización del acarreador de calcio continuó por muchos años resistiéndose, hasta que en el Instituto de Cardiología, el Dr. Edmundo Chávez, antiguo colaborador de nuestro grupo en la Facultad de Medicina, junto con la Dra. Cecilia Zazueta, purificaron una glicoproteína de membrana interna mitocondrial que transporta Ca2+ y que resultó muy afín a un inhibidor del transporte de Ca2+ en mitocondrias: el Rojo de Rutenio. Éste fue clave fue para seguir al transportador a lo largo de los pasos de purificación y para caracterizar el transporte en liposomas.
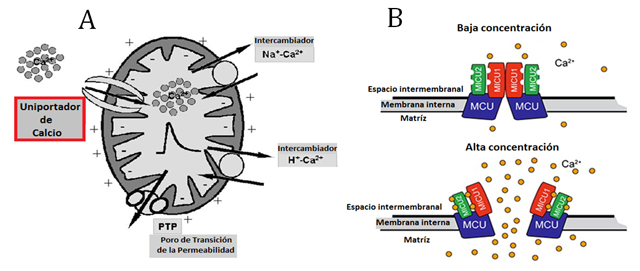
Figura 8. Diferentes proteínas que transportan el Ca2+ en las mitocondrias. A) Se muestran los diferentes transportadores de Ca2+ en la membrana interna mitocondrial, el uniportador transporta un ión Ca2+ a favor del gradiente de concentración existente entre el citoplasma y la matriz mitocondrial; los intercambiadores son dos antiportadores que translocan en sentidos opuestos iones sodio o protones en forma antiparalela al ión Ca2+. Finalmente el PTP (Poro de Transición a la Permeabilidad) del calcio, que se abre en condiciones de daño oxidativo mitocondrial o colapso de gradiente de protones. La apertura de este PTP es una señal de muerte celular por medio de la posterior liberación del citocromo c. B) Modelo del uniportador de Ca2+. Se muestran las tres diferentes subunidades de la proteína en varios colores: MCU: (Mitochondrial Calcium Uniporter) (azul), MCU1 (rojo) y MCU2 (verde). Las subunidades MCU1 y MCU2 son capaces de censar las concentraciones de Ca2+ del espacio intermembranal y abren el canal del uniportador al unir el Ca2+ proveniente del citoplasma para internalizarlo a la mitocondria.
El Ca2+ es un regulador metabólico en la célula, activa la contracción muscular y regula enzimas de importantes vías metabólicas. Se le conoce como un “segundo mensajero” y las mitocondrias tienen un papel preponderante en su regulación. La proteína que aislamos igual a la obtenida por el Dr. Carafoli corresponde al uniportador (tansportador transmembranal selectivo para un solo sustrato) de Ca2+, que ha sido purificada y caracterizada y cuyos componentes se esquematizan en el panel B de la figura 8.
La historia del acarreador de calcio no ha terminado, ya que existe una gran familia de proteínas que transportan calcio en la mitocondria. En la literatura se ha descrito tal número de acarreadores, que da la impresión de que no existiría espacio suficiente en la membrana para contenerlos a todos. Se han caracterizado acarreadores de sustratos oxidables de la cadena de transporte de electrones, tales como el succinato, malato y piruvato. El mejor estudiado y caracterizado es el llamado intercambiador ADP/ATP que transporta ADP al interior de la mitocondria y exporta el ATP sintetizado al citoplasma. Éste forma parte, junto con el de fosfato, del llamado ATP sintasoma, un supercomplejo de los acarreadores de fosfato y de ADP/ATP con la ATP sintasa.
Posteriormente concentramos nuestros estudios en el mecanismo de la enzima central en bioenergética: la F1F0-ATP sintasa mitocondrial. Logramos aislar por primera vez en México la F1-ATPasa mitocondrial y también demostrar que el ATP se sintetiza de manera espontánea dentro de los sitios catalíticos de la porción F1 con una relación de ATP/ADP de aproximadamente 1, es decir, con un equilibrio diferente al que ocurre in vitro en medio acuoso (recordar que éste es de 10-7), favoreciendo así la síntesis del ATP dentro de la enzima. Posteriormente, entre otros estudios, trabajamos con una legendaria proteína inhibidora (IF1) inicialmente aislada por los Dres. Maynard E. Pullman y Gladys C. Monroy en los sesenta. Ésta es un inhibidor natural de la enzima que previene la actividad de F1-ATPasa y así favorece la síntesis del ATP en la mitocondria. Fisiológicamente, la IF1 es importante, por ejemplo, en condiciones de isquemia o anoxia donde las células corren el riesgo de consumir sus pozas de ATP al hidrolizarlo. Esto ocurre sobre todo en tejidos de alto consumo del ATP mitocondrial, como el corazón, el músculo esquelético o el cerebro, y es en estos tejidos donde la IF1 se expresa mayoritariamente. Con medidas de actividad de la F1-ATPasa en presencia y ausencia de la IF1, encontramos que esta proteína se une a un intermediario F1-ADP para inhibir la actividad de F1-ATPasa, y que la IF1 inhibe tanto la actividad de F1F0-ATPasa como la de F1F0-ATP sintasa y por lo tanto tiene que liberar su efecto inhibitorio para permitir la síntesis del ATP dentro de la mitocondria en respuesta al gradiente de protones, esto sin que la IF1 se disocie completamente de la enzima.
Posteriormente, otros grupos, incluyendo al del Dr. José J. García Trejo2 (Facultad de Química, UNAM), han encontrado que la IF1 inhibe el mecanismo rotacional intrínseco de la enzima, dado que otros grupos demostraron que la enzima es un nanomotor con una parte giratoria o rotor y una fija o estator. Además, el Dr. García Trejo encontró que la IF1 funciona como una tranca para bloquear la rotación del nanomotor, y que además la IF1 dimeriza la F1F0-ATP sintasa en la mitocondria, y que esta dimerización es un factor determinante en la formación de las crestas mitocondriales. Esto ha sido de gran impacto en la bioenergética mitocondrial y ha abierto un nuevo campo en la biología estructural mitocondrial, donde se estudia la estructura y el acomodo de los dímeros de la ATP sintasa en las crestas tubulares de la membrana interna mitocondrial en conjunto con otros complejos y supercomplejos respiratorios. Este campo tiene grandes implicaciones en la morfología mitocondrial, en las miopatías mitocondriales, el metabolismo mitocondrial y en los nuevos modelos de la fosforilación oxidativa en general.
El Dr. García Trejo descubrió después un nuevo inhibidor natural de la ATP sintasa bacteriana, al que denominó subunidad ζ, el cual es también un potente inhibidor de la actividad de F1-ATPasa y del giro del rotor de la enzima, pero es diferente tanto en secuencia como en estructura terciaria a la IF1 o a la subunidad ε. Esta última es un inhibidor endógeno de la enzima bacteriana. Por lo tanto, este hallazgo abre una nueva línea de investigación del control de la rotación intrínseca del nanomotor en la clase de las a-proteobacterias como Paracoccus denitrificans. Esta bacteria es, por cierto, un predecesor en la evolución de las mitocondrias, de tal modo que este inhibidor o subunidad ζ es también un intermediario evolutivo importante en la regulación del nanomotor, dado que esta subunidad ζ surgió de manera previa al origen evolutivo mitocondrial por endosimbiosis, en el cual, hace varios millones de años una α-proteobacteria respiratoria fue engullida por una célula protoeucarionte carente de fosforilación oxidativa, y ambas células establecieron una simbiosis que dio origen a las actuales mitocondrias (Figura 9).
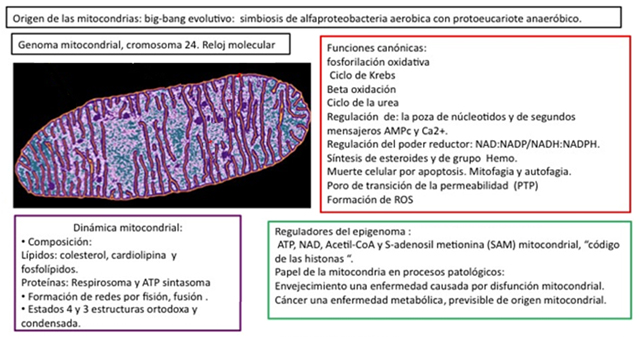
Figura 9. Funciones nuevas y canónicas de la mitocondria. Las funciones canónicas bioenergéticas centrales, explicadas anteriormente, se muestran en rojo. Evolutivamente se cree que las mitocondrias provienen de las α-proteobacterias como Paracoccus denitrificans (ver texto), hace varios millones de años una de estas bacterias hizo una endosimbiosis con un protoeucarionte, culminando en el origen de las mitocondrias actuales que conservan un ADN mitocondrial. Esto se muestra en los cuadros superiores. La dinámica mitocondrial y el papel de la mitocondria como regulador del epigenoma, los procesos patológicos, la muerte celular y el envejecimiento se muestran en los cuadros inferiores en morado y verde, repectivamente.
Como se mencionó anteriormente, en la mitocondriología moderna se han realizado enormes progresos utilizando las nuevas tecnologías surgidas de la biología molecular: la cristalografía, la resonancia magnética nuclear y la calorimetría, entre otras, todas apoyadas por los grandes avances computacionales de modelado de proteínas que han colocado a las mitocondrias en el centro del metabolismo celular, a partir del descubrimiento de nuevas e insospechadas funciones.
A manera de conclusión, presentamos una lista de las funciones de la mitocondria, la mayor parte de ellas descubierta en la era de la bioquímica moderna.
La mitocondria tiene un papel fundamental en la regulación de la poza de nucleótidos y de los segundos mensajeros: el AMP cíclico y el calcio.
Regula el llamado poder reductor NAD/NADH y NADP/NADPH o estado de oxidación/reducción celular.
Regula los procesos de muerte celular por apoptosis y los procesos de mitofagia y autofagia.
Toma parte en la formación del poro de transición de la permeabilidad mitocondrial (PTP) que altera la fosforilación oxidativa y las pozas de calcio intracelular, fosfato y nucleótidos.
Surte de sustratos como el ATP, NAD, Acetilcoenzima A y S- adenosil metionina que regulan el código de las histonas del DNA nuclear que forman el Epigenoma.
Forman redes por fusión de sus membranas, el objetivo es mantener homogénea la población y aumentar su eficiencia. En condiciones patológicas las redes se alteran por el proceso de fisión mitocondrial.
Son un factor importante en los procesos de envejecimiento por su producción de la cadena de transporte de electrones de especie reactivas de oxígeno (EROS) que dañan las proteínas, lípidos y ADN.
La disfunción mitocondrial se considera el evento primario común en la degeneración cancerosa de las células humanas. 
1 El autor del libro más popular de bioquímica básica.
2 Egresado de nuestros laboratorios y coautor de este artículo.
Glosario de términos
Fosforilación Oxidativa: el viaje de los electrones a través de la cadena de transporte de electrones o cadena respiratoria, genera una diferencia de pH (∆pH) y de cargas (∆ψ) a ambos lados de la membrana interna mitocondrial, que es la fuente de energía que utiliza la ATP sintasa para sintetizar el ATP.Ionóforos: antibióticos con superficie hidrofóbica, capaces de unir cationes en su interior, disolverse en la membrana y transportar los iones al interior de las mitocondrias. El Dinitrofenol (DNP) es un ionóforo de H+ que actúa como desacoplante porque establece un corto circuito de H+ que descarga el delta pH, acelera la respiración e inhibe la síntesis de ATP.
Los transportadores de membrana mitocondrial se clasifican por el tipo de intercambio que realizan: uniportadores, un ejemplo es el de calcio dado que transporta una única especie química. Antiportadores: transportan dos especies químicas en sentidos opuestos a través de la membrana, por ejemplo el de K+ es un intercambiador K+/H+. Simportadores o cotransportadores: transportan dos especies químicas en el mismo sentido a través de la membrana, como el de calcio/fosfato.
Apoptosis: es un proceso programado que lleva a la muerte celular, en el que la salida del citocromo “c” de la mitocondria así como la apertura del poro de transición de la permeabilidad (PTP) y la entrada masiva de calcio en la membrana interna mitocondrial son factores determinantes de la muerte celular.
Endosimbiosis mitocondrial: proceso evolutivo por el cual hace varios millones de años una protobacteria respiratoria de la clase alfa (a-protobacteria) se transformó en mitocondria después de ser interiorizada al citoplasma de otra célula protoeucarionte carente de respiración, por medio de una relación simbiótica entre ambas células que eventualmente formó a las mitocondrias actuales.
Epigenoma: modificaciones del DNA nuclear que no cambian su secuencia pero afectan la actividad de los genes a través del llamado código de las histonas.
Respirosoma: supercomplejos de la cadena de transporte de electrones.
ATP sintasoma: supercomplejo formado por la ATP sintasa, el acarreador de ADP/ATP y el acarreador de fosfato.
Autofagia y mitofagia: es un proceso de degradación y reciclaje de los componentes celulares. Funciona durante la proliferación y diferenciación celular, la respuesta inmune a patógenos, en el cáncer, la apoptosis y para obtención de energía durante condiciones adversas.
Especies reactivas de oxígeno (EROS) o (ROS): se derivan de la molécula de oxígeno por reducción química parcial. Incluyen el peróxido de hidrógeno (H2O2),el radical superóxido (O2-), el radical hidroxilo (OH-), el dióxido de nitrógeno (NO2-) y el óxido nítrico (NO).
Fuerza protón-motriz (ΔμH+): Gradiente electroquímico de protones establecido a través de las membranas transductoras de energía. Tiene un componente eléctrico (Δψ) por diferencia de cargas a través de la membrana y un componente químico (ΔpH) por diferencia en concentración de protones (H+) (o pH) a través de la membrana. Es la fuerza impulsora para la síntesis del ATP para todos los seres vivos.
Abreviaturas
Acetil-CoA : acetil Coenzima AADP: adenosín difosfato.
ATP. adenosín trifosfato.
Citocromos: a, a3, b, c y c1. Oxidados y reducidos.
FAD/FADH: coenzimas acarreadoras de electrones de la cadena respiratoria; flavín adenín dinucleótido en sus formas oxidado y reducido.
F1-ATPasa: porción soluble extramembranal de la F1F0-ATP sintasa que contiene los sitios catalíticos donde se sintetiza e hidroliza al ATP. Se llama ATPasa porque al separarse de la membrana (in vitro) conserva solamente la actividad de hidrólisis del ATP.
F1F0-ATP sintasa: complejo V respiratorio o complejo ATP sintasa completo; contiene a la porción extramembranal (F1) catalítico y al sector intramembranal (F0) que funciona como canal de protones o iones sodio. Ambos sectores se acoplan por un mecanismo rotacional para formar el nanomotor F1F0 completo.
MCU: uniportador de calcio (derivado del inglés Mitochondrial Calcium Uniporter).
NAD/NADH: nicotina amida adenín dinucleótido. Oxidado y reducido.
NADP/NADPH: nicotínamida adenín dinucleótido fosfato. Oxidado y reducido.
PTP: poro de la Transición de la Permeabilidad mitocondrial al calcio.
Q/QH2: ubiquinona oxidada y reducida.
COMENTARIOS
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
2013 Esta obra está bajo una licencia de Creative Commons