Vol. 23, núm. 2 marzo-abril 2022
Comunicación a través del olor: las plantas y sus secretos
Felipe de Jesús Torres-Salazar y Paula Sosenski CitaResumen
Las interacciones que ocurren entre las angiospermas y otros organismos en la naturaleza son mediadas por una amplia diversidad de atributos de las plantas, entre los que destacan los compuestos orgánicos volátiles que participan en la comunicación química. Estos compuestos actúan como señales químicas que transmiten información específica de la planta y son detectados por organismos mutualistas o antagonistas.
Palabras clave: compuestos volátiles, comunicación química, interacciones bióticas, mutualistas, antagonistas.
Communication through smell: plants and their secrets
Abstract
The interactions that occur between the angiosperms and other organisms are mediated by a wide variety of plant attributes. Among these attributes, the volatile organic compounds that participate in chemical communication stand out. These compounds act as chemical signals that convey plant-specific information and are detected by mutualistic or antagonistic organisms.
Keywords: volatile compounds, chemical communication, biotic interactions, mutualists, antagonist.
Introducción
A lo largo del tiempo, la selección natural ha favorecido la evolución de caracteres que permiten a los organismos mediar las interacciones con su ambiente. En el caso de las angiospermas, o plantas con flores, el papel de la selección natural se hace particularmente evidente cuando se pone bajo la lupa la extraordinaria diversidad de adaptaciones morfológicas, fisiológicas y químicas que permiten a las plantas responder a distintas presiones ambientales bióticas y abióticas. Una de las peculiaridades de las plantas es que son sésiles, es decir, no se pueden desplazar de un lado a otro, como es el caso de los animales. Esta característica hace que presenten estrategias que incrementan su eficiencia al interactuar con organismos de la misma o distinta especie, los cuales podrían tener efectos positivos o negativos sobre su reproducción y sobrevivencia. Una de estas estrategias es la comunicación química, que se da a través de la emisión de compuestos orgánicos volátiles, los cuales hacen posible el paso de información química de las plantas a otros organismos.
Compuestos orgánicos volátiles ¿qué son y cuál es su función?
Los compuestos orgánicos volátiles (a los que de aquí en adelante llamaremos compuestos volátiles) son pequeñas y ligeras moléculas de baja polaridad, con una alta presión de vapor, que les permite una fácil dispersión dentro y fuera de la planta (cuando estos son liberados al aire). Estas moléculas y sus diversas combinaciones conforman lo que percibimos como aromas.
Algunos de estos olores podrían no ser percibidos por los humanos, pero sí ser detectados por las plantas que los producen y sus interactores, para los que constituyen un universo de información; razón por la cual los compuestos volátiles también son conocidos como infoquímicos. Las moléculas responsables de los aromas se originan en distintas rutas del metabolismo secundario1 de las plantas y pueden producirse en órganos aéreos (hojas, tallos, flores y frutos) y subterráneos (raíces). El papel principal de los compuestos volátiles es mediar la interacción entre las plantas y otros organismos. Esto significa que, actúan como un puente químico de comunicación a través del cual una planta (emisor) emite una señal química que otro organismo es capaz de percibir (receptor). En otras palabras, los compuestos volátiles funcionan como la moneda de cambio en el proceso de comunicación. La respuesta del organismo receptor dependerá del tipo, la intensidad y la especificidad de la señal química emitida por la planta.
Las funciones de los compuestos volátiles de las plantas son diversas, y entre éstas destacan: atraer polinizadores, frugívoros y dispersores de semillas, ahuyentar herbívoros o depredadores de semillas, atraer parasitoides de herbívoros que dañan la planta, entre otras (ver figura 1). Además, los compuestos volátiles participan en la comunicación planta-planta y en la señalización que ocurre dentro de una misma planta.
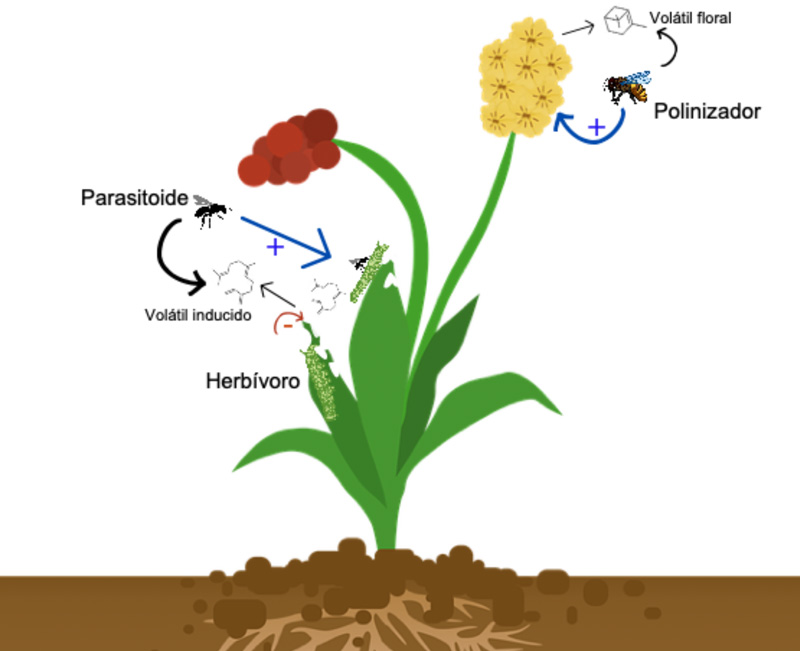
Figura 1. Los compuestos volátiles florales atraen polinizadores a las flores, que tienen un efecto positivo sobre la reproducción de la planta. Los compuestos volátiles inducidos que son liberados por las hojas dañadas por herbívoros atraen parasitoides que eliminan a estos últimos, con un efecto positivo sobre el desempeño y la sobrevivencia de la planta.
Crédito: elaboración propia.
Función ecológica de los compuestos volátiles producidos por raíces y hojas
De acuerdo con el órgano del cual se emiten, los compuestos volátiles pueden mediar las interacciones planta-planta o planta-animal que ocurren por debajo o por encima del suelo. Por un lado, en el caso de las interacciones subterráneas planta-planta, la selección natural ha favorecido la evolución de los mecanismos que permiten a las plantas emitir y recibir señales químicas para comunicarse a través de las raíces. Por ejemplo, Gfeller y colaboradores (2019) demostraron que ciertos compuestos volátiles emitidos por las raíces de la especie Centaurea stoebe facilitan la germinación y el crecimiento de otras especies en su vecindario, al potenciar ciertos procesos fisiológicos (ver figura 2). Aunque el crecimiento de plantas de otras especies podría resultar desventajoso para C. stoebe, al competir por los mismos recursos, los compuestos volátiles producidos por las raíces también podrían proteger a las plantas de herbívoros y patógenos.
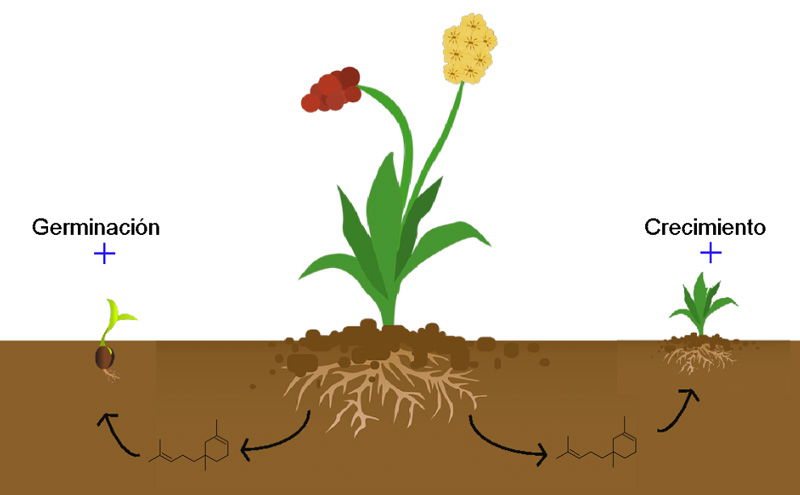
Figura 2. Los volátiles emitidos por las raíces de algunas especies pueden inducir la germinación de semillas y el crecimiento de plántulas que se encuentran alrededor.
Crédito: elaboración propia.
Casos como el anterior han generado una gran curiosidad por entender cómo ocurre la comunicación química entre plantas vecinas por debajo del suelo y, en particular, qué mecanismos desencadenan la síntesis y la emisión de compuestos volátiles en las raíces, cuáles son sus efectos sobre las plantas vecinas, o qué mecanismos permiten a las plantas responder ante las señales químicas emitidas por otras plantas.
Por otro lado, los compuestos volátiles producidos por las estructuras vegetativas aéreas también juegan un papel central en mediar interacciones bióticas, como la herbivoría (cuando una planta es consumida por un organismo que daña sus tejidos). Por ejemplo, los compuestos volátiles emitidos por las hojas — consideradas como las máquinas de producción de energía dado que realizan la fotosíntesis— han sido estudiados por su papel en la defensa de las plantas contra los herbívoros. Aunque es común que las hojas produzcan compuestos volátiles, se sabe que cuando éstas sufren un daño dichos compuestos son emitidos con mayor intensidad. Esta respuesta funciona como una señal que informa a plantas cercanas de la misma especie del riesgo, lo cual puede desencadenar la activación de defensas químicas en el grupo de plantas (ver video). Esto a su vez advierte a los herbívoros que las plantas han sido dañadas y que han producido una defensa para evitar seguir siendo consumidas.
El frijol lima (Phaseolus lunatus) es un buen ejemplo de plantas que emiten señales químicas para advertir peligro. Kost y Heil (2006) descubrieron que el daño por herbivoría en esta especie no sólo induce la producción de compuestos volátiles en las hojas, sino que éstos también funcionan como señales químicas que les permiten atraer organismos como los parasitoides, lo que las ayudan a defenderse contra sus herbívoros. Los parasitoides son insectos, en su mayoría del grupo de las avispas, que parasitan a los herbívoros para asegurar que sus larvas puedan desarrollarse en el interior o exterior de la superficie corporal de estos organismos, con el fin de obtener los recursos necesarios y cumplir su ciclo de vida. Dicha dinámica genera un beneficio para la planta, ya que los compuestos volátiles inducidos permiten el “control biológico” de los herbívoros por parte de los parasitoides.
De Moraes y colaboradores (1998) encontraron que especies de importancia económica como el maíz, el tabaco y el algodón inducen la producción de compuestos volátiles específicos dependiendo del herbívoro que las daña. Esto permite que los compuestos volátiles actúen como una señal altamente específica, que ayuda a los parasitoides a detectar los herbívoros que habrán de parasitar. Este ejemplo demuestra la alta complejidad de las señales químicas producidas por las plantas y su efecto en múltiples interacciones bióticas.
El papel de los compuestos volátiles en la polinización y dispersión de frutos y semillas
Dado que las plantas son organismos sésiles, requieren de vectores para transferir el polen de una planta a otra y, así, llevar a cabo su reproducción sexual. Por un lado, los vectores bióticos son los animales a los que se denomina polinizadores. Por el otro, los vectores abióticos son el agua y viento.
En el caso de las plantas que dependen de la polinización animal, las flores presentan un conjunto de atributos que atraen a distintos tipos de polinizadores, por ejemplo: abejas, mariposas, pájaros, murciélagos, entre muchos otros. Estas características no sólo hacen a las flores atractivas, sino que funcionan como señales que aportan información sobre la cantidad y la calidad de las recompensas florales, que son los recursos de los que se alimentan los polinizadores cuando visitan una flor (como néctar y polen).
Uno de los rasgos florales asociados con las preferencias de los polinizadores es el aroma o bouquet floral, que es producido por una combinación de compuestos volátiles específicos, que pueden ser emitidos por distintas partes de la flor, como los pétalos, las estructuras sexuales o, incluso, los granos de polen. Hasta la fecha, se han detectado más de 1700 compuestos volátiles florales, pero todavía faltan muchos por identificar. A pesar de que su función principal es mediar las interacciones de las plantas con los polinizadores también pueden atraer o repeler florívoros (organismos que consumen y dañan el tejido de las flores), depredadores de semillas, y patógenos (que afectan a las flores o a los polinizadores).
Un ejemplo que ilustra el papel de los compuestos volátiles en la atracción de polinizadores es el de las abejas euglosinas y las orquídeas que ellas polinizan. Cuando los machos de estas abejas visitan una orquídea, colectan fragancias florales al frotar sus patas con la superficie de la flor. Los machos almacenan estos compuestos aromáticos en pequeñas bolsas que tienen en las tibias de las patas traseras. Después, durante el cortejo sexual, exponen estas fragancias que actúan como sustitutos de las feromonas,2 por lo que ayudan en la atracción de las hembras. Así, esta peculiar interacción nos permite imaginar cómo las señales químicas emitidas por las plantas pueden ser usadas por los animales con los que interactúan en su beneficio.
Después de que ocurre la reproducción, las plantas dispersan las semillas contenidas en los frutos, para asegurar la propagación de nuevas plántulas. Las especies con frutos carnosos presentan adaptaciones que les permiten atraer a los mutualistas3 que se alimentan de sus frutos (conocidos como frugívoros), y dispersan sus semillas luego de que éstas pasan a través de su tracto intestinal (endozoocoria4). Entre estas adaptaciones se encuentran las señales de atracción visuales, olfativas y táctiles que son percibidas por dichos animales. La interacción entre las plantas y los dispersores de semillas implica un intercambio, ya que estos últimos obtienen la energía necesaria de los frutos que consumen y las plantas logran asegurar su permanencia a través de la dispersión de las semillas. Aunque el olor de los frutos ha sido poco estudiado en comparación con otros atributos como su color o tamaño, se ha demostrado que puede tener un efecto importante sobre las preferencias de los frugívoros. Por ejemplo, la evolución del aroma de los frutos de algunas especies se relaciona con la atracción de animales como murciélagos, elefantes y lémures que se alimentan de noche. Ellos tienen un sistema olfativo capaz de detectar a grandes distancias el aroma de los frutos que consumen, por lo que son dispersores muy eficientes.

Figura 3. Las semillas de Stemona tuberosa son dispersadas por la avispa Vespa velutina, que es atraída por los compuestos químicos presentes en la cubierta de las semillas.
Créditos: Jidanni, 2018 y Solabarrieta, 2012.
Efecto de las variables ambientales sobre la emisión de compuestos volátiles
Uno de los intereses de los ecólogos químicos, en los últimos años, ha sido tratar de entender el efecto del cambio global sobre la emisión de compuestos volátiles en plantas. En particular, se ha demostrado que la producción de dichos compuestos responde al estrés ambiental, como consecuencia de cambios drásticos en factores como la temperatura, la humedad ambiental, la humedad del suelo, la concentración de dióxido de carbono (CO2) y/o de ozono (CO3), entre otros. El ozono, por ejemplo, considerado uno de los gases de efecto invernadero más contaminantes, puede afectar positiva o negativamente la emisión de ciertos compuestos volátiles, según el nivel al que estén expuestas las plantas. De manera reciente, Saunier y Blande (2019) detectaron que la emisión de compuestos conocidos como diterpenos5 y su contribución relativa al bouquet floral fue afectada en plantas de cuatro especies de Brassicáceas que fueron expuestas a dos concentraciones diferentes de ozono (80 y 120 partes por billón), lo cual podría tener un efecto sobre las preferencias de los polinizadores.
Además, la poca disponibilidad de agua en el suelo también puede afectar la emisión de compuestos volátiles, pues induciría el cierre de estomas y reduciría la evapotranspiración en hojas y pétalos, lo que limitaría los recursos que las plantas tendrían disponibles para invertir en la síntesis de compuestos químicos. Lo anterior es una posible explicación a la reducción en la emisión de diversos compuestos volátiles florales o vegetativos reportada en plantas que crecen en condiciones de estrés hídrico. En el mismo sentido, la baja emisión de ciertos compuestos volátiles florales activos podría afectar la detección del aroma por parte de polinizadores especializados, con consecuencias negativas sobre la polinización de las plantas. Estos ejemplos muestran la relevancia de entender cómo las variables climáticas asociadas al calentamiento global pueden modificar las señales químicas emitidas por las plantas, así como las respuestas de los organismos con los que interactúan.
Conclusión
La comunicación química mediada por compuestos volátiles ha jugado un papel central en la evolución y el mantenimiento de las interacciones entre las plantas y otros organismos. En los últimos años se ha reportado un avance importante en el estudio de estos compuestos, lo cual ha facilitado su identificación y cuantificación en un gran número de especies. Aunque esto ha permitido tener una mejor comprensión del lenguaje químico en distintos grupos de angiospermas, todavía queda mucho trabajo por hacer. Por ejemplo, aún existe muy poca información sobre los compuestos volátiles de especies nativas, endémicas e invasoras que integran las comunidades vegetales en diferentes ecosistemas. Esta información, asociada a una caracterización más completa de las interacciones multiespecíficas (entre varias especies) de las plantas, así como de la función ecológica de los principales compuestos volátiles que median estas interacciones, nos permitirá contribuir con una perspectiva integral al estudio de la evolución y la diversidad de las señales químicas en plantas.
Referencias
- Blande J. D., y R. Glinwood (Eds.). (2016). Deciphering chemical language of plant communication. Springer.
- Chen, G., Wang Z.-W., Wen, P., Wei, W., Chen, Y., H., Ai, y Sun W.-B. (2018). Hydrocarbons mediate seed dispersal: a new mechanism of vespicochory. New Phytologist, 220, 714-725. https://doi.org/10.1111/nph.15166.
- De Moraes, C. M., Lewis, W. J., Paré, P. W., Alborn, H. T., y Tumlinson, J. H. (1998, 11 de junio). Herbivore-infested plants selectively attract parasitoids, Nature, 393, 570-573. https://doi.org/10.1038/31219.
- Farré-Armengol, G., Filella, I., Llusia, J., y Peñuelas, J. (2013). Floral volatile organic compounds: Between attraction and deterrence of visitors under global change. Perspectives in Plant Ecology, Evolution and Systematics, 15(1), 56-67. https://doi.org/10.1016/j.ppees.2012.12.002.
- Gfeller, V., Huber, M., Förster, C., Huang, W., Köllner, T. G., y Erb, M. (2019). Root volatiles in plant–plant interactions i: High root sesquiterpene release is associated with increased germination and growth of plant neighbours. Plant, Cell Environment, 42(6), 1950-1963. https://doi.org/10.1111/pce.13532.
- Jidanni. (2018, 28 de noviembre). Yam family Dongshi [fotografía]. Wikimedia Commons. https://en.wikipedia.org/wiki/File:Yam_family_Dongshi.jpg.
- Kost, C., y Heil, M. (2006, 10 de abril). Herbivore-induced plant volatiles induce an indirect defence in neighbouring plants. Journal of Ecology, 94(3), 619-628. https://doi.org/10.1111/j.1365-2745.2006.01120.x.
- nctv7. (2012, 23 de febrero). Las plantas hablan entre ellas Video bbc Mundo . YouTube. https://youtu.be/_vTWswnqg0k.
- Raguso, R. A. (2008, 1 de diciembre). Wake Up and Smell the Roses: The Ecology and Evolution of Floral Scent. Annual Review of Ecology, Evolution, and Systematics, 39, 549-569. https://doi.org/10.1146/annurev.ecolsys.38.091206.095601.
- Saunier, A., y Blande, J. D. (2019), The effect of elevated ozone on floral chemistry of Brassicaceae species. Environmental Pollution, 255, 113257. https://doi.org/10.1016/j.envpol.2019.113257.
- Schiestl, F. P. (2015). Ecology and evolution of floral volatile-mediated information transfer in plants. New Phytologist, 206(2), 571-577. https://doi.org/10.1111/nph.13243.
- Solabarrieta, D. (2012, 9 de octubre). Vespa velutina 0001 [fotografía]. Wikimedia Commons. https://en.wikipedia.org/wiki/File:Vespa_velutina_0001.jpg.
Agradecimientos
Este trabajo fue financiado por Ciencia de Frontera conacyt (840803).
Recepción: 27/07/2021. Aprobación: 07/01/2021.
Vol. 23, núm. 2 marzo-abril 2022
Herramientas matemáticas y políticas para reducir el efecto invernadero
Aurora del Carmen Munguía López y José María Ponce Ortega CitaResumen
En la actualidad, uno de los retos más importantes es desarrollar acercamientos para abordar problemas como la creciente generación de emisiones en el sector energético, debido a las consecuencias negativas que esto puede tener en nuestra vida diaria. En relación con estas problemáticas, se ha propuesto formular modelos matemáticos para evaluar políticas de carbono en sistemas de generación de energía no convencionales, que permitan reducir las emisiones. Estas políticas de carbono involucran impuestos y bonos de carbono para disminuir las emisiones; y algunos de los sistemas no convencionales incluyen plantas de potencia que utilizan combustión indirecta con un sistema de cultivo de algas y plantas de potencia de doble propósito, que incluyen el uso de biocombustibles y energía solar. El objetivo de este trabajo es mostrar cómo estas herramientas matemáticas y políticas permiten obtener soluciones óptimas que incluyen relaciones complejas entre aspectos económicos, ambientales, y sociales. Esto facilita la toma de decisiones en esquemas no convencionales de generación de energía.
Palabras clave: políticas de carbono, reducción de emisiones, sector energético, modelos matemáticos.
Mathematical and Policy Tools to Reduce Greenhouse Emissions
Abstract
Currently, one of the most important challenges is to develop approaches to address problems such as the growing generation of emissions in the energy sector, due to the negative consequences that this can have on our daily lives. In relation to these problems, it has been proposed to formulate mathematical models to evaluate carbon policies in non-conventional energy generation systems that allow emissions to be reduced. These carbon policies involve taxes and carbon credits to reduce emissions; and some of these unconventional systems include power plants that use indirect combustion with an algae cultivation system and dual-purpose power plants that include the use of biofuels and solar energy. The objective of this work is to show how these mathematical and political tools allow to obtain optimal solutions that include complex relationships between economic, environmental, and social aspects. This facilitates decision making in non-conventional power generation schemes.
Keywords: carbon policies, emission reduction, energy sector, mathematical models.
Introducción
En la actualidad, uno de los retos más importantes es desarrollar acercamientos para abordar problemas como la creciente generación de emisiones de Gases de Efecto Invernadero (gei) en el sector energético. Los principales gei en la atmósfera terrestre son el vapor de agua (H2O), el dióxido de carbono (CO2), el metano (CH4), el óxido nitroso (N2O) y el ozono (O3). En estudios previos se ha demostrado la naturaleza de captura de calor de estos gases (esto provoca un aumento en la temperatura global). Asimismo, de manera reciente, se ha observado un gran incremento en los niveles de los gei debido a las actividades humanas. Se considera que este incremento causa el calentamiento extremo de la tierra y los cambios climáticos.
Es muy importante resaltar que la crisis climática tiene varios impactos negativos. Uno de ellos es que modifica el ciclo del agua y, por lo tanto, afecta la calidad y cantidad disponibles de este líquido. También puede alterar el impacto de los desastres naturales, causando más y de mayor magnitud. Algunos de éstos, tales como las olas de calor, inundaciones y sequías provocan, además, defunciones y enfermedades. Todo esto podría afectar de manera significativa y permanente la forma en la que vivimos.
El cambio en la temperatura global en los últimos años es muy alarmante, y en muchas partes del mundo se han notado las consecuencias: por ejemplo, días significativamente más cálidos, incluso con temperaturas extremas. De acuerdo con datos reportados por la nasa (s. f.), los años 2016 y 2020 han sido los de mayor temperatura que se han registrado desde 1880. Además, los 10 años más cálidos en este período han ocurrido desde 2005 (ver figuras 1 y 2).
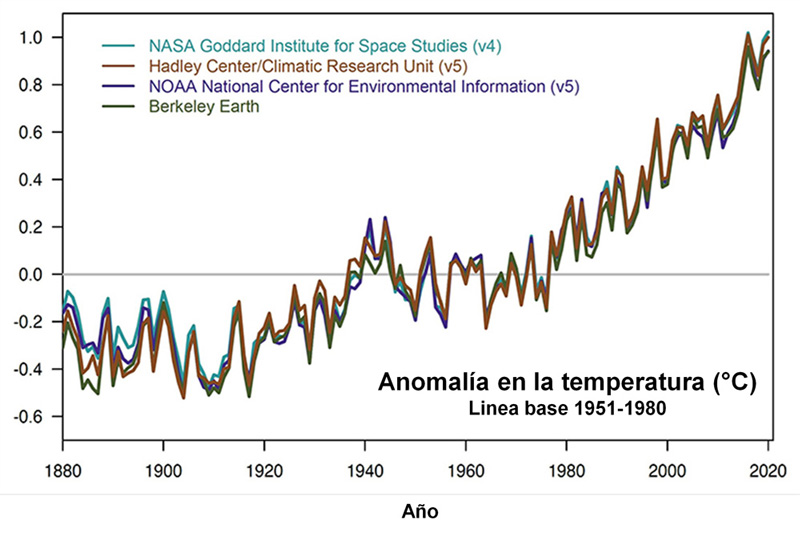
Figura 1. Datos históricos del cambio en la temperatura global de acuerdo con distintos institutos, desde 1880 hasta 2020 (adaptada de nasa, s. f.).
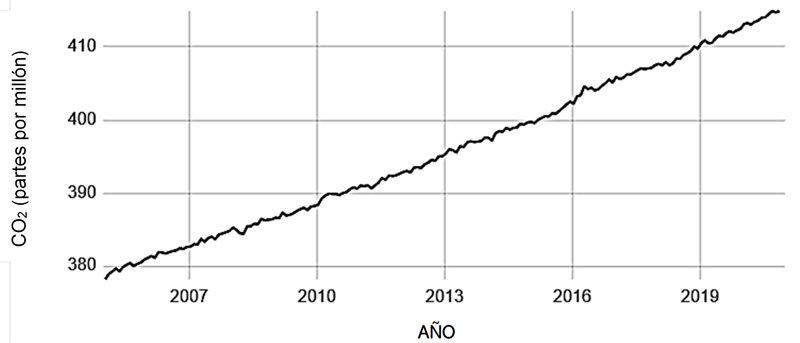
Figura 2. Rápido aumento de la concentración del dióxido de carbono en la atmósfera desde 2005 hasta el 2020 .Adaptado de National Oceanic and Atmospheric Administration (noaa, s. f.).
El CO2 presente en la atmósfera nunca había alcanzado una concentración mayor a las 300 partes por millón (ppm) hasta el año 1950 y a partir de ahí ha seguido incrementando. En estudios previos se ha demostrado la naturaleza de captura de calor del dióxido de carbono y otros gases. Además, los años de mayor cambio en la temperatura global coinciden con los de mayor rapidez de aumento de la concentración del CO2. Por lo tanto, se considera que el incremento de los niveles en los gei causa el calentamiento de la tierra y, por ende, los cambios climáticos. El Panel Intergubernamental del Cambio Climático afirma que la evidencia científica para el calentamiento del sistema climático es inequívoca y que es 95% probable que este calentamiento sea resultado de las actividades humanas (nasa, s. f.).
De acuerdo con la Environmental Protection Agency (epa, s. f.) de Estados Unidos, la producción de electricidad es la segunda mayor fuente de emisiones de dióxido de carbono (ver figura 3), además de que aproximadamente 63% del consumo de energía procede de combustibles fósiles (petróleo, carbón y gas natural). Esta agencia estima que, para el 2050, todas las emisiones de gei provenientes de tecnologías relacionadas con la generación de energía necesitarán ser reducidas a la mitad de sus niveles de 2007 para estabilizar el calentamiento global.
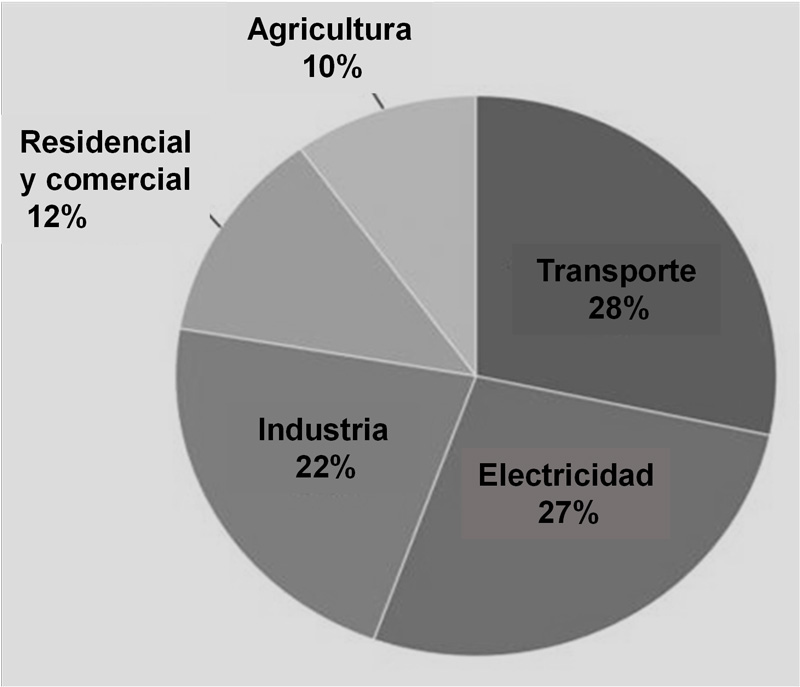
Figura 3. Emisiones de CO2 en Estados Unidos por sector económico en 2018 (adaptado de epa, s. f.).
Tomando en cuenta lo anterior, el objetivo de este trabajo es mostrar cómo ciertas herramientas matemáticas combinadas con modelos y políticas de carbono permiten obtener soluciones para reducir las emisiones de gei.
¿Qué son las políticas de carbono?
Para buscar una solución a estos problemas, se ha propuesto evaluar, a través de modelos matemáticos, diferentes políticas de carbono en sistemas de generación de energía no convencionales. Así, con el fin de reducir las emisiones, distintos gobiernos han desarrollado políticas de carbono, que se definen como instrumentos económicos que incluyen penalizaciones (Vatn, 2015) y compensaciones económicas (Secretaría de Medio Ambiente y Recursos Naturales [Semarnat] e Instituto Nacional de Ecología y Cambio Climático [inecc], 2012).
Una de estas políticas es el impuesto sobre el carbono, el cual se puede ver como una multa por las emisiones generadas. Este impuesto se define como un costo por tonelada de CO2 producido. La otra política es el crédito fiscal o bono de carbono. Este bono es una compensación por las emisiones evitadas (Baranzini et al., 2000) y se define como un pago por tonelada de CO2 evitado. Esta reducción ocurre después de un cambio en las tecnologías o en el proceso de producción incluyendo el uso de energías alternativas y biocombustibles. Estos parámetros se han abordado en la economía como el “principio de quien contamina paga” y el “principio de quien coopera obtiene” (Vatn, 2015). Esto significa que quienes alteran el medio ambiente deben pagar y quienes lo mejoran deben ser compensados (Avi-Yonah y Uhlmann, 2009).
Es importante notar que si la decisión es invertir en combustibles renovables (Cristóbal et al., 2012) o cambiar de tecnologías para reducir las emisiones (Afzal et al., 2018), existen costos asociados. Sin embargo, también se considera que las emisiones generan costos no deseados. Por esta razón, es posible usar los impuestos y bonos para limitar las emisiones en sistemas de generación de energía (Fuentes-Cortés et al., 2018). Estas políticas se han implementado en diversos sistemas energéticos, por ejemplo, en redes eléctricas (Feijoo y Das, 2014) y en sistemas de ahorro de energía y reducción de emisiones (Fang et al., 2017).
Valores económicos para los impuestos y bonos de carbono
Se ha hablado de los valores para los impuestos y bonos de carbono que ya han sido usados en distintos países o que están dentro de los planes para su uso futuro. En el caso de México, para la penalización económica (impuesto), es probable que se consideren en futuras regulaciones los valores de 10 y 15 dólares estadounidenses (usd)/tonelada de CO2 (semarnat e inecc, 2012). En comparación, los valores de 25, 32, 41 y 52 usd /tonelada de CO2 se han utilizado como impuestos o multas sobre el carbono en Estados Unidos (Kaufman et al., 2016).
Por otro lado, los bonos de carbono reportados fluctúan entre 0.3 a 130 usd/tonelada de CO2 evitado. El CO2 evitado se refiere a las emisiones que no se generan al producir cierta cantidad de electricidad, gracias a que se usaron tecnologías alternativas. El valor promedio de estas compensaciones ha cambiado en los últimos años de 4 a 7 usd/tonelada de CO2, y para la mayoría de las emisiones mundiales se utiliza un valor de 10 usd/tonelada de CO2, aunque el bono de 80-120 usd/tonelada de CO2 ha sido estimado por modelos económicos (Kossoy et al., 2015). Es importante determinar el valor óptimo de las multas y bonos que se deben usar en los sistemas de reducción de emisiones. A continuación, se explican algunos de ellos.
Sistemas de generación de energía no convencionales que incluyen reducción de emisiones
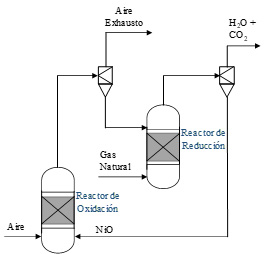
Figura 1. Ácidos nucleicos.
Un ejemplo es un ciclo de potencia que incluye el uso de sistemas de combustión indirecta o clc (por sus siglas en inglés: Chemical Looping Combustion). Éstos pueden capturar el CO2 con solamente una pequeña penalización en la eficiencia de la planta. En la combustión convencional, el combustible arde al reaccionar con el oxígeno que está en el aire.1 En cambio, en los sistemas de combustión indirecta el combustible que se va a consumir no entra en contacto directo con el aire. Esto sucede porque este tipo de combustión se lleva a cabo en dos reactores separados. Además, se usa un metal que funciona como acarreador de oxígeno, es decir, “transporta” el oxígeno del aire al combustible. Esto permite obtener dos corrientes como productos, una de aire exhausto y otra de dióxido de carbono con agua (ver figura 4).
Una alternativa para aprovechar y mitigar el CO2 generado en estos sistemas es enviar el efluente, ese líquido residual, a un sistema de cultivo de algas. Este último es eficiente y sustentable, pues sólo requiere carbón, nutrientes, temperatura ambiente y luz solar. El principal producto de estos sistemas de cultivo es la biomasa,2 que se puede procesar para producir biocombustibles, proteínas y otros productos de alto valor (Judd et al., 2015).
Se ha reportado un modelo matemático que evalúa las políticas de carbono en plantas de potencia usando combustión indirecta y sistemas de cultivo de algas (Munguía-López et al., 2018). En este modelo se propuso un enfoque de optimización que considera objetivos económicos y ambientales (maximizar la ganancia del sistema y minimizar las emisiones generadas). También se evaluaron diferentes tecnologías para cada paso del proceso, la selección del combustible óptimo y la cantidad de CO2 enviada al sistema de cultivo (ver figura 5). Para encontrar la solución del modelo multiobjetivo se usan distintas herramientas matemáticas implementadas en computadoras. A través de los resultados del modelo se presentaron soluciones para varias penalizaciones y compensaciones económicas. También se identificaron los beneficios de considerar los impuestos y bonos de carbono como una estrategia para reducir las emisiones y simultáneamente lograr un sistema rentable de generación de energía y producción de biocombustibles. El bono de 130 USD/tonelada permite obtener los mayores beneficios económicos y ambientales.
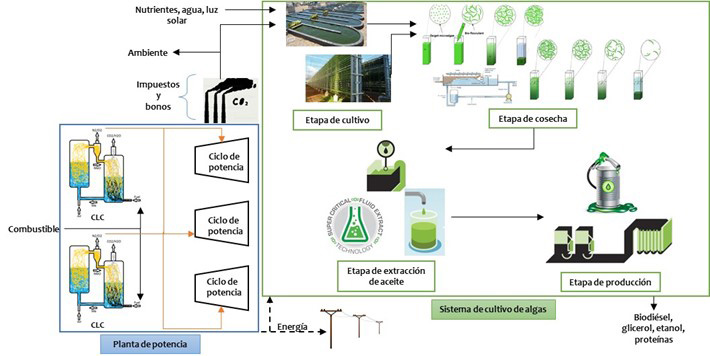
Figura 5. Representación esquemática del sistema propuesto que integra plantas de potencia usando combustión indirecta con sistemas de algas.
Otra alternativa para reducir emisiones en la generación de energía incluye el uso de biocombustibles y energía solar. Dichos combustibles están restringidos por su disponibilidad en temporada. Esta opción se ha estudiado en un sistema que involucra redes de reparto de agua y plantas de potencia de doble propósito, que pueden generar agua y energía simultáneamente. Se ha reportado un modelo de programación matemática para evaluar las políticas de carbono en este sistema (Munguía-López et al., 2019), el cual sólo tiene un objetivo: maximizar la ganancia del sistema. Sin embargo, a través de las multas y bonos, se espera un impacto positivo en las funciones ambientales y sociales incluidas en el problema.
En este sentido, se busca una reducción en las emisiones producidas y extracción de agua, al igual que un aumento en la generación de empleos en el sistema macroscópico propuesto. Éste incluye la generación de energía en plantas de doble propósito existentes y nuevas, con el fin de satisfacer las demandas de distintos usuarios (ver figura 6). Para encontrar la solución del modelo se usan diversas herramientas matemáticas, basadas en su descripción con distintas variables, parámetros y ecuaciones. Los resultados del modelo mostraron los beneficios de considerar los impuestos y bonos relacionados al carbono y al agua, ya que se identificaron compromisos importantes entre las funciones ambientales y sociales, maximizando el beneficio económico. Al usar los bonos al carbono, se encontró la mayor ganancia con beneficios similares al esquema de impuestos al carbono en la disminución de emisiones y el aumento de empleos generados. Usando el mayor bono de carbono (130 USD/tonelada) se encontró la mayor reducción de emisiones y un menor consumo de combustibles fósiles.
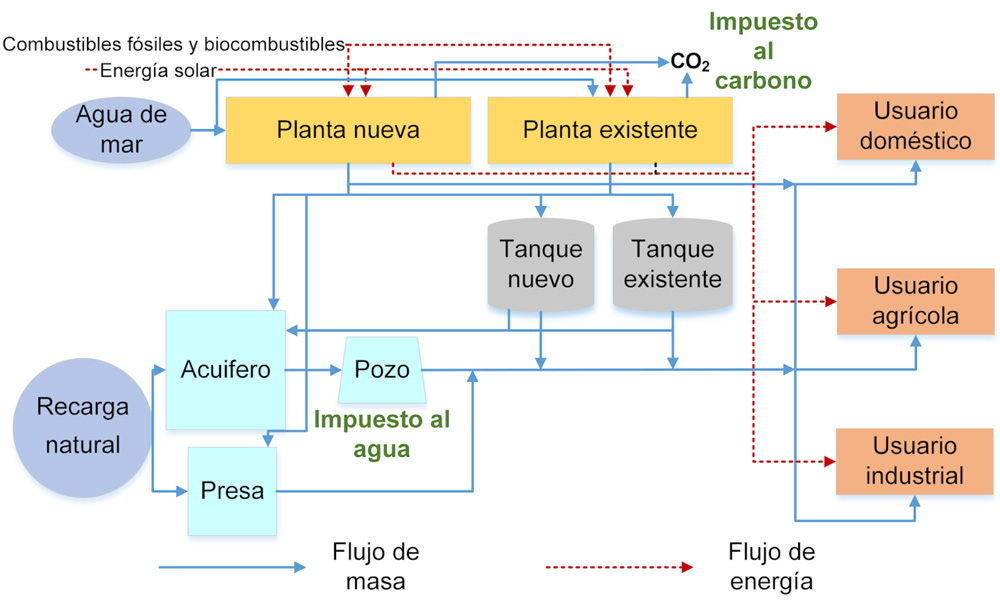
Figura 6. Representación esquemática del sistema de distribución de agua integrado con las plantas de potencia de doble propósito.
Conclusiones
De manera general, se puede concluir que, al evaluar las políticas de carbono usando modelos matemáticos, es posible obtener soluciones óptimas que permiten reducir emisiones en sistemas de generación de potencia. Además, los resultados obtenidos a partir de los modelos matemáticos facilitan la toma de decisiones para determinar el impuesto o bono de carbono que se debe aplicar a las emisiones.
Debido a problemas actuales como la gran cantidad de emisiones generadas, es importante considerar políticas que fomenten su disminución. El uso de las políticas de carbono representa una alternativa interesante para abordar los problemas actuales y para obtener diseños óptimos que incluyan beneficios ambientales y económicos.
Referencias
- Afzal, S., Sengupta, D., Sarkar, A., El-Halwagi, M., y Elbashir, N. (2018). Optimization approach to the reduction of CO2 emissions for syngas production involving dry reforming. acs Sustainable Chemistry y Engineering, 6(6), 7532-7544. https://doi.org/10.1021/acssuschemeng.8b00235.
- Avi-Yonah, R. S., y Uhlmann, D. M. (2009). Combating Global Climate Change: Why a Carbon Tax is a Better Response to Global Warming than Cap and Trade. Stan. Envtl. LJ, 28(1), 3-50. https://repository.law.umich.edu/articles/52.
- Baranzini, A., Goldemberg, J., y Speck, S. (2000). A future for carbon taxes. Ecological economics, 32(3), 395-412. https://doi.org/10.1016/S0921-8009(99)00122-6.
- Cristóbal, J., Guillén-Gosálbez, G., Jiménez, L., e Irabien, A. (2012). Optimization of global and local pollution control in electricity production from coal burning. Applied energy, 92, 369-378. https://doi.org/10.1016/j.apenergy.2011.11.028.
- Environmental Protection Agency (epa). (s. f.). Sources of Greenhouse Gas Emissions. Consultado el agregar fecha de consulta de https://www.epa.gov/ghgemissions/sources-greenhouse-gas-emissions#t1fn3.
- Fang, G., Tian, L., Fu, M., Sun, M., Du, R., y Liu, M. (2017). Investigating carbon tax pilot in yrd urban agglomerations—Analysis of a novel eser system with carbon tax constraints and its application. Applied energy, 194, 635-647. https://doi.org/10.1016/j.apenergy.2016.02.041.
- Feijoo, F., y Das, T. K. (2014). Design of pareto optimal CO2 cap-and-trade policies for deregulated electricity networks. Applied Energy, 119, 371-383. https://doi.org/10.1016/j.apenergy.2014.01.019.
- Fuentes-Cortés, L. F., Ma, Y., Ponce-Ortega, J. M., Ruiz-Mercado, G., y Zavala, V. M. (2018). Valuation of water and emissions in energy systems. Applied Energy, 210, 518-528. https://doi.org/10.1016/j.apenergy.2016.09.030.
- Judd, S., van den Broeke, L. J. P., Shurair, M., Kuti, Y., y Znad, H. (2015). Algal remediation of CO2 and nutrient discharges: A review. Water Research, 87, 356-366. https://doi.org/10.1016/j.watres.2015.08.021.
- Kaufman, N., Obeiter, M., y Krause, E. (2016). Putting a price on carbon: Reducing emissions [Issue Brief World Resources Institute]. https://www.wri.org/research/putting-price-carbon-reducing-emissions.
- Kossoy, A., Peszko, G., Oppermann, K., Prytz, N., Klein, N., Blok, K., Lam, L., Wong, L., y Borkent, B. (2015). State and Trends of Carbon Pricing 2015. World Bank. http://hdl.handle.net/10986/22630.
- Munguía-López, A. del C., Rico-Ramírez, V., y Ponce-Ortega, J. M. (2018). Analysis of Carbon Policies in the Optimal Integration of Power Plants Involving Chemical Looping Combustion with Algal Cultivation Systems. acs Sustainable Chemistry y Engineering, 6(4), 5248-5264. https://doi.org/10.1021/acssuschemeng.7b04903.
- Munguía-López, A. del C., González-Bravo, R., y Ponce-Ortega, J. M. (2019). Evaluation of carbon and water policies in the optimization of water distribution networks involving power-desalination plants. Applied Energy, 236, 927-936. https://doi.org/10.1016/j.apenergy.2018.12.053.
- nasa. (s. f.). Global Climate Change. Consultado en enero de 2021 de https://climate.nasa.gov/scientific-consensus/.
- National Oceanic and Atmospheric Administration (noaa). (s. f.). Trends in Atmospheric Carbon Dioxide. Consultado en enero de 2021 de https://climate.nasa.gov/vital-signs/carbon-dioxide/.
- Secretaría de Medio Ambiente y Recursos Naturales (Semarnat) e Instituto Nacional de Ecología y Cambio Climático (inecc). (2012). Quinta comunicación nacional ante la convención marco de las Naciones Unidas sobre el cambio climático. https://unfccc.int/documents/125276.
- Vatn, A. (2015). Markets in environmental governance. From theory to practice. Ecological Economics, 117, 225−233. https://doi.org/10.1016/j.ecolecon.2014.07.017.
Recepción: 29/07/2021. Aprobación: 07/01/2022.
Vol. 23, núm. 2 marzo-abril 2022
De ciudades, conservación y roedores: San Cristóbal de las Casas
Gloria Tapia-Ramírez, Consuelo Lorenzo, Óscar Retana y Arturo Carrillo-Reyes CitaResumen
La mitad de la población humana vive en alguna de las muchas ciudades del mundo. La tendencia apunta a que cada vez habrá más gente que habite en alguna ciudad ya existente, o en proceso de transformación. Se pronostica que para 2030, seis de cada diez mexicanos vivirán en una ciudad, lo que traerá diversas implicaciones en la fauna, los ecosistemas y la salud humana. Esta investigación describe el caso de San Cristóbal de Las Casas, en Chiapas, una ciudad mediana que ha pasado en poco tiempo de la ruralidad a la urbanización de manera acelerada. Nuestro objetivo fue evaluar la respuesta de la comunidad de roedores a la urbanización, desde la perspectiva de la ecología del paisaje. De manera paralela, buscamos entender el papel de los paisajes naturales y conservados que rodean el área urbana, en el mantenimiento de altas diversidades de roedores. Encontramos que, si bien los paisajes mejor conservados no son los más diversos, sí poseen especies que no se encuentran en paisajes intermedios o urbanos, aún cuando están sometidos a una alta presión antropogénica.
Palabras clave: ecología, paisajes, roedores, urbanización, zoonosis.
Of cities, conservation and rodents: San Cristóbal de las Casas
Abstract
Currently, more than half-worldwide population is living in a city. This present tendency is increasing. In this way, in a few years, even more people will inhabit in an exist or developing city. Predictions are that in 2030 six of ten Mexicans will live in a city, which will have consequences to the fauna, ecosystems, and human health. This research project is about a medium-sized city in Chiapas, named San Cristobal de las Casas, that has experienced an accelerated urbanization process in a short period. The overall goal was to evaluate the rodent’s response to the urbanization, from the landscape ecology approach. At the same time, we have investigated the role of natural and preserved landscapes in maintaining high diversities of rodent species. We found that preserved areas are not the most diverse areas; nevertheless, they maintain high abundance of rodent species that have not been found in other landscapes in San Cristobal de las Casas. In conclusion, these landscapes are under big anthropogenic pressure.
Keywords: ecology, landscapes, rodents, urbanization, zoonosis.
Las ciudades en el mundo y sus efectos sobre la biodiversidad
Actualmente, en el mundo hay más de 7.8 mil millones de personas. Más de la mitad vive en alguna de las 500 grandes ciudades del planeta (onu-Habitat, 2021). Se espera que para 2035, 62.5% de la población viva en alguna ciudad. En México, se pronostica que para el 2030, seis de cada diez mexicanos vivirán en una ciudad (Almejo et al., 2014).
Las ciudades representan un sueño de bonanza y estabilidad de las poblaciones rurales, pues ofrecen infraestructura inmobiliaria, servicios públicos como transporte, hospitales, comercio y acceso a la cultura, beneficios que muchas veces no tienen las localidades rurales. Sin embargo, el establecimiento de estas urbes trae consigo la modificación, en algunos casos irreversible, de bosques, selvas, u otro ecosistema donde se asienten. A veces, esta modificación conduce a la extirpación de flora y fauna nativas (McKinney, 2006) o favorece la presencia e incremento de poblaciones de especies de fauna silvestre no nativas, es decir, no originarias del sitio en cuestión, que se adaptan fácilmente a las condiciones urbanas.
Con condiciones urbanas nos referimos a la forma en la que las ciudades están organizadas o configuradas espacialmente. Una configuración ideal es aquella que cuenta con diferentes secciones destinadas a la vivienda, a la industria, a las áreas verdes y a la conservación, y donde éstas no se mezclan. Sin embargo, una configuración ideal depende de las regulaciones existentes, que deberían ordenar el crecimiento de las ciudades, y garantizar el bienestar humano y la permanencia de los ecosistemas naturales que las rodean.
¿Por qué es necesario preservar los ecosistemas que rodean a las ciudades?
Los ecosistemas conservados, dígase bosques o selvas, por mencionar algunos, no sólo preservan a las plantas que los constituyen, sino también a los animales que viven ahí. Estos ecosistemas conservados prestan servicios a la población humana cercana, como lo son la provisión de agua, la polinización y la oportunidad de tener espacios bellos para la contemplación.
Algunos investigadores han establecido que los ecosistemas en buen estado podrían ayudar a preservar la salud humana, pues contribuyen a que los patógenos zoonóticos (microorganismos como bacterias, virus u hongos que podrían ocasionar enfermedades en seres humanos, sí pasaran de animales al hombre) se queden circulando entre los animales silvestres y no entren en contacto con las poblaciones humanas. De esta manera, se podría evitar un futuro brote epidemiológico debido a una enfermedad infecciosa, como la covid-19, ocasionada por el sars-CoV2, que ahora aqueja a la humanidad.
¿Y qué pasa si no conservamos? En este caso, las ciudades van extendiéndose (proceso de urbanización) hasta abarcar grandes áreas donde sólo hay cemento y casas. Los animales responderán a esta ausencia de vegetación, desapareciendo o aprovechando las nuevas ventajas que aporta la presencia humana. En este sentido, uno de los grupos de animales donde se ha estudiado la respuesta a la urbanización es en los roedores. Se sabe que algunas especies responden desapareciendo de los ecosistemas, y otras, llegando a nuestras ciudades e instalándose en ellas para siempre.
¿Qué buscamos en este proyecto?
El objetivo general de este estudio fue evaluar la respuesta de la comunidad de roedores a la urbanización en San Cristóbal de las Casas (sclc), desde la perspectiva de la ecología del paisaje, disciplina de la ecología que estudia las interacciones de los seres vivos con el espacio (el paisaje) que habitan y los procesos ecológicos que los definen. Elegimos sclc porque es un buen ejemplo de cómo una ciudad crece sobre los ecosistemas que la rodean. Además, en el momento actual, tiene un tamaño tal que facilita los desplazamientos de un extremo a otro sin mayores contratiempos o tráfico vehicular, ideal para realizar los muestreos de este proyecto en unas cuantas horas.
Con la perspectiva de la ecología del paisaje, buscamos entender el papel de los paisajes naturales y conservados que rodean a sclc, en el mantenimiento de la diversidad de roedores. Primero, se analizó cómo la configuración espacial de la ciudad moldea la comunidad de roedores. Para ello, se caracterizaron los distintos tipos de cobertura vegetal de la ciudad y sus alrededores. Finalmente, se registraron las especies de roedores presentes por tipo de paisaje.
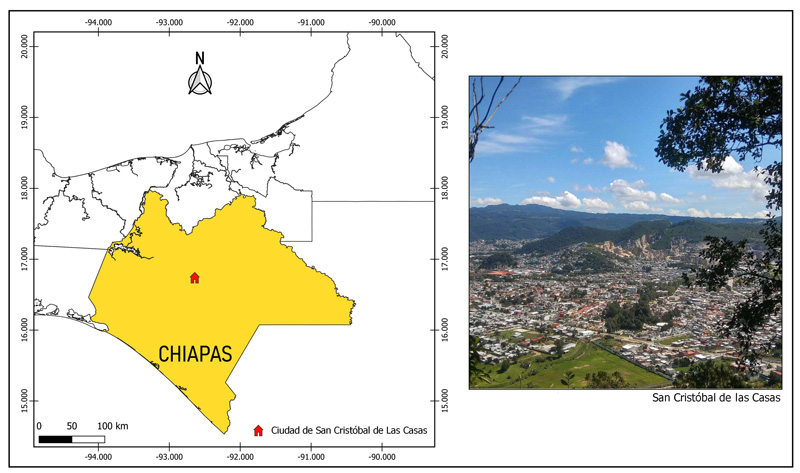
Figura 1. Ubicación del área de estudio en el estado de Chiapas, y vista panorámica de la ciudad.
Créditos: G. Tapia-Ramírez.
La ciudad de San Cristóbal de las Casas
sclc se ubica en el centro norte de Chiapas (ver figura 1), en la región conocida como Los Altos de Chiapas. A pesar de que muchos consideran a sclc un pueblo y, de hecho, ha sido designado pueblo mágico por la Secretaría de Turismo de México, es una ciudad de más de 200,000 habitantes; según el inegi (2021), una ciudad mediana. Se fundó en 1528 (Markman, 1963), por lo que es casi tan antigua como la Ciudad de México (fundada en 1521). sclc se ubica en un área con importantes ecosistemas, como humedales de montaña, bosques de coníferas y bosques mesófilos de montaña (ver figura 2). El asentamiento original era sólo de 18 cuadras y 12 calles; no obstante, lentamente, la ciudad se extendió sobre los ecosistemas que bordeaban a la traza original, y pasó de 30,000 habitantes en la década de 1970 a 190,000 en 2010, hasta alcanzar en 2021 la cifra de 202,459 (inegi, 2010).

Figura 2. Tipos de ecosistemas y asentamientos humanos en San Cristóbal de las Casas.
Créditos: G. Tapia-Ramírez.
De acuerdo con Camacho-Valdez et al., (2019), entre 2001 y 2018, el área urbana en San Cristóbal se incrementó en 12.5% y uno de los ecosistemas que más ha disminuido su área es el humedal de montaña, con una reducción de 7.4% en el mismo período. Otro aspecto por considerar es que las áreas naturales han reducido su tamaño y, actualmente, los fragmentos que persisten están embebidos en la ciudad, y sólo algunos están destinados a la conservación.
¿Qué y cómo lo hicimos?
El estudio se realizó en un área de 15,143 hectáreas, con un radio de 6 km, a la que denominamos área de estudio. Ésta incluye a la ciudad de sclc y áreas conurbadas. El trabajo se dividió en dos fases: gabinete y campo (ver figuras 3a y b). En la primera, llevamos a cabo un análisis de percepción remota, con imágenes del satélite Sentinel 2. Éste permite obtener una vista panorámica del sitio de interés, en el que se identifican los elementos que configuran el paisaje. Con las imágenes de satélite se caracterizó al área de estudio en cuatro tipos de coberturas: urbanas, agrícolas, humedales y bosques (ver figura 3a).
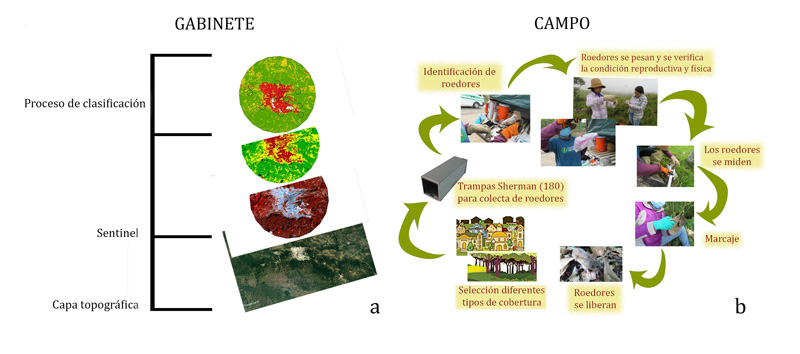
Figura 3. Métodos llevados a cabo en este estudio. a) Clasificación de los tipos de vegetación en San Cristóbal de las Casas. b) Muestreo de roedores.
Créditos: G. Tapia-Ramírez.
En la fase de campo, muestreamos roedores sobre gradientes de urbanización de 6 km (líneas establecidas de lo más urbanizado a 0 km, a lo menos urbanizado, 6 km), donde ubicamos sitios de muestreo, con radios de 500 m. Cuando se trabaja con ratones en campo, es importante poder identificarlos, y así conocer a qué especie pertenecen (en México hay unas 244). Por este motivo, pusimos trampas de las llamadas Sherman (ver figura 3b), que atrapan a los ratones sin causarles daño. Cada ratón así capturado fue identificado, pesado y medido. Posteriormente los ratones fueron liberados en el mismo sitio de su captura. Los sitios donde registramos roedores se categorizaron por el tipo de paisaje (ver figura 4), por el tipo de cobertura y por su configuración espacial.
Hallazgos
La ciudad de sclc está en proceso de urbanización, por lo que la configuración actual del paisaje es un mosaico de parcelas agrícolas, áreas boscosas y humedales de montaña, embebidas en el área urbana, y donde aún existen relictos (o porciones pequeñas de cierto tipo de vegetación) de bosque en las zonas más alejadas del centro de nuestra área de estudio (6 km). Encontramos que hay cuatro tipos de paisajes que incorporan las coberturas arriba mencionadas: urbanos, de tipo mosaico, en transición y conservados (ver figura 4). Estos tipos de paisaje están esparcidos en el área de estudio: los de mayor cobertura urbana se concentran en los primeros 1.5 km, y aquellos con mayor cobertura boscosa están hacia los 6 km (ver figura 4).
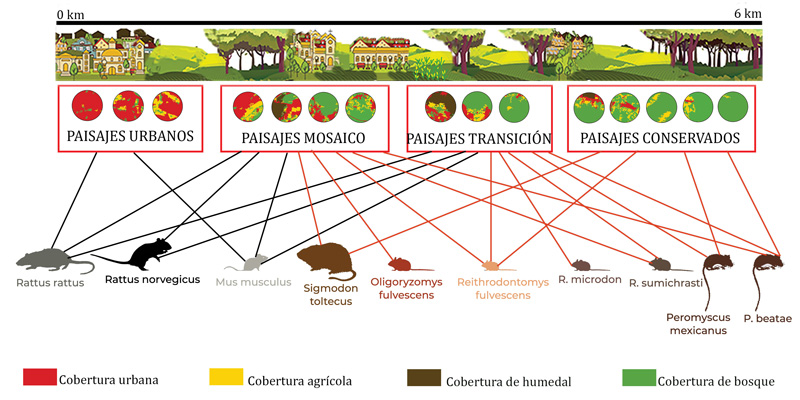
Figura 4. Esquema de los tipos de paisajes presentes en el área de estudio en San Cristóbal de las Casas, y de las especies de roedores que habitan cada una de ellas.
Se encontró que la comunidad de roedores está compuesta por 10 especies correspondientes a las familias: Cricetidae y Muridae; con siete y tres especies, respectivamente. Encontramos que hay especies estrechamente ligadas a los paisajes urbanos, aquellos con casas, avenidas y, en general, estructuras con cemento. Estas especies son Rattus rattus y Mus musculus, pertenecientes a la familia Muridae, especies no nativas y consideradas nocivas. Éstas son especies que esperábamos encontrar, pues son comunes de ver en todos los contextos urbanos del mundo. Cabe resaltar, que éstas, acompañadas de Rattus norvegicus, también fueron encontradas en paisajes donde confluyen casas habitación, parcelas agrícolas, humedales y bosques (ver figura 4, líneas negras). Estas especies no nativas se encuentran en todos los tipos de paisajes, excepto en los conservados, aunque son más abundantes en los urbanos (ver figura 4).
Otro dato interesante es que las especies de la familia Cricetidae (nativas de este continente) no se encuentran en los paisajes urbanos (ver figura 4, líneas cafés). Éstas son especies con requerimientos particulares para establecerse, razón por la cual no aparecen en todo el gradiente. Por ejemplo, Sigmodon toltecus (ver figura 5) requiere de pastos, por lo que se encontró en paisajes donde ese tipo de cobertura abunda (mosaico y conservados). Finalmente, como se esperaba, los paisajes conservados sólo presentan especies nativas. Y si bien, las especies de Peromyscus también fueron reportadas en otros tipos de paisaje, es en estos últimos paisajes donde son más abundantes.
¿Esto qué significa?
Los resultados de este estudio muestran que, contrario a lo que se esperaba, los paisajes conservados en sclc no son los más diversos. Poseen la mitad de especies (n=4) que los paisajes que se ubican en la porción media del gradiente (de mosaico y de transición; 8 especies cada uno; ver figura 4). Estas diferencias en el número de especies se explican por la heterogeneidad ambiental, es decir, los paisajes intermedios de este gradiente poseen más de un tipo de cobertura (en promedio tienen dos), pero hay unidades de paisaje hasta con cuatro. Esta heterogeneidad ambiental propicia un mayor número de hábitats disponibles, lo que favorece un mayor número de especies.
Es importante destacar que si bien es relevante conocer el número de especies que posee un paisaje, también es necesario considerar la identidad de cada una. Por ejemplo, los paisajes conservados tienen cuatro especies, pero todas son nativas y poseen la mayor abundancia de especies de Peromyscus mexicanus (ver figura 5) y P. beatae. En cambio, los paisajes intermedios tienen a las tres especies de roedores considerados nocivos y, además, en mayor abundancia que las especies nativas.

Figura 5. Especies de roedores que habitan los distintos paisajes en San Cristóbal de las Casas.
Entonces… ¿Seguimos haciendo ciudades?
Nuestros resultados ponen de manifiesto que una ciudad mediana, como lo es sclc, aún puede sostener a un número importante de roedores. Sin embargo, también apuntan a que el crecimiento acelerado y no regulado, pone en riesgo la existencia de paisajes que conserven ecosistemas que sostengan a un mayor número de especies de roedores. Con los resultados de este estudio se pudo identificar la importancia de las áreas de conservación en la preservación de especies de roedores nativos, poco abundantes e incluso no presentes en paisajes con coberturas urbanas. Los autores estamos conscientes de la imposibilidad de detener el crecimiento de las ciudades, pero sí consideramos necesario preservar los paisajes que sostienen ecosistemas que contribuyen al bienestar humano en más de un sentido.
¿Qué sigue?
Basados en nuestros resultados, los autores proponemos:
- Establecer muestreos a largo plazo que permitan verificar la salud de los ecosistemas y sus cambios a través del tiempo en San Cristóbal de las Casas.
- Analizar el estado de conservación de los ecosistemas desde la perspectiva de otras especies de mamíferos, menos carismáticos, pero no por eso, menos importantes.
- Establecer vigilancia epidemiológica con la población humana que está en contacto más estrecho con las poblaciones de roedores no nativos en la ciudad de San Cristóbal de las Casas y área conurbada.
- Involucrar a la población en acciones de concientización de la importancia de preservar espacios naturales.
Referencias
- Almejo Hernández, R., García Galeana, J., y Benítez Villegas, I. (2014). La urbanización en México 2010-2030: un esbozo de los retos y oportunidades asociados al crecimiento urbano y regional oportunidad. La situación demográfica de México 2014 (pp. 139-163). Consejo Nacional de Población. https://cutt.ly/EAEKjhd.
- Camacho-Valdez, V., Tello-Alcaide, E. M., Wootton, A., y Valencia-Barrera, E. (2019). Land Use Change and Urban Ecosystem Services: a case study of urban wetlands in a rapidly sprawling city in the Highlands of Chiapas, Mexico. Journal of Management and Sustainability, 9(1), 67-81. https://doi.org/10.5539/jms.v9n1p67.
- inegi. (2015). Conteo Intercensal de Población y Vivienda, Instituto Nacional de Estadística y Geografía, Aguascalientes.
- inegi. (2021). Chiapas. Número de habitantes. Información de México para niños. http://www.cuentame.inegi.org.mx/monografias/informacion/chis/poblacion/.
- Markman, D. S. (1963). San Cristóbal de Las Casas. Escuela de Estudios Hispano Americanos.
- McKinney, M. L. (2006). Urbanization as a major cause of biotic homogenization. Biological Conservation, 127(3), 247-260. https://doi.org/10.1016/j.biocon.2005.09.005.
- onu-Habitat. (2021). Tendencias del desarrollo urbano en México. Programa de Las Naciones Unidas Para Los Asentamientos Humanos. https://onuhabitat.org.mx/index.php/tendencias-del-desarrollo-urbano-en-mexico.
Recepción: 09/12/2021. Aprobación: 23/02/2022.
Vol. 23, núm. 2 marzo-abril 2022
Bosques vemos, diversidad de frutos no sabemos: fotografías que delatan
José Miguel Romero-Saritama CitaResumen
Con el avance de la ciencia y la tecnología, la fotografía digital es una herramienta indispensable en las labores de campo y laboratorio en las ciencias naturales. La fotografía nos permite documentar, evidenciar y validar información. Asimismo, ayuda a acercarnos visualmente a realidades y a estructuras vegetales escondidas en los bosques tropicales. Por esta razón, en este trabajo mostramos a la fotografía como un instrumento práctico para explorar de forma rápida la diversidad morfológica de frutos de especies leñosas en un bosque montano del sur del Ecuador, ecosistema altamente biodiverso y poco conocido a nivel mundial. A través de registros fotográficos, se identificó, midió y catalogó la variedad de formas, colores y tamaños de los frutos en el bosque. Estos resultados nos permiten valorar, desde un enfoque más ilustrativo, la diversidad de estructuras vegetales presente en los ecosistemas montanos.
Palabras clave: bosques tropicales, diversidad de frutos, fotografía digital, frutos forestales, rasgos morfológicos.
Forests we see, diversity of fruits we do not know: photographs that reveal
Abstract
With the advancement of science and technology, digital photography is an indispensable tool in field and laboratory work in Natural Sciences. Photography allows us to document, evidence, and validate information. Likewise, it helps us approach realities and plant structures, hidden in tropical forests, in a visual manner. For this reason, in this work, we show photography as a practical instrument to quickly explore the morphological diversity of fruits of woody species in a montane forest in southern Ecuador, a highly biodiverse ecosystem, little known worldwide. Using photography, it was possible to identify, measure and catalog the variety of shapes, colors, and sizes of the fruits in the forest. These results allow us to assess with a more illustrative approach the diversity of plant structures present in montane ecosystems.
Keywords: tropical forest, fruits diversity, digital photography, forest fruits, morphological traits.
Introducción
Desde su invención, en 1839, la fotografía ha ido adquiriendo una importancia cada vez mayor en todos los ámbitos de la sociedad y de la ciencia (Grilli et al., 2014). Actualmente, la fotografía digital, por su alta disponibilidad y accesibilidad mediante un celular inteligente o una cámara fotográfica, se ha convertido en un recurso utilizado prácticamente a diario en todos los campos del saber.
Gracias a las imágenes fotográficas, hoy en día sabemos de realidades que muchas veces son desconocidas, han pasado inadvertidas o, lamentablemente, ya no existen en el mundo natural. A medida que se perfeccionan los procedimientos fotoquímicos para captar y fijar imágenes, la fotografía se convierte en una herramienta insustituible de la investigación y la divulgación científica (Galvez, 2017).
En las ciencias biológicas, los que hemos realizado trabajo de campo, recolectado y analizado muestras botánicas, podemos dar fe de la importancia de contar con una cámara fotográfica, ya que ésta nos permite desde documentar el trabajo realizado y registrar en una imagen diversas estructuras vegetales (que posteriormente sirven para generar nueva información), hasta congelar en un momento la belleza escénica que nos presenta la madre naturaleza. No obstante, para aquellas personas con intereses distintos al quehacer científico, una cámara fotográfica puede significar el medio para captar sólo lo que sus ojos les permiten ver, dejando de lado la diversidad de componentes vegetales que encontramos en los bosques. Esto último es comprensible porque muchas de las estructuras vegetales están alejadas de la vista humana o no representan gran interés fotográfico debido al desconocimiento sobre su diversidad e importancia ecológica.
Ante lo mencionado, el objetivo del presente trabajo es denotar la importancia de la fotografía como una herramienta para captar estructuras vegetales que pasan desapercibidas para la vista humana, como son los frutos de especies leñosas dentro de un bosque húmedo tropical. Asimismo, la idea es mostrar cómo las imágenes captadas por una cámara fotográfica nos permiten conocer y medir aspectos morfológicos de los frutos, al tomar como referencia aquellas especies que encontramos en un bosque montano en el sur del Ecuador. Por lo tanto, para empezar este recorrido de información sobre la fotografía y los frutos, primeramente, es menester hacer referencia a lo que son los bosques.
Los bosques, más que lindas plantas
Cuando pensamos en un bosque, o si nos preguntan ¿qué es un bosque?, inmediatamente se nos vienen a la mente muchos árboles de distintas formas y tamaño, de color verde, colocados en una montaña (ver figura 1a), o al menos eso nos hacían pensar en la escuela, aunque ese pequeño concepto no está tan alejado de la realidad. En un sentido más técnico, podemos mencionar que un bosque es todo un ecosistema natural; es decir, un lugar donde predominan árboles y arbustos, que conviven en toda una red de interacciones entre plantas, animales y muchos otros organismos (ver figura 1b). Por lo tanto, un bosque es, en realidad, mucho más de los que nuestros ojos ven.
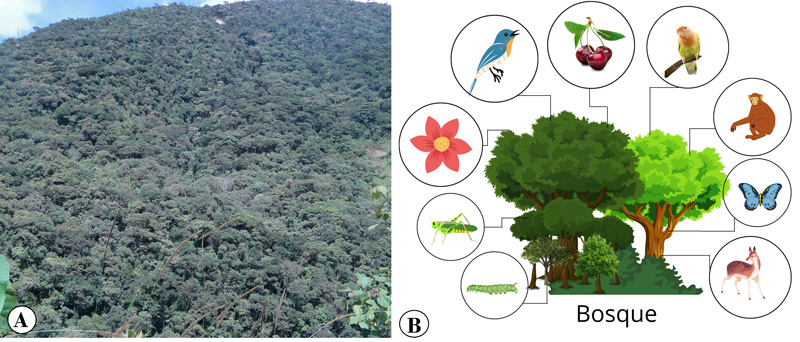
Figura 1. Vista de lo que vemos de bosque versus lo que existe en realidad. A) Fotografía de un bosque natural. B) Representación de la diversidad de organismos y componentes en un bosque.
A nivel mundial podemos encontrar diferentes tipos de bosque, que se clasifican según su ubicación en nuestro planeta y en función de las condiciones ambientales que predominan en ellos. En forma muy general, podemos encontrar los bosques tropicales y bosques subtropicales, muy familiares para quienes habitamos en Sudamérica y Centroamérica, y los bosques templados y el bosque boreal en el norte del planeta. Si bien los bosques del mundo poseen sus propias características que los diferencian entre sí, comparten un común denominador muy desafortunado y terrorífico: todos están bajo amenaza, pues pierden un área aproximada a 27 campos de futbol por minuto, sobre todo en la zona tropical (wwf, 2019).
Acabar con nuestros bosques no sólo supone atentar contra la vida de los animales y plantas, como muchas de las veces nos hacen pensar, sino también poner en riesgo nuestra propia existencia. Los bosques, como ya se comentó, son una red de interacciones de las cuales dependen miles de organismos que habitan dentro o fuera de él. Además, nos ayudan a regular el clima mundial, son un cúmulo de servicios ambientales y una fascinante farmacia natural.
Pero volviendo a nuestro tema principal, la gala de diversidad de especies que presentan nuestros bosques también está expresada en la variedad morfológica de cada uno de los componentes que constituyen a las plantas. Entre dichos componentes están sus frutos.
Frutos de especies forestales
Si pensamos en los árboles y arbustos que dominan los bosques, es fácil imaginar cómo están compuestos. Basta recordar las enseñanzas de los profesores de ciencias naturales en la escuela: —La raíz, tallo, hojas, flores y frutos son las partes de las plantas —nos decían. Pero, en realidad, ¿qué tan fácil es observar todas esas estructuras en un bosque? En especial cuando los árboles pueden llegar a medir entre 20 y 30 metros de altura y se interconectan entre ellos. Si recorremos un bosque nos daremos cuenta de lo fácil que es para nosotros observar los tallos, hojas e incluso las flores, pero es difícil percatarse claramente de los frutos, debido al frondoso follaje de los árboles; sin embargo, para las aves o mamíferos frugívoros, los frutos en su fase madura sin duda alguna no pasan desapercibidos.
Desde un punto de vista botánico, los frutos son órganos de las plantas que se desarrollan posterior a la fecundación de las flores, donde, luego de varios procesos metabólicos, las paredes del ovario se transforman en el fruto. Estas estructuras cumplen un rol fundamental en los ecosistemas: son alimento para animales, contienen y protegen a las semillas, y en muchos de los casos son el vehículo que facilitan la dispersión de las semillas en el tiempo y el espacio. No obstante, para el ser humano generalmente, los frutos en el bosque permanecen en el anonimato.
La fotografía y su importancia en las ciencias forestales
La fotografía es una herramienta multidisciplinaria que nos ha permitido conocer detalles de estructuras o fenómenos que antes desconocíamos, y que, además, puede transformar en verdaderas obras de arte estructuras atómicas o galaxias (inecol, 2021). Es así como las imágenes captadas por una cámara se convierten en un documento autentificador de primera magnitud, dotado de un alto valor testimonial (Pantoja Chaves et al., 2016), y con funciones tales como respaldar, obtener y apoyar información existente, para presentar resultados en una investigación (De las Heras, 2015; Grilli et al., 2015).
En el campo de las Ciencias Forestales, estoy seguro de que aquel que haya visitado un bosque siempre tendrá un recuerdo de una planta o parte de ella, grabado en una imagen captada por una cámara fotográfica o de celular. Para los que estamos involucrados en el quehacer científico o de divulgación, la fotografía es una herramienta indispensable que nos permite observar el entorno más allá del alcance de nuestros ojos. Asimismo, sobre las imágenes captadas podemos medir diferentes elementos como el crecimiento de hojas, tamaños y formas de semillas, cálculos de áreas, análisis de cobertura vegetal, entre otras estructuras (Rincón et al., 2012; Romero-Saritama y Draper, 2017). Es por ello que las imágenes fotográficas han acompañado a muchos escritos científicos de botánica en general (Grilli et al., 2014), y han contribuido a la divulgación de la ciencia en diferentes documentos técnicos (inecol, 2021).
Por otro lado, la fotografía puede convertirse es un recurso didáctico funcional para la enseñanza de las ciencias botánicas, ya que los estudiantes, mediante fotografías tomadas por ellos mismos o por los docentes, pueden explorar, describir y medir todos los elementos captados en la imagen. Así lo demuestran Cabrera, Armijos y Romero-Saritama (2019), quienes dentro de una asignatura utilizaron imágenes fotográficas de frutos de dos especies de un páramo ecuatoriano para identificar y medir diferentes rasgos morfológicos.
¿Cómo la fotografía puede ayudar a conocer la diversidad de frutos?
Para muestra basta un botón, dice un refrán muy popular. En tal sentido, en esta sección, para ejemplificar a la fotografía como una herramienta para conocer la diversidad de frutos de especies leñosas, tomaremos como ejemplo el trabajo realizado por Valarezo y Romero-Saritama (2021). Éste inició como una tesis de pregrado y posteriormente se convirtió en un libro publicado en físico por la Universidad Técnica Particular de Loja (utpl).
El trabajo mencionado se ofertó dentro de la carrera en Gestión Ambiental de la utpl con el tema Guía fotográfica de frutos y semillas de especies leñosas de un bosque montano al sur del Ecuador. Parte de la materia consistió en tomar fotografías de esas dos estructuras (frutos y semillas) de diferentes especies de árboles y arbustos, distribuidos en un bosque montano o también denominado bosque nublado, que forman parte de la zona tropical, presentan altos grados de humedad y pasan el mayor tiempo escondidos bajo la neblina, de allí su nombre. A los bosques montanos también los podemos encontrar en Venezuela, Colombia, Perú y Bolivia, a 1500 metros sobre el nivel del mar (Bruijnzeel et al., 2011).
El objetivo del trabajo fue identificar la variedad de frutos y semillas presentes en el bosque, que hasta ese momento no se había identificado mediante registros fotográficos. El desarrollo fue como sigue: se programaron salidas de campo en función de la fructificación de las especies. Luego, usando una cámara Nikon D5200 se tomaron diferentes fotografías de los frutos. Una muestra de las imágenes se presenta en la figura 2, donde ya se puede apreciar la diversidad de los frutos en el bosque mediante registros fotográficos. Aquí es importante mencionar que en los bosques montanos existe un reto de investigación, desde el punto de vista de la observación y recolección de muestras botánicas, debido a la altura de las plantas, y a la estructura y composición del bosque. Ante esta situación, la fotografía se convierte en una herramienta para acercarnos visualmente a las estructuras vegetales sin necesidad de colectarlas.

Figura 2. Diversidad de frutos en un bosque montano del sur del Ecuador, captados mediante fotografías. A) Vismia tormentosa. B) Miconia sp. C) Ocotea oblonga. D) Miconia quadripora. E) Cedrela montana. F) Heliocarpus americanus. G) Orepanax microflorous. H) Solanum sp. I) Palicourea calycina. J) Lycianthes sp. K) Spirotheca rosea. L) Clethra fagifolia. M) Tournefortia hirsutissima. N) Palicourea stenosepala. O) Varios tipos frutos del bosque montano. Créditos: Valarezo y Romero-Saritama (2020).
Posteriormente, con las imágenes captadas se generó una base digital (fototeca) y se seleccionaron las mejores fotografías de cada especie, que fueron utilizadas para identificar el color, forma y tipo de fruto, y se usaron para medir el largo, ancho y grosor. La secuencia del proceso realizado se muestra en la figura 3. La herramienta para medir los frutos en las imágenes fue el programa de acceso libre ImageJ, muy utilizado en diferentes estudios morfológicos vegetales.
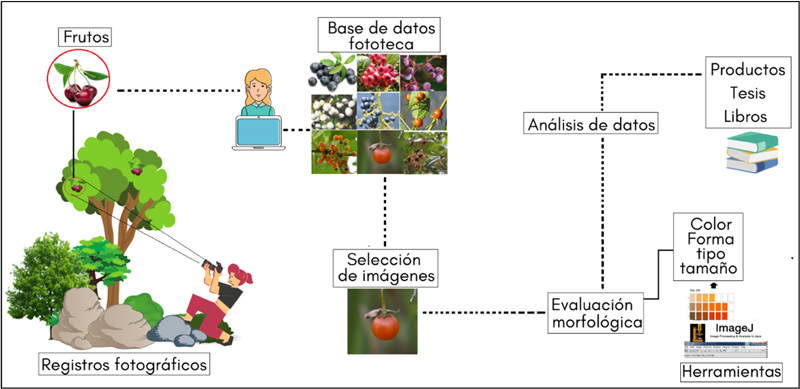
Figura 3. Representación del proceso metodológico para identificar la diversidad de frutos mediante la fotografía digital.
Con las imágenes de los frutos y mediciones realizadas, se logró evidenciar la diversidad de frutos del bosque en estudio. Este trabajo conllevó a la escritura del libro titulado Frutos y semillas de bosque montano del Sur del Ecuador, donde se refleja por primera vez la diversidad de los frutos del bosque montano, mediante registros fotográficos.
A manera de conclusión
En ecosistemas tropicales, donde puede resultar un reto la recolección directa de frutos para fines de investigación, la fotografía digital nos permite hacer una aproximación rápida de la diversidad de esas estructuras vegetales, sin tener la necesidad de bajarlas de las plantas, una actividad que puede conllevar mucho tiempo. Además, la fotografía nos ayuda a mantener fijos los elementos que caracterizan a los frutos, lo que permite medirlos y evaluarlos en cualquier momento y lugar, sin temor a que se pierdan por daño en su morfología, lo que sí podría ocurrir cuando se trabaja sobre frutos recolectados. Finalmente, la fotografía es una herramienta práctica que se puede utilizar como estrategia para divulgar información científica desconocida de nuestros bosques tropicales.
Referencias
- Bruijnzeel, L., Scatena, F., y Hamilton, L. (2011). Tropical montane coud forests: Science for conservation and management. Cornell University.
- Cabrera, A. P., Armijos, N., y Romero-Saritama, J. M. (2019). Rasgos Morfológicos de frutos y su incidencia en la conservación ex situ de dos especies de páramo en el Sur del Ecuador. Investiga utpl, 393-397.
- De las Heras, B. (2015). Testimoniando con imágenes. La fotografía en el estudio de la historia. Fotocinema. Revista científica de cine y fotografía, 10, 27-55. https://doi.org/10.24310/Fotocinema.2015.v0i10.5978.
- Gálvez Díaz, V. (2017). La fotografía científica. Historia y vínculo con la divulgación. Revista Digital Universitaria, 18(5), 1-17. http://www.revista.unam.mx/vol.18/num5/art36/index.html.
- Grilli, J., Laxague, M., y Barboza, L. (2014). Dibujo, fotografía y Biología. Construir ciencia con y a partir de la imagen. Revista Eureka sobre Enseñanza y Divulgación de las Ciencias, 12(1), 91-108. https://revistas.uca.es/index.php/eureka/article/view/2904.
- inecol. (2021, 2 de diciembre). La fotografía científica: el arte de la comunicación. https://cutt.ly/ZAYmePZ.
- Pantoja Chaves, A., Soto Vázquez, J., y Galea, E. (2016). La fotografía escolar como fuente para la investigación educativa. La Fototeca Digital Escolar de Extremadura. Educació i Història: Revista d’història de l’educació, 28, 229–254. https://dialnet.unirioja.es/servlet/articulo?codigo=5644535.
- Rincón Guerrero, N., Olarte Quintero, M. A., y Pérez Naranjo, J. C. (2012). Determinación del área foliar en fotografías tomadas con una cámara web, un teléfono celular o una cámara semiprofesional. Revista Facultad Nacional de Agronomía-Medellín, 65(1), 6399-64050. https://doi.org/10.15446/rfnam.
- Romero-Saritama, J .M., y Draper, D. (2017). Almacenamiento y morfología de semillas; especies distribuidas en el Sur del Ecuador. Ediloja Cía. Ltda. Universidad Técnica Particular de Loja.
- Valarezo, T., y Romero-Saritama, J. M. (2020). Frutos y semillas de bosque montano Sur del Ecuador. Ediloja Cía. Ltda. Universidad Técnica Particular de Loja.
- World Wildlife Fund (wwf). (2019, 1 de diciembre). Cuatro tipos de bosques: conoce las diferencias. https://cutt.ly/FAYmLMC.
Recepción: 14/12/2021. Aprobación: 23/02/2022.
Vol. 23, núm. 2 marzo-abril 2022
Y así, ad infinitum… Las especies parásitas de los parásitos
Rogelio Aguilar-Aguilar, Ricardo Balam-Narváez y Raúl Contreras-Medina CitaResumen
Los parásitos son parte importante de la biodiversidad. El término parásito refiere a múltiples organismos con diferentes orígenes filogenéticos. En este escrito se aborda el concepto de parásito desde un punto de vista biológico, y se comentan aquellas especies conocidas como hiperparásitos por ser parásitas de parásitos, haciendo énfasis en los ejemplos de plantas hiperparásitas en México, que forman un grupo muy interesante de parásitos poco conocidos que actualmente son abordados como parte de las líneas de investigación vigentes de los autores.
Palabras clave: biodiversidad, epiparasitismo, hiperparasitismo, parásitos.
And so on, ad infinitum… Parasites of parasites
Abstract
Parasites constitute an important part of biodiversity. The parasite term refers to a wide group of organisms with different phylogenetic origins. This contribution defines the concept of parasite from a biological perspective, emphasizing in those living as parasites of parasites, which are called hyperparasites. Additionally, we expose some examples of hyperparasitic plants inhabiting Mexico, which constitutes an interesting but few known sorts of parasites, currently studied by the authors.
Keywords: biodiversity, epiparasites, hyperparasitism, parasites.
En las dos primeras partes de la obra Los viajes de Gulliver, escrita hace más de tres siglos, el autor irlandés Jonathan Swift sitúa al cirujano y capitán Lemuel Gulliver en las enigmáticas tierras de Liliput y Brobdingnag, la primera habitada por seres humanos con un tamaño unas doce veces menor al del protagonista, mientras que la segunda está ocupada por personas gigantescas, esta vez unas doce veces mayor al inquieto capitán. Esta aparente pasión por las proporciones y las dimensiones llevó a Swift a escribir, en forma de versos incluidos en su poema satírico “Sobre la poesía: una rapsodia” (1733), uno de sus proverbios más conocidos: “Los naturalistas han observado que una pulga lleva sobre su cuerpo otras pulgas más pequeñas, que a su vez alimentan a otras pulgas más diminutas, y así, ad infinitum”.
Unos años después, el matemático Augustus De Morgan incluyó líneas similares en su poema “Siphonaptera”1 (1872), con la idea de que la materia pudiera estar sucesivamente formada de partículas de dimensiones menores y, en sentido inverso, que cierta unidad de materia forme parte de unidades de mayores proporciones, y así “hasta el infinito”.
Algún tiempo después, el parasitólogo español Carlos Rodríguez López-Neyra (1885-1958) reinterpretó con ingenio estos versos desde una perspectiva biológica, suponiendo que la pulga más pequeña resultaría igual de molesta para la de mayor tamaño que ésta para el perro que la aloja. De esta forma, reconoció un modelo de asociación interespecífica denominada hiperparasitismo, que se produce cuando el hospedador de un parásito es otro parásito (Gállego, 2003; Lucius et al., 2017). Claro está que dicha interpretación no es tan simple, pues bien pudiera suceder que en realidad las pulgas más pequeñas fueran crías trasportadas por sus progenitores, lo que las descartaría como parásitas. En una relación de parasitismo resulta fundamental precisar que los participantes deben de pertenecer a especies diferentes.
Así, la única posibilidad de que los versos concernientes a pulgas pequeñas sobre otras de mayor tamaño pudieran referirse a una relación de hiperparasitismo sería si cada una correspondiera a una especie distinta y, además, que las sucesivas pulgas pequeñas actuaran efectivamente como parásitos, ya que el simple hecho de vivir sobre o dentro de otro organismo de tamaño mayor no convierte de inmediato al más pequeño en un parásito. Por tanto, para entender una relación como el hiperparasitismo es necesario primero asegurarnos de comprender el concepto biológico de parásito.
La conocida enciclopedia libre Wikipedia (s. f.) dice que se considera como parásito a un organismo que depende de otro denominado huésped, del que obtiene algún beneficio, y de paso, provoca un daño o perjuicio al hospedador. La definición parece funcionar, sin embargo, su simpleza puede llevar a confusiones, pues en este caso cualquier relación depredador-presa se ajustaría a tal descripción, lo que desde el punto de vista ecológico es incorrecto porque la depredación y el parasitismo son relaciones interespecíficas diferentes. Así, la definición básica de parásito se ha complementado con alguno o una combinación de atributos como la asociación espacial entre el parásito y el huésped, el tipo de perjuicio que el primero infringe al segundo, el tipo de dependencia, el tamaño relativo entre los componentes de la relación, el número de individuos participantes, etcétera.
Entonces, los parásitos son definidos como aquellos organismos que viven en o sobre otro organismo, recibiendo sostén de éste y causándole daño (Lucius et al., 2017); o como organismos que dependen para su vida del huésped, al cual generalmente no destruyen, pero al que provocan un daño (Pérez-Íñigo, 1976). Asimismo, otros autores los consideran como organismos vegetales o animales que viven a costa de otro de distinta especie, alimentándose de él y deteriorándole sin llegar a matarlo (Guzmán-Cornejo et al., 2012); como simbiontes2 que causan daño a su huésped o en algún sentido viven a expensas de éste (Roberts y Janovy, 2005); o como organismos que obtienen sus nutrientes de uno o unos pocos individuos huéspedes provocándoles habitualmente un daño, pero sin causarles una muerte inmediata (Begon et al., 1995).
A pesar de las distintas definiciones, cada una de ellas es más o menos adecuada dependiendo del punto de vista del observador. Así, la acepción de parásito que es útil a un médico o sus pacientes puede no ser compartida por un ecólogo, que es capaz de percibir los difusos límites entre el parasitismo y otras relaciones interespecíficas como el comensalismo, cuando sólo una especie se beneficia sin perjudicar a la otra, o el mutualismo, donde ambos participantes resultan beneficiados (Herrera-Mares y Guzmán-Cornejo, 2020), Incluso, recientemente se ha documentado que la relación ecológica entre dos participantes puede cambiar (por ejemplo, de parasitismo a comensalismo, o viceversa) en función de las condiciones ambientales.
Lo anterior resalta un problema difícil de resolver, que es la dificultad en definir y/o medir el daño que provoca el parásito. Si bien algunas especies causan un perjuicio evidente al individuo hospedador, con otras la parasitosis es apenas perceptible, incluso con estudios clínicos. Por ejemplo, las famosas “lombrices intestinales”, que en realidad son gusanos nematodos de la especie Ascaris lumbricoides, provocan en los seres humanos diversos trastornos intestinales que se manifiestan con fuertes vómitos y enteritis (inflamación del intestino delgado), lo que puede incluso causar bloqueo del tracto digestivo seguido de peritonitis.3 En cambio, la especie conocida comúnmente como “solitaria” (Taenia solium) es también parásita del tracto digestivo del ser humano, pero apenas provoca escasos síntomas genéricos cuando el adulto se aloja en los intestinos (Mehlhorn, 2016). Por tal razón, la presencia de algunos tipos de parásitos suele pasar desapercibida hasta que el hospedador es sometido a exámenes específicos. Este tipo de pruebas clínicas informa de inmediato a los médicos y veterinarios, no obstante, tales exámenes rara vez se aplican en el estudio de la vida silvestre.
En cambio, como biólogos, el concepto de parásito debería aplicarse de acuerdo con el paradigma central de la disciplina, es decir, en función de la evolución por selección natural. Así, un parásito será aquella especie que potencial o efectivamente, reduce la adecuación4 del hospedador. Al definir parásito de esta manera, es posible evitar confusiones, al descartar casos de asociación que en realidad no implican un efecto negativo, o que incluso representan un beneficio.
Un ejemplo sería el de los peces lophiiformes (ver figura 1), que habitan grandes profundidades, de aspecto terrible, con grandes bocas y dientes afilados, en donde las hembras son unas diez veces más grandes que los machos, quienes además viven adheridos a éstas y se nutren a sus expensas, por lo que la literatura científica comúnmente los considera sus parásitos (Pietsch, 2009; Vieira et al., 2013; Hernández-Urcera y Guerra, 2014), en lo que se denomina parasitismo sexual (Pietsch, 2009; Vieira et al., 2013). Sin embargo, considerarlo parasitismo por la simple dependencia y la probable molestia que el macho causa la hembra es por demás erróneo, pues tal asociación confiere a la hembra una ventaja selectiva al garantizar su reproducción y la transmisión de sus genes a la siguiente generación.
Figura 1. Pez lophiiforme Centrophryne spinulosa. A) Hembra (369 mm de longitud estándar) con un macho asociado (38.0 mm de longitud estándard), vista lateral izquierda. B) Macho “parásito”, vista lateral izquierda. C) Detalle del acoplamiento, vista lateral derecha. Dibujos por Helena Encarnação. Reimpresa con permiso de Vieira et al. (2013).
Es importante resaltar que la adopción de un estilo de vida parasitario ha resultado tan conveniente en términos evolutivos, que se encuentra en diversos taxones y en distintos períodos de la historia filogenética de los seres vivos (Weinstein y Kuris, 2016). Aunque el estudio de la biodiversidad de taxones parásitos ha sido enormemente subestimado (Windsor, 1995), la suma de las especies con este estilo de vida constituye una gran proporción de la diversidad biológica, considerándose incluso la posibilidad de que al menos la mitad de las especies conocidas sean parásitas (Windsor, 1998).
Entre dichas especies parásitas, existe un conjunto que es capaz de actuar como hiperparásito, es decir, que provoca una disminución de la adecuación de su hospedador, que por su parte también es un parásito; entonces, se trata de parásitos de los parásitos. En ellas, son relativamente comentados los hongos que viven a expensas de otro organismo parásito. Sin embargo, existen otros casos como los de ciliado-ciliado5 (como el género Phtorophrya, que es hiperparásito del ciliado Gymnodinioides, el cual aprovecha los fluidos secretados durante la muda de la cutícula de su huésped crustáceo (Lynn, 2008)); ciliado-animal (p. ej. los ciliados de la familia Isochonidae son parásitos de crustáceos copépodos del genero Balaenophilus, que a su vez son parásitos de ballenas (Lynn, 2008); o ciliados del género Trichodina como hiperparásitos de monogeneos, que son un grupo de pequeños gusanos planos que son ectoparásitos de las branquias de los peces (Colorni y Diamant, 2005); o ciliados peritricos asociados al copépodo parásito de peces dulceacuícolas Lernaea cyprinacea (Van As, 2019); o animal-animal (p. ej. crustáceos isópodos similares a las cochinillas, que pertenecen a la familia Cabiropidae que son hiperparásitos de otros isópodos de la familia Bopyridae (Smit et al., 2019); o isópodos parásitos de otros grupos de crustáceos como percebes o decápodos (Van As, 2019); o larvas de cestodos dentro del cuerpo de otros gusanos llamados trematodos (Ostrowski de Núñez, 1966).
Cuando pensamos en especies parásitas, por lo general recurrimos a ejemplos en los que el protagonista es un animal, un protozoo (ver figura 2) o un hongo (estos últimos merecedores de un trabajo aparte, dada su gran diversidad), pues es fácil suponer que algunas especies de estos grupos han moldeado su estilo de vida para aprovechar los recursos que las especies hospedadoras ofrecen.
Figura 2. Fotomicrografía electrónica de barrido de ciliados peritricos (subclase Peritrichia) asociados a huevos de temnocéfalos, que son gusanos aplanados que viven sobre la superficie de crustáceos como los cangrejos. Imagen cedida por el Dr. Andrés Martínez Aquino, Facultad de Ciencias de la Universidad Autónoma de Baja California, Unidad Ensenada.
En otro tipo de seres vivos como las plantas, que son capaces de producir su propio alimento por medio de la fotosíntesis, no existe una necesidad aparente de adoptar un estilo de vida parasitario, por lo que comúnmente son pasadas por alto en la mayor parte de los textos de parasitología. Sin embargo, existe un no tan reducido número de especies de plantas que son efectivamente parásitas y que no son bien conocidas (ver figura 3). Al igual que sucede con otros grupos, el parasitismo en las plantas se ha detectado en diferentes linajes evolutivos, y en algunas familias particulares de plantas con flores es en donde encontramos la mayor diversidad (Nickrent, 2002).

Figura 3. Ejemplar de Psittacanthus calcyculatus, planta parásita, en una leguminosa (Bahuinia sp.) en Villa de Etla, Oaxaca.
Crédito: Raúl Contreras y Rogelio Aguilar.
Las plantas parásitas son un grupo poco abordado en los diferentes estudios florísticos en México, y esto posiblemente se debe al poco interés que se tiene sobre su biología, o por lo difícil de su colecta, preparación, identificación y mantenimiento en colecciones biológicas (Cruz-Pérez, 2019). Aún así, a nivel nacional existe el registro de cerca de 400 especies de plantas parásitas distribuidas en 40 géneros (Cházaro, 2006).
El hecho de que exista parasitismo en las plantas resulta de gran interés, pues la adopción de este estilo de vida rompe el paradigma de la autotrofía,6 lo que da lugar a la posibilidad de que las plantas persistan sin la necesidad de invertir recursos en la generación de su propio alimento, y que dependan de una heterotrofía estricta, o al menos de una alternancia entre ambos tipos de alimentación (Nickrent, 2002; Cruz-Pérez, 2019). Con el objetivo de cuantificar la diversidad de este interesante y poco conocido grupo de plantas, en la Universidad Autónoma “Benito Juárez” de Oaxaca hemos iniciado recientemente una línea de estudio dedicada a esta flora. Determinamos que en el estado de Oaxaca habitan poco más de 100 especies de plantas parásitas y, de éstas, al menos dos son hiperparásitas (o epiparásitas, como se les llama también en botánica), al poder crecer y aprovechar los recursos que obtienen de otra planta parásita. Ambas especies epiparásitas o hiperparásitas pertenecen al género Phoradendron de la familia Santalaceae, y son conocidas comúnmente como “injertos” o “muérdagos” (Rzedowski y Calderón, 2011). Una de ellas, Phoradendron iltisiorum, considerada nativa de los estados de Oaxaca y Guerrero (Galván-González et al., 2021), se ha encontrado parasitando a plantas de la familia Loranthaceae, que a la vez son parásitas de encinos; en tanto Phoradendron falcatum (ver figura 4) presenta el interesante caso de parasitar a otras especies del mismo género Phoradendron.

Figura 4. Ejemplar de Phoradendron falcatum (Departamento de Botánica, Instituto de Biología [IBUNAM], 2019).
Como ya se ha referido, las especies parásitas (incluidas las hiperparásitas) constituyen una gran proporción de la biodiversidad. Si bien el parasitismo posee mala fama desde varios puntos de vista, como el médico o el veterinario, desde la perspectiva de la biología y la ecología, las especies parásitas tienen gran relevancia como componentes de la diversidad biológica y como factores que contribuyen a regular las poblaciones de los hospederos, por lo que su presencia es importante para mantener la estructura y función de los ecosistemas. Por lo anterior, conocer su diversidad y las relaciones que guardan con su ambiente y con otros organismos es necesario para la elaboración de estrategias integrales de conservación y/o restauración de los sistemas biológicos.
Entonces, saber más sobre la gran diversidad de especies parásitas y sus intrincadas relaciones ayudará a adoptar nuevas perspectivas. Así, seremos como el capitán Gulliver al final de sus viajes, quien después de haber analizado y comprendido los distintos tipos de sociedades que conoció, aprendió a valorar cada uno de ellos.
Referencias
- Begon, M., Harper, J. L., y Townsend, C. R. (1995). Ecología: individuos, poblaciones y comunidades. Omega.
- Cházaro, M. J. (2006). Las plantas parásitas de México: florística y fitogeografía [Tesis de doctorado, Universidad de Guadalajara]. Repositorio Dspace. http://repositorio.cucba.udg.mx:8080/xmlui/handle/123456789/4823.
- Colorni, A., y Diamant, A. (2005). Hyperparasitism of trichodinid ciliates on monogenean gill flukes of two marine fish. Diseases of Aquatic Organisms 65(2), 177-180. https://doi.org/10.3354/dao065177.
- Cruz-Pérez, D. H. (2019). Las plantas parásitas vasculares de Oaxaca: riqueza y distribución [Tesis de licenciatura, Universidad Autónoma “Benito Juárez” de Oaxaca].
- Departamento de Botánica, Instituto de Biología (ibunam). (2019, 24 de noviembre). Phoradendron falcatum Eichler, ejemplar de: Herbario Nacional de México (mexu), Plantas Vasculares. Portal de Datos Abiertos unam. http://datosabiertos.unam.mx/IBUNAM:MEXU:920157.
- Gállego, J. (2003). Manual de Parasitología: morfología y biología de los parásitos de interés sanitario. Publicacions i Edicions, Universitat de Barcelona. http://www.publicacions.ub.es/refs/indices/06738.pdf.
- Galván-González, L. G., Espejo-Serna, A., y Cerros-Tlatilpa, R. (2021). Phoradendron iltisiorum (Santalaceae), nuevo registro para el estado de Guerrero, México. Journal of the Botanical Research Institute of Texas, 15(2), 579-581. https://doi.org/10.17348/jbrit.v15.i2.1164.
- Guzmán-Cornejo, C., García-Prieto, L., Rivas, G., Mendoza-Garfias, B., Osorio-Sarabia, D., y Montiel-Parra, G. (2012). Manual de prácticas de metazoarios parásitos de vertebrados. Las Prensas de Ciencias.
- Hernández-Urcera, J. y Guerra, A. (2014). La vida en las grandes profundidades. Dendra Médica, Revista de Humanidades, 13(1), 34-48. https://cutt.ly/4Aa4i5z.
- Herrera-Mares, A., y Guzmán-Cornejo, C. (2020, marzo-abril). Hasta que la extinción nos separe: parásitos para toda la vida. Biodiversitas, 149, 12-16. https://bioteca.biodiversidad.gob.mx/janium/Documentos/15190.pdf.
- Lucius, R., Loos-Frank, B., Lane, R. P., Poulin, R., Roberts, C. W., y Grencis, R. K. (2017). The biology of parasites. Wiley-VCH.
- Lynn, D. H. (2008). The ciliated protozoa: Characterization, classification, and guide to the literature. Springer.
- Mehlhorn, H. (2016). Human parasites: Diagnosis, treatment, prevention. Springer.
- Nickrent, D. L. (2002). Orígenes filogenéticos de las plantas parásitas. En J. A. López-Sáez, P. Catalán, y L. Sáez (Eds.), Plantas parásitas de la Península Ibérica e Islas Baleares (pp. 29-56). Mundi-Prensa Libros.
- Ostrowski de Núñez, M. (1966). Sobre un caso de hiperparasitismo: una larva de cestodes en el paránquima de Drepanocephalus spathans Dietz (Trematoda, Echinostomidae), parásito del biguá. Neotropica (La Plata) 12(39), 81-85.
- Pérez-Íñigo, C. (1976). Parasitología. Editorial Blume.
- Pietsch, T. W. (2009). Oceanic Anglerfishes: Extraordinary diversity in the deep sea. University of California Press.
- Roberts, L. S., y Janovy, J. (2005). Foundations of Parasitology. McGraw-Hill.
- Rzedowski, J., y Calderón G. (2011). Viscaceae. En J. Rzedowski, y G. Calderón (Eds.). Flora del Bajío, Fascículo 170 (pp. 1-57) Instituto Nacional de Ecología.
- Smit, N. J., Bruce, N. L., y Hadfield, K. A. (2019). Introduction to parasitic Crustacea: State of knowledge and future trends. En N. J. Smit, N. L. Bruce, y K. A. Hadfield (Eds.). Parasitic Crustacea: State of knowledge and future trends (pp. 1-6). Springer.
- van As, L. L. (2019). Hypersymbionts and hyperparasites of parasitic Crustacea. En N. J. Smit, N. L. Bruce, y K. A. Hadfield (Eds.). Parasitic Crustacea: State of knowledge and future trends (pp. 343-395). Springer.
- Vieira, S., Biscoito, M., Encarnação, H., Delgado, J., y Pietsch, T. W. (2013). Sexual parasitism in the deep-sea ceratioid Anglerfish Centrophryne spinulosa Regan and Trewavas (Lophiiformes: Centrophrynidae). Copeia 2013(4), 666-669. https://doi.org/10.1643/CI-13-035.
- Weinstein, S., y Kuris, A. M. (2016). Independent origins of parasitism in Animalia. Biology Letters, 12(7), 20160324. https://doi.org/10.1098/rsbl.2016.0324.
- Windsor, D. A. (1995). Equal rights for parasites. Conservation Biology, 9(1), 1-2. https://cutt.ly/xAa6WHV.
- Windsor, D. A. (1998). Most of species on Earth are parasites. International Journal for Parasitology, 28(12), 1939-1941. https://doi.org/cx8vmt.
Agradecimientos
Los autores desean agradecer a las divulgadoras de la ciencia Patricia Magaña Rueda, Clementina Equihua y Paloma Zubieta por la revisión y los comentarios al primer borrador del manuscrito.
Recepción: 12/9/2018. Aprobación: 4/10/2018.




