Vol. 22, núm. 5 septiembre-octubre 2021
Aplicaciones médicas de los anticuerpos
Benjamín García Ramírez y Adela Rodríguez Romero CitaResumen
Debido a la pandemia originada por el virus sars-CoV-2, los anticuerpos se han convertido en foco de discusión. Estas moléculas, también llamadas inmunoglobulinas, son proteínas especializadas, producidas por el sistema inmune en respuesta a la presencia de invasores extraños del cuerpo, como virus, bacterias, parásitos o cualquier otra sustancia extraña, a las cuales se les denomina antígenos. Una vez detectados, los anticuerpos se unen a estos invasores de una manera muy específica y entonces los marcan para ser destruidos. Sin embargo, existen muchas dudas sobre qué son los anticuerpos y cómo funcionan. Este documento tiene como objetivo aclarar algunas preguntas relacionadas con estas moléculas.
Palabras clave: anticuerpos, inmunoglobulinas, vacuna, virus.
Antibodies’ medical applications
Abstract
Antibodies have been the focus of discussion due to the pandemic caused by the sars-CoV-2 virus. These molecules, also called immunoglobulins, are specialized proteins produced by the immune system in response to the presence of foreign invaders of the body, such as viruses, bacteria, parasites or any other substance, which are called antigens. Once detected, the antibodies bind to these invaders in a very specific way and then mark them for destruction. However, there are many questions about what antibodies are and how they work. This document aims to clarify some questions related to these molecules.
Keywords: antibodies, immunoglobulins, vaccine, virus.
¿Qué son los anticuerpos?
Los anticuerpos son grandes estructuras proteicas, que forman parte del sistema inmune y se encuentran en la sangre, saliva, lágrimas, leche materna y mucosas. Éstos protegen a los organismos ante sustancias dañinas o patógenos, por lo que evitan las enfermedades.
Los anticuerpos están constituidos por una o más cadenas de aminoácidos y algunas de ellas tienen unidas cadenas de azúcares o sacáridos. Un aminoácido es una molécula orgánica pequeña, que contiene un grupo amino, uno carboxilo y una cadena lateral, que puede presentar diferentes características químicas. En la naturaleza existen 20 aminoácidos diferentes y son las piezas básicas que constituyen a las proteínas, al unirse entre sí por un enlace peptídico. Si imaginamos a una proteína como una cadena de perlas, cada aminoácido es representado por una perla de color diferente (ver figura 1, izquierda). Para que estas cadenas puedan realizar alguna función, la mayoría de las veces deben de adquirir una estructura tridimensional o plegamiento específico, es decir, una forma no lineal. Esta estructura tridimensional depende de los aminoácidos que la componen y de la longitud de la cadena (ver figura 1, derecha).
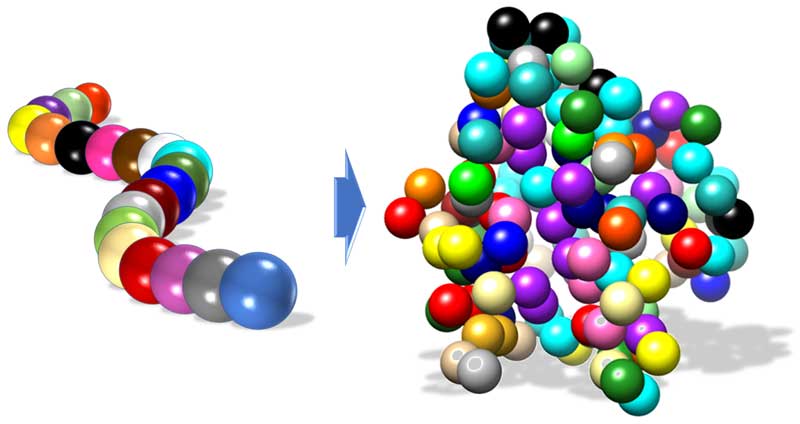
Figura 1. Izquierda. Cadena de aminoácidos lineal. Derecha. Cadena de aminoácidos plegada, que es como adquiere, generalmente, su actividad biológica. Cada aminoácido está representado por una perla de diferente color.
En general, los anticuerpos están constituidos por cuatro cadenas de aminoácidos: dos cadenas pesadas, que contienen un número mayor de aminoácidos, y dos cadenas ligeras idénticas. Estas cadenas se unen y forman una estructura en forma de la letra Y (ver figura 2). Las diferencias entre los aminoácidos que componen dichas cadenas brindan distintas características a los anticuerpos, como flexibilidad, distinción entre patógenos (especificidad), el tipo de respuesta que despliegan, e inclusive la forma en que se encuentran en el organismo. Los anticuerpos se dividen en dos fragmentos, el fragmento de unión al antígeno o Fab (del inglés antigen binding fragment), que se compone de la cadena ligera y la cadena pesada (ver figura 2), y el fragmento Fc (del inglés crystallizable fragment), que es la continuación de las dos cadenas pesadas, y es el que tiene la capacidad de interaccionar con otros elementos del sistema inmune (Abbas et al., 2014, p. 88).
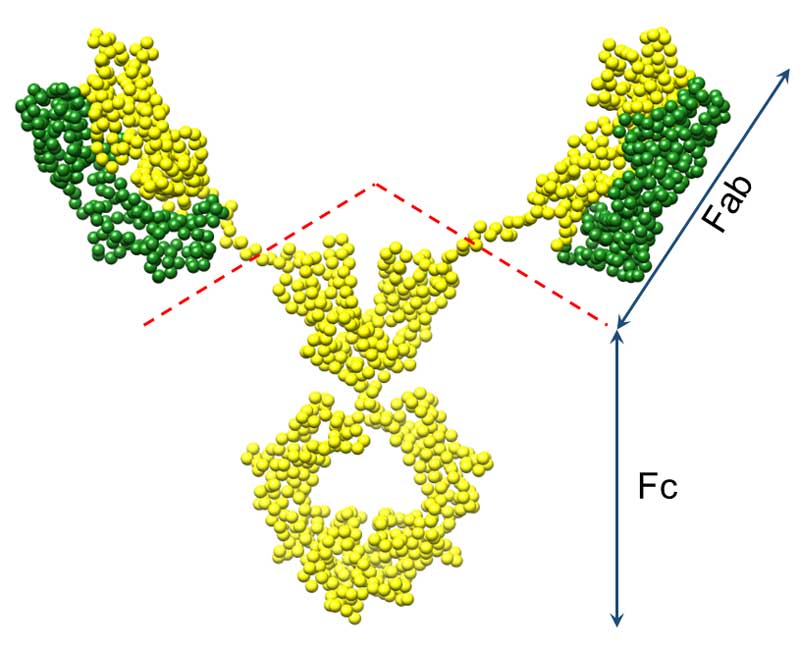
Figura 2. Representación en esferas de un anticuerpo. Se muestran en amarillo los aminoácidos de las dos cadenas pesadas (440 aminoácidos), y en verde las dos cadenas ligeras (220 aminoácidos). La línea discontinua (rojo) indica la separación entre el fragmento Fab y el fragmento Fc.
Los anticuerpos reconocen, de manera muy específica, regiones en la superficie de los agentes externos o antígenos mediante los fragmentos Fab. Los antígenos pueden ser proteínas, carbohidratos, lípidos u otras moléculas encontradas en bacterias, hongos, parásitos, virus, productos químicos y otras sustancias que provocan que el sistema inmunológico desencadene una respuesta. Una vez unidos a los antígenos, los anticuerpos trasmiten una señal a través de la unión del fragmento Fc a receptores específicos, lo que desencadena una cascada de acciones que “vencen” al invasor. Estos receptores están localizados en la superficie de varias células del sistema inmunológico (ver figura 3). Los anticuerpos son parte del sistema inmunológico adaptativo, que reconoce y elimina patógenos específicos.
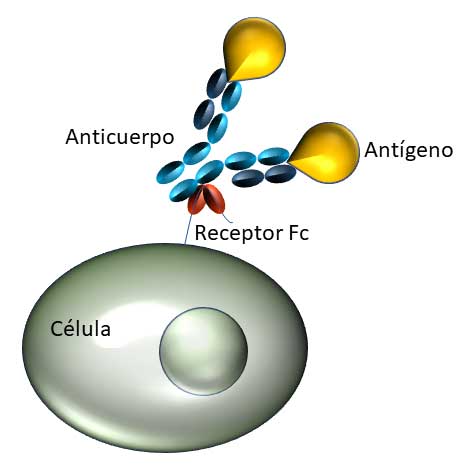
Figura 3. Esquema que muestra el reconocimiento de un agente externo o antígeno (amarillo) por un anticuerpo (azul), el cual se une al receptor de una célula del sistema inmune (rojo), mediante su fragmento Fc (azul).
Por tanto, una de las funciones principales de los anticuerpos que son secretados a la mucosa y sangre es unirse e inactivar sustancias extrañas como virus, patógenos o toxinas. La región en la superficie del virus o patógeno que es reconocida por el anticuerpo se denomina epítopo, mientras que la región que reconoce al epítopo se conoce como parátopo y cada anticuerpo cuenta con dos parátopos (ver figura 4). Estos últimos reconocen de manera complementaria al epítopo, formando un complejo anticuerpo-antígeno a través de una serie de interacciones muy específicas, tal y como una llave reconoce a la cerradura. Consecuentemente, a mayor complementariedad parátopo-epítopo, el anticuerpo será más específico; por el contrario, sí no existe complementariedad no habrá reconocimiento (ver figura 4). Esta especificidad favorece, por ejemplo, que un anticuerpo reconozca al virus de la influenza y no al virus sars-CoV-2.
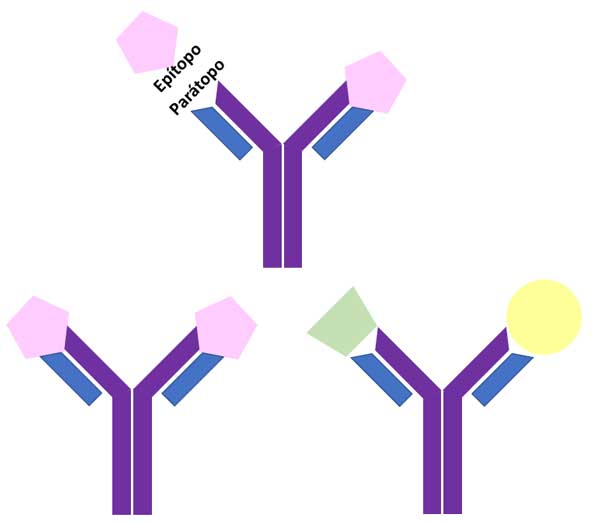
Figura 4. Esquema del reconocimiento de un antígeno por un anticuerpo. En rosa se muestra al antígeno con su epítopo uniéndose al parátopo. El reconocimiento parátopo-epítopo es complementario. En verde y amarillo se muestran antígenos no complementarios.
¿Dónde se forman y como actúan los anticuerpos?
En los organismos existen múltiples respuestas inmunológicas, algunas de las cuales están mediadas por células y otras por proteínas. En la respuesta mediada por proteínas, también llamada respuesta humoral, se encuentran los anticuerpos.
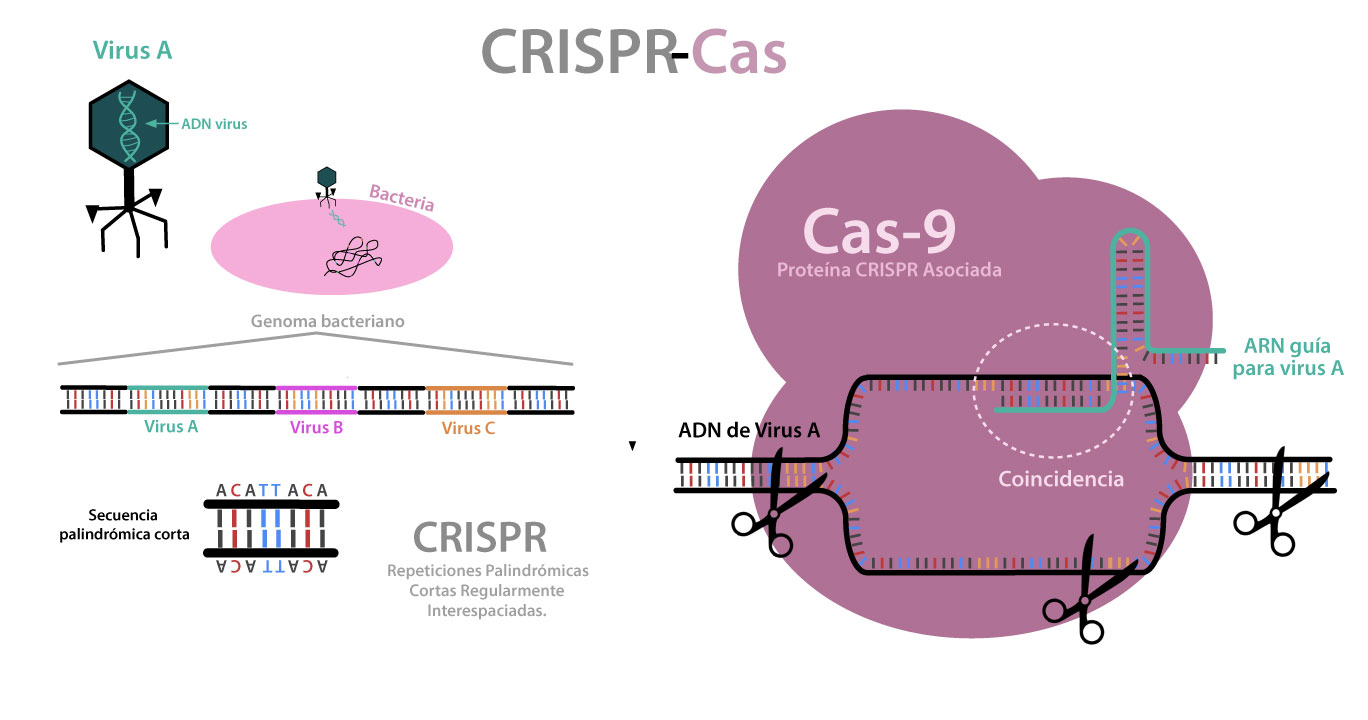
Los anticuerpos generados en mamíferos son producidos por las células B o glóbulos blancos que se forman en la médula ósea. Estos últimos producen anticuerpos, inicialmente como receptores en su superficie, y una vez que maduran, los liberan. Cuando los antígenos son reconocidos, las células B se activan a través de un complejo mecanismo que les permite madurar y dividirse en células idénticas llamadas clon. Algunas células B derivan en células plasmáticas, que actúan como fábricas, secretando millones de anticuerpos al torrente sanguíneo y al sistema linfático, o pueden derivar en células B de memoria, que permiten una respuesta del sistema inmune en menor tiempo, cuando existe una segunda exposición al mismo antígeno (Murphy y Weaver, 2016, p. 195). Para entender la importancia de los anticuerpos, podemos pensar en personas infectadas por el Virus de Inmunodeficiencia Adquirida (vih), el cual daña el sistema inmunológico al destruir sus glóbulos blancos, por lo que no se producen anticuerpos contra agentes extraños y las personas pueden, entonces, sufrir enfermedades graves.
En humanos existe un “ejercito” de diferentes tipos de anticuerpos, las inmunoglobulinas (Ig) G, D, E, A y M (ver figura 5), los cuales están caracterizados por sus cadenas pesadas y gracias a éstas se localizan en distintos lugares del organismo, en diferentes concentraciones y respuestas. Tanto IgE como IgM tienen una cadena pesada más larga que la IgG y la IgD. La IgA, por otra parte, se puede encontrar como monómero o como dímero, es decir, dos IgA unidas por otra cadena llamada J. La IgM puede formar un complejo que consta de cinco IgM y una cadena J (Alberts et al., 2002).
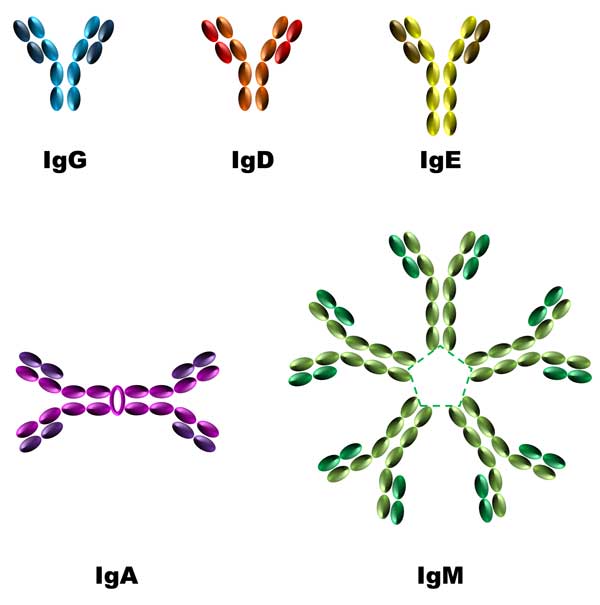
Figura 5. Diferentes tipos de inmunoglobulinas. La IgG, IgA e IgD cuentan con una cadena pesada más corta mientras que es más larga en la IgE e IgM. La IgA e IgM pueden formar estructuras de mayor tamaño.
La IgM es el primer anticuerpo que se genera en las células B, y es secretado en grandes cantidades. En el caso de infecciones virales, como la covid-19, éste es el primer anticuerpo en “entrar en acción”. A medida que maduran las células B, también se expresa la IgD, pero en cantidades menores.
Los anticuerpos IgG son los más importantes en la defensa contra bacterias y virus patógenos, como el sars-CoV-2 que invaden el cuerpo humano. En general, debe de trascurrir un tiempo para que sean expresados, son abundantes en circulación sanguínea y son los únicos capaces de atravesar la placenta, confiriendo inmunidad al feto. Además, se pueden unir a la superficie del patógeno para evitar que éste entre a las células humanas a replicarse, o lo marcan para que otras células lo destruyan.
Los anticuerpos IgE tienen un papel importante en la defensa contra parásitos y están implicado en respuestas alérgicas. Finalmente, el anticuerpo IgA se encuentra en las mucosas y en las secreciones como lágrimas, donde brinda protección. Recientemente, se ha reportado que los bajos niveles de IgA están asociados también con asma y repuestas alérgicas (Kim et al., 2017).
Los anticuerpos contra un patógeno requieren varios días, incluso semanas, para producirse cuando el individuo es infectado por primera vez. Sin embargo, cuando el individuo se re-expone al mismo patógeno, entonces producirá anticuerpos específicos de manera muy rápida (usualmente 24 horas). Debido a esto, necesitamos vacunas para protegernos contra algunos patógenos. Además, los anticuerpos no efectúan la misma función cuando se unen a un objetivo. Algunos cortan la infección desde un principio, neutralizando directamente al antígeno y evitando que el patógeno entre en la célula. Otros etiquetan a los invasores, de modo que algunas células del sistema inmunológico puedan eliminarlo. Otros pueden cubrir a los virus o bacterias en una capa pegajosa. Finalmente, otros anticuerpos avisan a las células inmunes llamadas macrófagos para que devoren al invasor.
Existe una clara variabilidad de la respuesta entre individuos ante un patógeno, hay algunos que producen anticuerpos de muy alta calidad, que son muy buenos para reconocer al antígeno, mientras que otros individuos producen anticuerpos que no son tan efectivos para unirse al patógeno y proporcionan sólo una protección parcial. Estos últimos pueden experimentar una infección más severa con síntomas más prolongados. Para los pacientes infectados con sars-CoV-2 no se sabe a ciencia cierta qué porcentaje está en las dos categorías mencionadas.
Los anticuerpos y sus aplicaciones médicas
Desde la antigüedad, se observó que individuos curados de algunas enfermedades eran resistentes a infecciones posteriores. También se vio que podían adquirir protección ante dichas enfermedades al ser inmunizados con una variante atenuada. En 1976 el Dr. Edward Jenner demostró que una vacuna elaborada con el virus que infecta a roedores confería inmunidad contra el virus de la viruela en humanos. Después de más de un siglo del uso de la primera vacuna, se descubrió que los organismos inmunizados contenían “sustancias activas” denominadas anticuerpos. Estas moléculas complejas, generadas por el sistema inmunológico en respuesta a la presencia de un antígeno específico, podían ser aisladas y usadas para la prevención o el tratamiento de enfermedades.
Las vacunas normalmente contienen fragmentos del patógeno para estimular al sistema inmune a producir anticuerpos antígeno-específicos y generar células de memoria. Así, los organismos se preparan para responder rápidamente ante un nuevo ataque del patógeno. En el caso del sars-CoV-2, se han producido vacunas que generan anticuerpos contra la proteína S (espícula o spike), que sobresale en la superficie del virus.
Actualmente, científicos y empresas farmacéuticas buscan producir, en grandes cantidades, anticuerpos que reconozcan epítopos específicos para imitar o desencadenar la respuesta del sistema inmunológico. Los anticuerpos pueden ser policlonales cuando reconocen el mismo antígeno, pero diferente epítopo (fuerza y especificidades diferentes) o monoclonales que sólo reconocen un epítopo (Ecker et al., 2015). En aplicaciones médicas se busca que los anticuerpos sean monoclonales y son generados de dos maneras: a partir de una tecnología llamada hibridoma, donde las células B que producen al anticuerpo deseado son fusionadas con células cancerígenas, dando como resultado células inmortales que producen anticuerpos de manera constante (Ghahane et al., 2017), o mediante el uso de técnicas de biología molecular, en las que se obtienen construcciones genéticas que son introducidas en células animales o bacterianas, para ser traducidas como el anticuerpo deseado (Buss et al., 2012).
La producción de anticuerpos por biología molecular es más sencilla, aunque no siempre se obtiene la afinidad esperada, es decir, el anticuerpo no se une fuertemente a su antígeno. Sin embargo, una vez obtenida la afinidad deseada, los anticuerpos pueden ser fusionados con otras proteínas permitiendo que se emita una señal cuando el anticuerpo reconoce al antígeno; esta señal puede ser un cambio de color, o bien la emisión de fluorescencia. Tal es el caso de los anticuerpos que se usan para detectar sars-CoV-2 mediante inmunoensayos.
De los anticuerpos, la IgG ha sido el más investigado, razón por la cual se ha obtenido una gran diversidad de éstos con diferentes especificidades y afinidades. Algunos de ellos han sido empleados en diversas terapias, al suministrarse completos o en fragmentos, dependiendo del antígeno blanco y de la respuesta que se busque obtener. No obstante, existen algunas limitantes para su uso, debido a que no se conocen completamente algunas de sus características, como su comportamiento en diferentes soluciones, o bien el efecto de sus secuencias de aminoácidos en cada organismo.
En el área diagnóstica, los anticuerpos se emplean en la detección de enfermedades o para determinar el estado de salud de un individuo. Algunos ejemplos son la detección de patógenos (parásitos, virus y bacterias), cáncer, autoinmunidad, embarazo, niveles hormonales, entre otros. Actualmente, algunas pruebas diagnósticas están enfocadas para su uso por personas no especializadas, de manera que puedan ser adquiridas comercialmente en farmacias o centros de distribución, como es el caso de las pruebas de embarazo. No obstante, la gran mayoría dependen de personal capacitado y certificado en los métodos de laboratorio, ya que estos últimos son más precisos y cuantificables al reportar valores numéricos. En el caso de la covid-19, se emplean pruebas rápidas de antígeno para detectar presencia del sars-CoV-2, o las pruebas rápidas de sangre, para saber si el individuo tiene presencia de anticuerpos contra sars-CoV-2.
En el campo terapéutico, los anticuerpos se suministran directamente al individuo para contener enfermedades o mejorar su salud. Algunos anticuerpos han sido empleados en el tratamiento de personas con asma, cáncer, artritis reumatoide, Alzheimer, como antídotos contra venenos o al estimular su producción, como en la tuberculosis y el sarampión. Este último método también puede prevenir el desarrollo de algunas enfermedades, y esto se hace suministrando el antígeno en pequeñas cantidades (Matsuoka et al., 2013). Sin embargo, existen incógnitas alrededor de los anticuerpos, por ejemplo, cómo las células discriminan entre agentes externos para generar anticuerpos y por qué las células pueden generar anticuerpos contra el mismo organismo, como en la enfermedad de lupus, una enfermedad autoinmune.
El 21 de noviembre de 2020, la fda (Food and Drug Administration de los Estados Unidos) dio una autorización de uso de emergencia de los anticuerpos monoclonales casirivimab e imdevimab para el tratamiento de la covid-19. Por supuesto, el costo de estos anticuerpos es bastante elevado, comparado con el costo de un antibiótico o un tratamiento antiviral.
Conclusión
Los anticuerpos monoclonales se emplean en numerosas aplicaciones médicas como terapia, diagnóstico e investigación. No obstante, se trata de un campo del conocimiento que está en constante evolución, por lo que algunos avances actuales deberán ser adaptados en el futuro para alcanzar un mayor desarrollo. Consecuentemente, se generan productos más específicos y eficientes a medida que la investigación avanza, lo que contribuye en diversas aplicaciones médicas, como es el caso de los anticuerpos utilizados para diagnosticar y combatir al virus sars-CoV-2.
Referencias
- Abbas, A., Lichtman, A. H. H. y Pillai, S. (2014). Cellular and Molecular Immunology (8.ª ed.). Saunders.
- Alberts, B., Johnson A., Lewis J., Raff, M., Roberts, K. y Walter, P. (2002). Molecular Biology of the Cell (4.ª ed.). Garland Science.
- Buss, N. A., Henderson, S. J., McFarlane, M., Shenton, J. M. y de Haan, L. (2012). Monoclonal antibody therapeutics: history and future. Current opinion in pharmacology, 12(5), 615–622. https://doi.org/10.1016/j.coph.2012.08.001.
- Ecker, D. M., Jones, S. D. y Levine, H. L. (2015). The therapeutic monoclonal antibody market. mAbs, 7(1), 9–14. https://doi.org/10.4161/19420862.2015.989042.
- Kim, W. J., Choi, I. S., Kim, C. S., Lee, J. H. y Kang, H. W. (2017). Relationship between serum IgA level and allergy/asthma. The Korean journal of internal medicine, 32(1), 137–145. https://doi.org/10.3904/kjim.2014.160.
- Matsuoka, T., Shamji, M. H. y Durham, S. R. (2013). Allergen immunotherapy and tolerance. Allergology international: official journal of the Japanese Society of Allergology, 62(4), 403–413. https://doi.org/10.2332/allergolint.13-RAI-0650.
- Murphy, K. y Weaver, C. (2016). Janeway’s Immunobiology (9.ª ed.). Garland Science/Taylor and Francis.
Agradecimientos
Se agradece el apoyo financiero de la dgapa-unam (Proyecto papiit in-208418) y del conacyt (Proyecto Fronteras 87163).
Recepción: 13/01/2021. Aprobación: 13/04/2021.