

Revista Digital Universitaria ISSN: 1607 - 6079 | Publicación mensual
1 de noviembre de 2014 vol.15, No.11
• TEMA DEL MES •
Animales ponzoñosos y la utilidad de sus venenos
Introducción
Un veneno es una secreción producida en las glándulas especializadas de un animal, el cual se libera en otro animal, denominado blanco, mediante la inflicción de una herida con la ayuda de diferentes sistemas como colmillos, aguijones, arpones, entre otros. Estas secreciones contienen numerosas sustancias químicas y biomoléculas que pueden desestabilizar los procesos fisiológicos de otros organismos (FRY et al, 2006). | Los venenos representan para los organismos que los producen una ventaja evolutiva, ya que pueden ser utilizados para la cacería de presas o como un mecanismo de defensa contra el ataque de depredadores. | |
 | ||
Desde el punto de vista farmacológico, los venenos son mezclas complejas de sustancia activas que causan una amplia gama de síntomas. Los venenos de animales ponzoñosos son importantes fuentes de toxinas, y su estudio y caracterización, ha ayudado a un entendimiento más profundo de la fisiología humana y ha aportado información sobre su naturaleza y mecanismos de acción. También ha permitido el desarrollo de componentes terapéuticos a partir de sustancias especificas o toxinas, proteicas o no proteicas, provenientes de los mismos.
 | Los venenos de animales y sus toxinas, actualmente son reconocidos como fuentes de moléculas bioactivas que pueden ser utilizados para la formulación medicamentos o inclusive insecticidas específicos contra plagas en cultivos de interés. | |
 | ||
Arácnidos
Los arácnidos (clase arachnida) conforman un grupo de organismos que incluye a los ácaros, las garrapatas, las arañas patonas (opiliones), las tarántulas y los alacranes (Figura 1). Se conocen alrededor de 93,000 especies distribuidas en el mundo. En México se han descrito 5,387 (CONABIO, 2009). Los arácnidos pueden habitar una gran variedad de nichos ecológicos, siendo de vida libre o parásitos de otros organismos; la gran mayoría de estos organismos son depredadores de insectos y de otros arácnidos, llegando inclusive a consumir reptiles y mamíferos pequeños, mientras que otros se alimentan de plantas o son omnívoros (FRANCKE, 2014). Los ácaros son arácnidos microscópicos relacionados con padecimientos en veterinaria como la sarna del ganado y la canina, también se les ha relacionado con el desarrollo de alergias en humanos (NISBET et al, 2006; PEAT et al, 1996). Las garrapatas, por su parte, son importantes parásitos en el sector agropecuario, colonizando al ganado, y por su forma de alimentación hematófaga pueden ser vectores para enfermedades (JONGEJAN y UILENBERG, 2006). Dentro de los diferentes órdenes que comprenden a la clase arachnida, el orden aranae (arañas y tarántulas) y el orden scorpiones (alacranes) son de particular interés debido a que comprenden animales capaces de producir venenos, los cuales se han propuesto como fuentes de moléculas activas para el desarrollo de insecticidas y medicamentos como antibióticos (BAILEY y WILCE, 2001).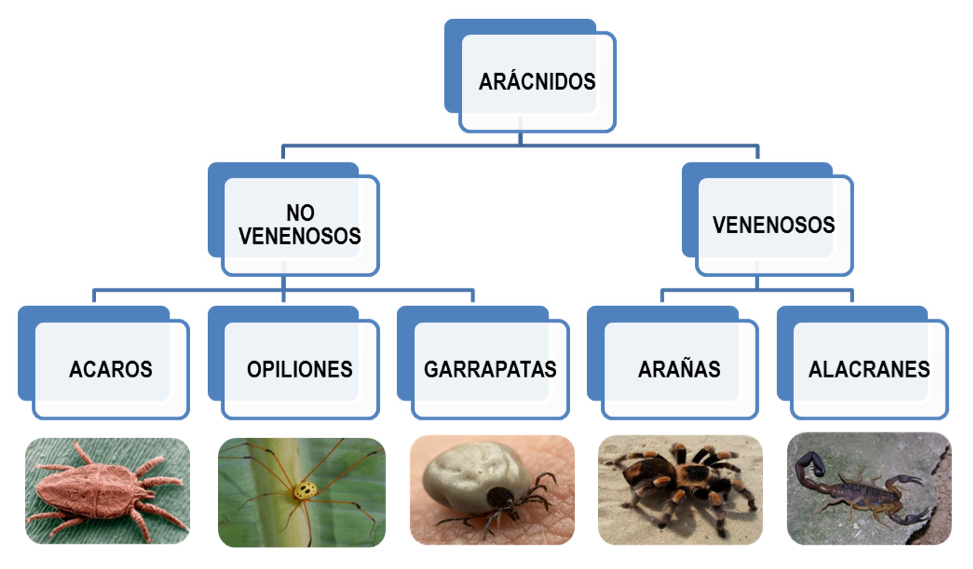
Figura 1. Principales grupos que comprenden a la clase arácnida.
Componentes del veneno de alacranes y arañas
El veneno de alacranes y arañas es una mezcla compleja de diferentes componentes proteicos, tales como toxinas, enzimas y péptidos. Estos actúan como herramientas de defensa contra predadores, o bien, para capturar a sus presas. En el caso de los venenos provenientes de los alacranes se conocen cerca de 500 componentes proteicos y se proyecta que existen cerca de 100,000 distintos componentes. Los componentes proteicos más estudiados en los venenos de alacranes son las toxinas que bloquean los canales dependientes de voltaje de Na+ y K+, los cuales son indispensables para la vida, y también se han reportado actividades enzimáticas como hialuronidasas y fosfolipasas (POSSANI y RODRÍGUEZ DE LA VEGA, 2006), así como la presencia de péptidos antibióticos. Las llamadas Pandininas, IsCT, Opistoporinas y BmK son algunos ejemplos de este tipo de antibióticos (ZENG et al, 2005). Por otro lado, el veneno de las arañas también presenta una amplia gama de componentes proteicos, principalmente neurotoxinas específicas para paralizar y matar insectos, las cuales han sido propuestas como alternativas para el control biológico de plagas en diferentes cultivos (WINDLEY et al, 2012). En las glándulas venenosas de arañas también se han identificado péptidos antibióticos como las Oxyopininas, Latarcinas y Lycotoxinas (SAEZ et al, 2010). Estos reportes ponen de manifiesto el potencial de los venenos de los arácnidos para la identificación de novedosos antibióticos.Problemática relacionada con los insectos plaga
En la actualidad se han descrito más de un millón de especies de insectos, las cuales sólo representan el 20% de su diversidad estimada en cinco millones (GRIMALDI, 2005). Los insectos son de gran importancia para todos los ecosistemas terrestres, participan en el reciclaje de nutrientes, ayudan a la polinización de las plantas, la dispersión de semillas, mantienen la estructura y la fertilizad de los suelos, controlan las poblaciones de otros organismos y sirven como fuente de alimento para otros grupos de animales (SCUDDER, 2009). | Los insectos son de gran importancia para todos los ecosistemas terrestres, participan en el reciclaje de nutrientes, ayudan a la polinización de las plantas, la dispersión de semillas, mantienen la estructura y la fertilizad de los suelos, controlan las poblaciones de otros organismos y sirven como fuente de alimento para otros grupos de animales. | |
 | ||
Dentro de los principales órdenes de insectos que atacan los cultivos se encuentran: Coleoptera (escrabajos), Orthoptera (langostas y saltamontes) y Lepidoptera (polillas y mariposas), siendo las larvas de este último grupo las plagas más destructivas en los cultivos de hortalizas, cereales y plantas textiles, entre otras (NOVOTNY y BASSET, 2005). Por otro lado, algunos insectos presentan gran impacto desde el punto de vista de la salud pública, debido a que son agentes transmisores (vectores) de bacterias, virus y protozoarios, causantes de enfermedades en animales y humanos. Entre los ejemplos más conocidos de enfermedades trasmitidas por insectos resaltan la enfermedad de Chagas, la malaria, el paludismo y el dengue, destacando los órdenes Diptera (mosquitos) y Heminoptera (chinches) como los principales (PARRA-HENAO, 2010).
Por muchos años, el combate de insectos plaga y vectores de enfermedades se ha llevado a cabo mediante el uso de compuestos insecticidas de origen químico, tales como el DDT, los piretroides, los compuestos halogenados, organosulfurados y organofosforados. Sin embargo, su acción insecticida es muchas veces inespecífica, ejerciendo su efecto tanto en los insectos problema, como en especies de insectos benéficas, e inclusive contra anfibios, como las ranas, sapos y salamandras, y mamíferos, como nosotros. Además de los problemas ecológicos relacionados con su alta toxicidad, persistencia y acumulación en el ambiente, el uso agrícola y doméstico de muchos de estos compuestos químicos ha sido prohibido en México, Estados Unidos y muchos países de la Unión Europea (GAVRILESCU, 2005).
Un problema más del uso de los insecticidas químicos radica en que su aplicación desmedida ha generado que muchas especies de insectos plaga adquieran resistencia a su acción, generando que tengan que ser utilizados en mayores cantidades o inclusive que no funcionen para detener la plaga. Debido a estos problemas, en los últimos años el control biológico de plagas,
 | ...la naturaleza nos provee una alternativa dentro de los venenos de los arácnidos, principalmente alacranes y arañas, los cuales presentan toxinas insecticidas, sin efectos en mamíferos, con un gran potencial para el desarrollo de nuevos bioinsecticidas. | |
 | ||
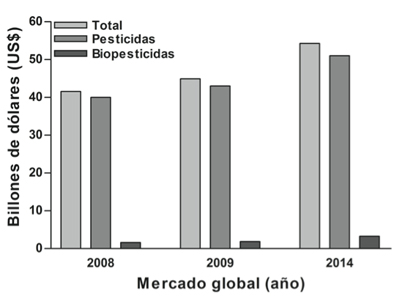
Figura 2. Comportamiento de las ventas globales de productos pesticidas para los años 2008 y 2009, así como su proyección para 2014, generada a partir de la información de LEHR, 2010.
Toxinas insecticidas del veneno de arácnidos
Los canales iónicos dependientes de voltaje permiten el paso de iones como el Ca2+, K+ y Na+ se encuentran en todos los organismos, desde los invertebrados hasta los mamíferos, y desempeñan un papel muy importante en los procesos celulares. Algunos de los componentes del veneno de los alacranes y las arañas actúan sobre estos canales iónicos dependientes de voltaje, como los de calcio (Cav), potasio (Kv) y sodio (Nav). Estos canales se encuentran en las membranas excitables de las células del sistema nervioso de diversos organismos como insectos, peces, anfibios, reptiles, aves y mamíferos, y su interacción afecta su estado fisiológico y puede causarles la muerte (DONG, 2007). Sin embargo, dentro de este grupo de proteínas, algunas presentan selectividad exclusiva sobre canales iónicos de insecto, por lo que se han propuesto como alternativas para el control de insectos plaga en la agricultura y de vectores de enfermedades en lo referente a la salud.Dentro de los canales iónicos de insecto, los canales de sodio (NaV) han sido utilizados ampliamente para su control, debido a su actividad central en la excitabilidad regulando una gran variedad de procesos fisiológicos, principalmente en las células nerviosas y musculares de estos organismos,
 | ...debido a la gran similitud de los canales en el reino Animalia, la mayoría de los insecticidas no distinguen entre insectos o mamíferos, generando un alto riesgo de intoxicación para mamíferos, incluyendo, por supuesto, a los humanos. | |
 | ||
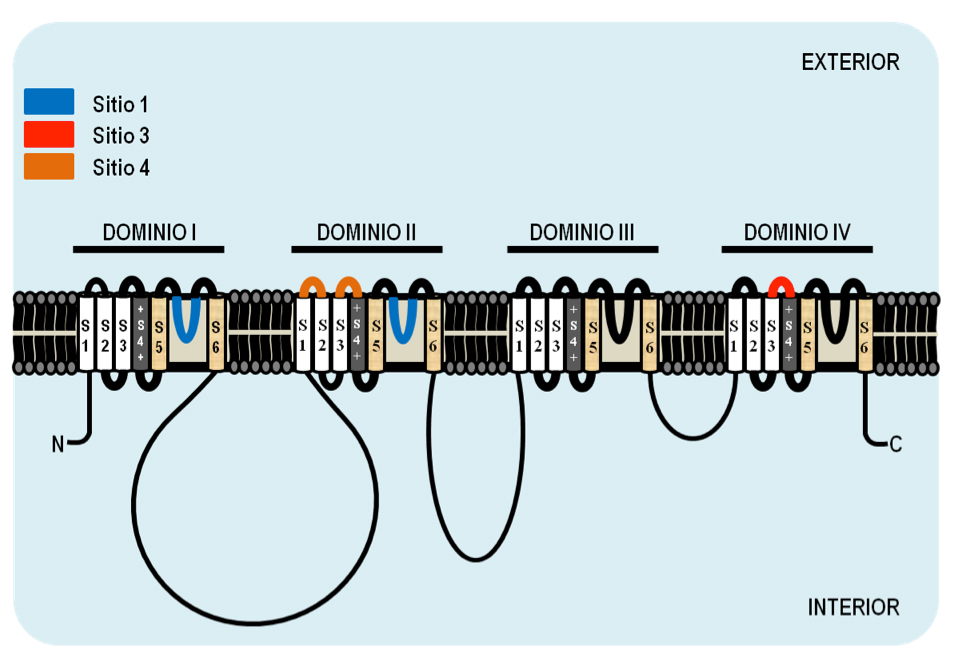
Figura 3. Representación esquemática de la organización de la subunidad alfa transmembranal del canal de sodio dependiente de voltaje. La subunidad alfa consiste de cuatro dominios homólogos, cada uno con seis segmentos transmembranales (S1-S6). Los que están cargados positivamente (+) corresponden a los sensores de voltaje. Los sitios 1 (azul), 3 (rojo) y 4 (naranja), son blancos de la actividad de las toxinas insecticidas de alacranes y arañas. Generada a partir de la información de CATTERALL, 2000.
Las toxinas aisladas del veneno de alacranes han sido ampliamente estudiadas y se clasifican en grupos de acuerdo con su acción específica sobre los canales iónicos anteriormente mencionados. Las toxinas que actúan sobre canales de Nav son divididas en α y β toxinas. De manera general, la longitud de su secuencia va de los 61-76 aminoácidos y presentan un peso molecular de 7-8 KDa. En ambos grupos pueden encontrarse representantes de toxinas insecto-específicas. La estructura tridimensional de ambos grupos de toxinas se comprende de un segmento alfa-helicoidal y tres segmentos de hebras beta antiparalelas, estabilizados por cuatro puentes disulfuro. A pesar de su similitud estructural, los sitios de interacción con el canal y sus efectos son diferentes entre sí (GORDON et al, 1998). Las α-toxinas de alacrán (Figura 4A y 4B) presentan al sitio 3 de la subunidad alfa del canal NaV como blanco de su actividad, al unirse al canal estas toxinas impiden su desactivación ocasionando un bloqueo en la transmisión de las señales neuronales y finalmente la muerte del insecto (KARBAT et al, 2004). Mientras que las β-toxinas de alacrán (Figura 4C y 4D) tienen como blanco el sitio 4 del canal Nav generando dos grupos de acuerdo con sus efectos, el primero genera un cambio en el voltaje de activación a potenciales más negativos afectando la activación del canal Nav y generando una parálisis rígida, mientras que el segundo grupo produce un efecto depresivo, generando parálisis con contracciones intermitentes y parálisis flácida (GUREVITZ et al, 2007). En la tabla 1 se enumeran ejemplos de toxinas del veneno de alacrán ordenadas de acuerdo con su sitio de interacción en el canal de Nav.
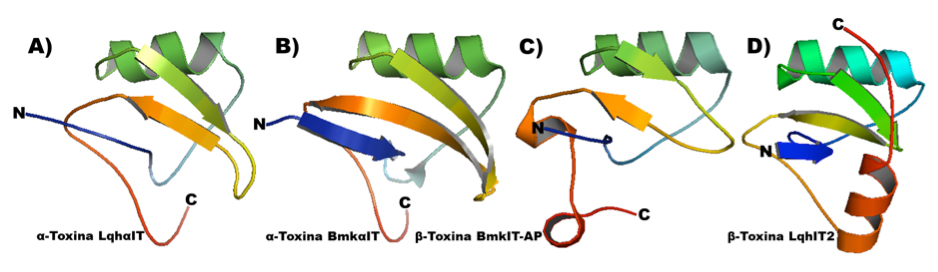
Figura 4. Ejemplos de estructuras de toxinas de alacrán. A. Alfa toxina insecto especifica LqhαIT (TUGARINOV et al, 1997), B. Alfa toxina insecto específica BmkαIT (HUANG et al, 2003), C. Beta toxina insecto especifica BmkIT-AP (LI et al, 2004), D. Beta toxina insecto especifica LqhIT2 (KARBAT et al, 2007).
Por su parte, de manera homóloga se encuentran las toxinas aisladas de venenos de araña que interactúan con el Nav. De manera general, la estructura tridimensional de las toxinas de Nav del veneno de araña presenta una conformación denominada nudo inhibidor de cisteínas (ICK, por sus siglas en inglés), que les brinda gran estabilidad biológica. Este motivo estructural está constituido por tres hebras beta antiparalelas estabilizadas por tres o cuatro puentes disulfuro (NORTON y PALLAGHY, 1998). En la figura 5 se esquematiza el motivo estructural ICK y tres ejemplos de toxinas insecticidas de araña.
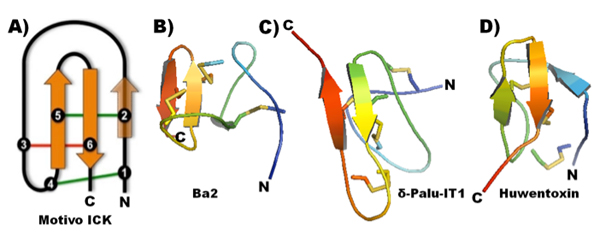
Figura 5. Ejemplos de estructuras de toxinas de araña. A. representación del motivo ICK (SAEZ et al, 2010), B. Ba2 (CORZO et al, 2009), C. δ-Palu-IT1 (FERRAT et al, 2005), D. Huwentoxin (QU et al, 1997).
El canal de Nav presenta 4 sitios de interacción para toxinas, de los cuales las toxinas de araña pueden interaccionar con tres, sitio 1, 3 y 4 (Figura 3). Dentro de las que interactúan con el sitio 1 del canal de Nav destacan las hainantoxinas de la araña Ornithoctonus hainana, las cuales generan un efecto de bloqueo en el canal (XIAO y LIANG, 2003). Entre las toxinas de araña que interactúan con el sitio 3 destacan Magi 1 y Magi 2 de la araña Macrothele gigas, éstas inducen parálisis flácida cuando son inyectadas en larvas de lepidópteros (CORZO et al, 2003). Finalmente, dentro de las toxinas que interactúan con el sitio 4 destacan las palutoxinas de la araña Paracoelotes luctuosus y las µ-agatoxinas de la araña Agelenopsis aperta, las cuales producen un efecto de inhibición en la inactivación del canal de Nav (SKINNER et al, 1989). En la tabla 1 se enumeran ejemplos de toxinas del veneno de araña ordenadas de acuerdo con su sitio de interacción en el canal de Nav. En nuestro grupo de investigación se han caracterizado toxinas provenientes del veneno de arácnidos ricas en puentes disulfuro con actividad selectiva para canales de Nav de insecto, como Magi 1, Magi 2 y Magi 5, las palutoxinas 1-4 y la toxina Ba1 y Ba2. Sus características las hacen atractivas para su uso potencial como bioinsecticidas.
Tabla 1. Toxinas insecticidas de alacranes y arañas que afectan el canal Nav, agrupadas de acuerdo con su sitio de interacción.
La resistencia bacteriana a los antibióticos
La disponibilidad de los antibióticos en la actualidad permite el tratamiento de infecciones bacterianas agudas y la contención de enfermedades crónicas, como el cáncer y la diabetes; | La disponibilidad de los antibióticos en la actualidad permite el tratamiento de infecciones bacterianas agudas y la contención de enfermedades crónicas, como el cáncer y la diabetes; permiten, de igual manera, la posibilidad de realizar procedimientos médicos invasivos, como las cirugías. | |
 | ||
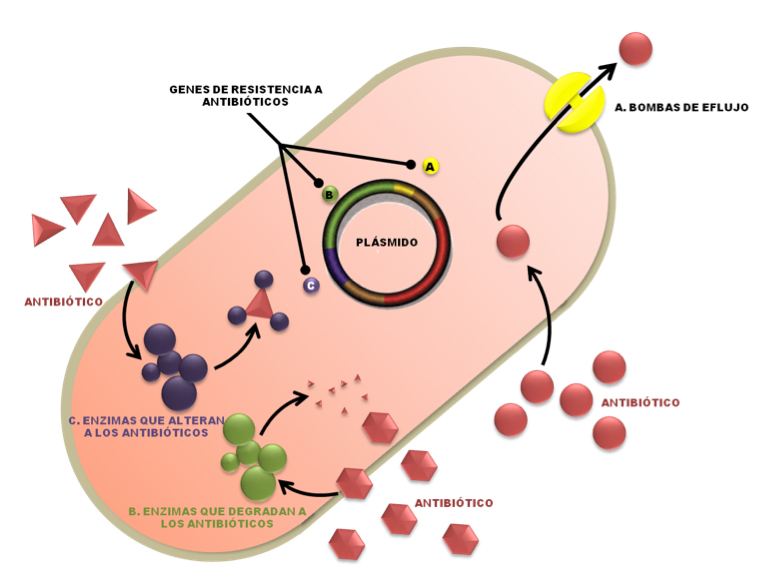
Figura 6. Principales mecanismos de resistencia bacteriana a los antibióticos. Generada a partir de la información de WRIGHT, 2011.
Los efectos clínicos, sociales y económicos relacionados con este problema se reflejan principalmente en incrementos en la mortalidad, aumento en los tiempos de hospitalización y acrecentamientos en los costos de los medicamentos utilizados para su control (FRENCH, 2005). Dentro de los principales microorganismos de interés médico que presentan resistencia a antibióticos se encuentran los siguientes: Staphylococcus aureus con resistencia a Metacilina (MRSA) o a múltiples antibióticos, enterococos con resistencia a Vancomicina (VRE), neumococos resistentes a Penicilina, bacilos Gram-negativos como Escherichia coli, Pseudomonas aeruginosa, Klebsiella sp., y Enterobacter sp., con multirresistencias a antibióticos. La constante aparición de cepas bacterianas con resistencia a antibióticos ha motivado la búsqueda de agentes antibióticos con propiedades o mecanismos de acción diferentes a los convencionales, entre los cuales podemos encontrar como candidatos a los péptidos antibióticos o antimicrobianos provenientes de diferentes fuentes. Estos péptidos pertenecen a los mecanismos de defensa contra bacterias patógenas en insectos, arácnidos, anfibios y mamíferos y su potencial radica en que se han registrado muy pocos eventos de resistencia a su acción, por lo que se les ha propuesto como alternativas para el tratamiento de infecciones ocasionadas por bacterias con resistencias al efecto de múltiples antibióticos comerciales.
Péptidos antibióticos
Los péptidos antibióticos que se hallan ampliamente distribuidos en la naturaleza han sido encontrados en organismos como plantas, insectos, arácnidos, anfibios y mamíferos (ZASLOFF, 2002). Esta moléculas comprenden el principal mecanismo de defensa contra infecciones bacterianas en insectos y anfibios, mientras que en mamíferos son componentes del sistema de inmunidad innata, además de presentar actividades accesorias como la quimiotaxis 1, actividad que sirve de enlace con el sistema inmune adaptativo, y la angiogénesis 2, esencial para la cicatrización de los tejidos (OPPENHEIM et al, 2003). Debido a su amplia distribución a través de los organismos, los péptidos antibióticos han generado una gran diversidad en su estructura y espectro de actividad. En la figura 7A se muestran ejemplos de las estructuras de los péptidos antibióticos de alacranes y en la figura 7B ejemplos de los péptidos antibióticos de arañas.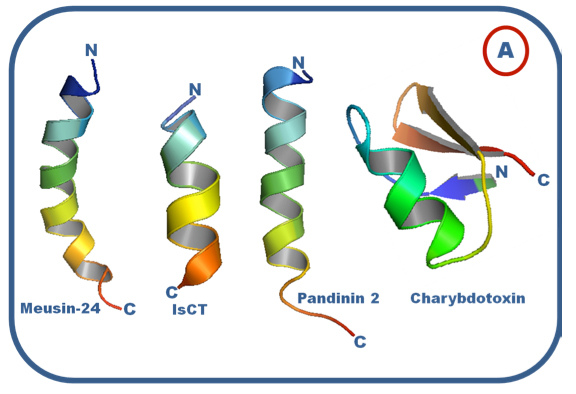
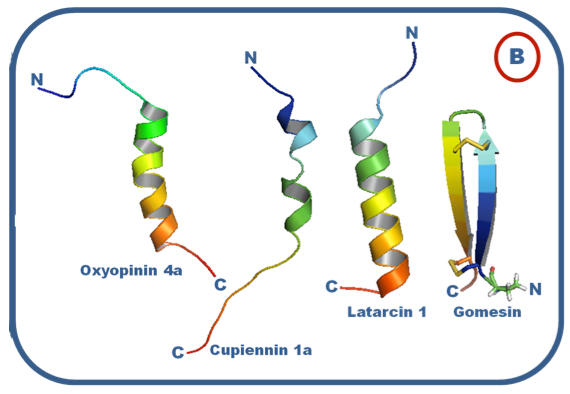
Figura 7. Ejemplos de estructuras de péptidos antibióticos. A. Péptidos antibióticos de alacrán, Meusin-24 (GAO et al, 2010), IsCT (LEE et al, 2004), Pandinin 2 (CORZO et al, 2001) y Charybdotoxin (BONTEMS et al, 1992). B. Péptidos antibióticos de araña, Oxyopinin 4a (DUBOVSKII et al, 2011), Cupiennin 1a (PUKALA, 2007), Latarcin 1 (DUBOVSKII et al, 2008), Gomesin (MANDARD, et al, 2002).
En la actualidad, existen reportados más de 5,000 tipos de péptidos antibióticos y se han caracterizado bioquímicamente más de 2,000 diferentes, tanto naturales como sintéticos (WANG et al, 2009). Estas moléculas son pequeñas, con un tamaño que puede variar entre los 12-50 aminoácidos (2-5 kDa), y generalmente se organizan en una estructura anfipática (JENSSEN et al, 2006). Sin importar su longitud y características estructurales, los péptidos antibióticos tienen dos características comunes: la primera, poseen una carga neta positiva a pH fisiológico de +2 a +9 debido a la presencia de aminoácidos básicos (Lisinas y Argininas) y la segunda, aproximadamente un 30-50% de los aminoácidos que los constituyen son hidrofóbicos, esto les permiten ser solubles en membranas lipídicas como las de las bacterias. Estas cualidades comunes otorgan a los péptidos antimicrobianos un amplio espectro de actividad, que incluye a diferentes tipos de virus encapsulados, microorganismos como bacterias Gram-positivas y Gram-negativas, levaduras, protozoarios y hongos. Además, se ha reportado su actividad citotóxica contra células cancerígenas, razón por la cual, en los últimos años, los péptidos antimicrobianos han sido propuestos como candidatos para el desarrollo de nuevos antibióticos.
Dentro de las ventajas propuestas del uso de los péptidos antimicrobianos como moléculas terapéuticas, destacan su amplio espectro de acción, la capacidad inmunoreguladora de algunos de ellos, su potencial angiogénico y antiinflamatorio, así como efecto potenciador o sinérgico con antibióticos comunes, facilitando su acceso al interior de las células bacterianas (GORDON et al, 2005). A la fecha, al menos 10 productos terapéuticos basados en péptidos antimicrobianos han sido sometidos para su aprobación por la FDA (American Food and Drug Administration), y sólo un par de ellos han sido aceptados para su comercialización (nicina y polimixina). Esto se debe a que en estas moléculas aún existen ciertas limitantes a vencer para lograr su aprobación como terapéuticos (FOX, 2013). Dentro de las principales limitaciones de los péptidos antimicrobianos se encuentran su posible toxicidad contra células eucariotas (humanas), su susceptibilidad a las proteasas bacterianas y el costo de su síntesis química, especialmente en péptidos de más de 20 aminoácidos (HANCOCK y SAHL, 2006; SEO et al, 2012).
 | La evaluación y caracterización de los péptidos antimicrobianos ha puesto de manifiesto su potencial como terapéuticos, especialmente para el control de bacterias resistentes a los antibióticos, no obstante, para lograr su introducción al mercado farmacéutico, es necesario mejorar algunas de sus características, como su estabilidad, selectividad y costo de producción. | |
 | ||
1La quimiotaxis es un de fenómeno en el cual las bacterias y otras células de organismos uni o multicelulares dirigen sus movimientos de acuerdo con la concentración de ciertas sustancias químicas en su medio ambiente, un ejemplo de quimiotaxismo se encuentran la respuesta de los leucocitos a las heridas.
2 La angiogénesis es un proceso fisiológico que consiste en la formación de vasos sanguíneos nuevos a partir de los vasos preexistentes, es un fenómeno normal durante el desarrollo embrionario, el crecimiento del organismo y en la cicatrización de las heridas.
Mecanismo de acción de los péptidos antimicrobianos
Las superficies de las membranas bacterianas se encuentran cargadas negativamente por la presencia de fosfolípidos como el fosfatidilglicerol, la cardiolipina o la fosfatidilserina, que presentan una carga neta negativa. Se ha propuesto que las regiones catiónicas de los péptidos antimicrobianos interaccionan con los fosfolípidos de la membrana, mientras que sus regiones hidrofóbicas se insertan en el interior hidrofóbico, ensamblándose en diferentes poros multiméricos que causan la lisis celular (YEAMAN y YOUNT, 2003). El mecanismo molecular por el cual los péptidos antimicrobianos se permeabilizan a través de las membranas provocando su disrupción es dependiente de parámetros como la secuencia de aminoácidos, su carga neta y la concentración del péptido. Como se mencionó anteriormente, el objetivo principal de la actividad de los péptidos antimicrobianos es la membrana celular de las bacterias (proceso disruptivo), sin embargo, los péptidos antimicrobianos pueden difundirse al espacio intracelular e interferir con procesos esenciales para la maquinaria celular bacteriana, tales como la síntesis y plegado de proteínas, así como la replicación del ADN y el ARN, proceso no disruptivo (NICOLAS, 2009). En la figura 8 se esquematiza el mecanismo general de acción de los péptidos antibióticos.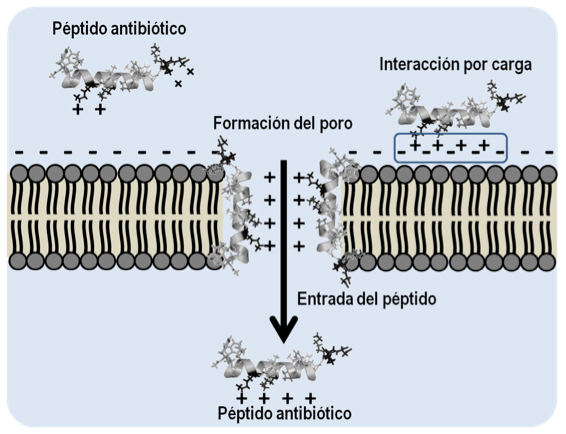
Figura 8. Mecanismo general de acción de los péptidos antibióticos sobre las membranas bacterianas. Generada a partir de la información de YEAMAN y YOUNT, 2003.
Péptidos antimicrobianos en el veneno de arácnidos
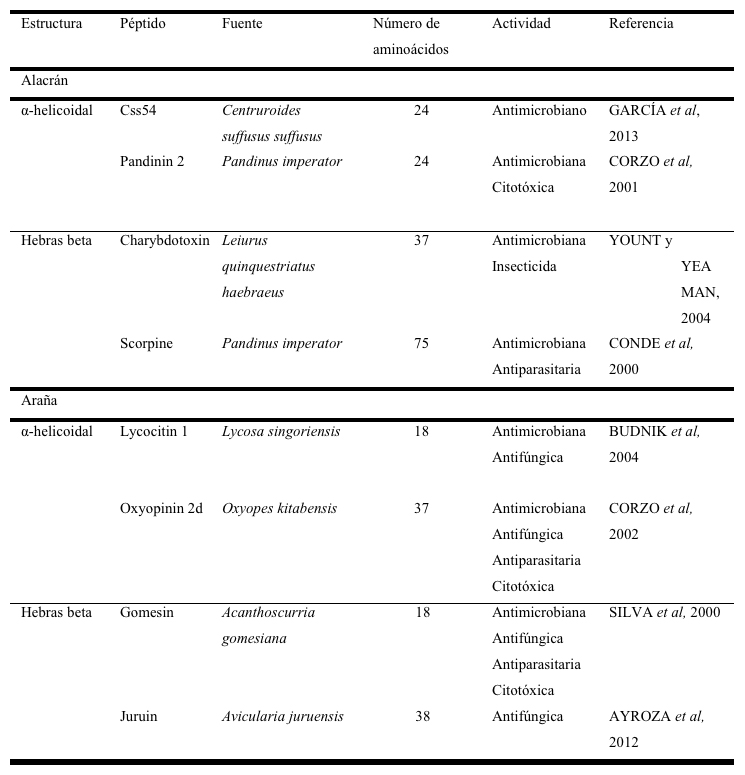
En la tabla 2 se reportan los nombres y algunas propiedades de los péptidos antibióticos de alacranes y arañas. La mayoría de estos péptidos poseen estructuras alfa helicoidales, sin embargo, también se han reportado péptidos con estructura beta-plegada, como las defensinas de Androctonus australis y Leiurus quinquestriatus, entre otros péptidos como la Androctina, la Buthinina y las Opiscorpinas (COCIANCICH et al, 1993; EHRET-SABATIER et al, 1996; MANDARD et al, 1999; ZHU et al, 2004). En nuestro grupo de investigación se ha abordado el estudio, caracterización y diseño de péptidos antimicrobianos provenientes de alacranes, como las pandininas 1 y 2 de Pandinus imperator (CORZO et al, 2001) y el péptido Css54 de Centruroides suffusus suffusus (GARCIA et al, 2013).La Pandinina 2 ha sido modificada en su secuencia con el objetivo de mejorar sus características terapéuticas (RODRIGUEZ et al, 2011), sintetizada con D-aminoácidos (CARMONA et al, 2013) y, recientemente, la longitud de su secuencia fue reducida para disminuir su costo de producción (RODRIGUEZ et al, 2014). Por su parte, el péptido Css54 ha sido evaluado como combinación con antibióticos comerciales. Estos péptidos presentan potencial como agentes antimicrobianos contra bacterias patógenas, inclusive con resistencia a la acción de los antibióticos. Dentro de este grupo destacan las licotoxinas de la araña Lycosa carolinensis, las cupieninas de Cupiennius salei, las licocitinas de Lycosa singoriensis y las latarcinas de Lachesana tarabaevi. Todos los péptidos antimicrobianos del veneno de arañas pueden inhibir el crecimiento de bacterias Gram-positivas, Gran-negativas y levaduras a concentraciones en el rango micromolar (ESTRADA et al, 2007). En nuestro grupo de investigación se ha abordado el estudio de péptidos antimicrobianos provenientes del veneno de arañas, reportando la purificación y caracterización de las Oxyopinina 1 y las Oxyopininas 2a, 2b, 2c y 2d del veneno de Oxyopes takiobus (CORZO et al, 2002).
Tabla 2. Péptidos antibióticos de alacranes y arañas clasificados de acuerdo con su estructura secundaria.
Conclusiones
Los venenos de alacranes y arañas contienen una gran diversidad de moléculas de interés científico, ya que se pueden usar como prototipos para la elaboración de novedosos bioinsecticidas que ayuden en el control de plagas en cultivos de manera general o específica. Es posible, también, emplearlos como modelos en la elaboración de medicamentos, en este caso, antibióticos con un modo de acción bactericida diferente a los antibióticos que usamos actualmente y de manera que su operación sea sinérgica con ellos y les permita ejercer su efecto bactericida de manera eficiente a menores concentraciones. Ahora, nosotros, como manipuladores del ambiente químico-biológico, debemos recurrir a lo que la naturaleza ha creado tiempo atrás para contender con los desequilibrios ambientales que hemos introducido como parte de nuestra forma de vida."Agradecimientos a SEP-CONACyT 153606 y a DGAPA IN200412."
Bibliografía
ANAYA-LÓPEZ, J.L., et al. "Bacterial resistance to cationic antimicrobial peptides!" Critical reviews in microbiology, 2013, 39, p. 180-195.
ARNON, T., et al. "BjαIT: a novel scorpion α-toxin selective for insects-unique pharmacological tool". Insect biochemistry and molecular biology, 2005, 35, p. 187-195.
AYROZA, G., et al. "Juruin: an antifungal peptide from the venom of the Amazonian Pink Toe spider, Avicularia juruensis, which contains the inhibitory cystine knot motif". Frontiers in microbiology, 2012, 3. p. 324.
BAILEY, P., Wilce, J. "Venom as a source of useful biologically active molecules". Emergency Medicine, 2001, 13, p. 28-36.
BONTEMS, F., et al. "Analysis of side-chain organization on a refined model of charybdotoxin: structural and functional implications". Biochemistry, 1992, 31, p. 7756-7764.
BUDNIK, B.A., et al. "De novo sequencing of antimicrobial peptides isolated from the venom glands of the wolf spider Lycosa singoriensis". Journal of mass spectrometry, 2004, 39, p. 193-201.
CARMONA, G., et al. "Improved Protease Stability of the Antimicrobial Peptide Pin2 Substituted with D-Amino Acids". The protein journal, 2013, 32, p. 456-466.
CATTERALL, W.A. "From ionic currents to molecular mechanisms: the structure and function of voltage-gated sodium channels". Neuron, 2000, 26, p. 13-25.
COCIANCICH, S., et al. "Purification and characterization of a scorpion defensin, a 4kDa antibacterial peptide presenting structural similarities with insect defensins and scorpion toxins". Biochemical and biophysical research communications, 1993, 194, p. 17-22.
CONABIO. "Biodiversidad Mexicana: Arácnidos". 2009. [en línea]: http://www.biodiversidad.gob.mx/especies/gran_familia/animales/aracnidos/aracnidos.html.
CONDE, R., et al. "Scorpine, an anti-malaria and anti-bacterial agent purified from scorpion venom". FEBS letters, 2000, 471, p. 165-168.
CORZO, G., et al. "Characterization of unique amphipathic antimicrobial peptides from venom of the scorpion Pandinus imperator". Biochemical journal, 2001, 359, p. 35-45.
CORZO, G., et al. "Distinct primary structures of the major peptide toxins from the venom of the spider Macrothele gigas that bind to sites 3 and 4 in the sodium channel". FEBS letters, 2003, 547, p. 43-50.
CORZO, G., et al. "Insecticidal peptides from the theraposid spider Brachypelma albiceps: An NMR-based model of Ba2". Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2009, 1794, p. 1190-1196.
CORZO, G., et al. "Isolation, synthesis and pharmacological characterization of delta-palutoxins IT, novel insecticide toxins from the spider Paracoelotes luctuosus (Amaurobiidae)". European Journal of Biochemistry, 2000, 18, p.5783-5795.
CORZO, G., et al. "Oxyopinins, large amphipathic peptides isolated from the venom of the wolf spider Oxyopes kitabensis with cytolytic properties and positive insecticidal cooperativity with spider neurotoxins". Journal of Biological Chemistry, 2002, 277, p. 23627-23637.
DARBON, H., et al. "Covalent structure of the insect toxin of the North African scorpion Androctonus australis Hector". International journal of peptide and protein research, 1982, 20, p. 320-330.
DAVIES, J., Davies, D. "Origins and evolution of antibiotic resistance". Microbiology and Molecular Biology Reviews, 2010, 74, p. 417-433.
DONG, K. "Insect sodium channels and insecticide resistance". Invertebrate Neuroscience, 2007, 7, p. 17-30.
DUBOVSKII, P.V., et al. "Novel lynx spider toxin shares common molecular architecture with defense peptides from frog skin". FEBS Journal, 2011, 278, p. 4382-4393.
DUBOVSKII, P.V., et al. "Three-dimensional structure/hydrophobicity of latarcins specifies their mode of membrane activity". Biochemistry, 2008, 47, p. 3525-3533.
EHRET-SABATIER, L., et al. "Characterization of novel cysteine-rich antimicrobial peptides from scorpion blood". Journal of Biological Chemistry, 1996, 271, p. 29537-29544.
EITAN, M., et al. "A scorpion venom neurotoxin paralytic to insects that affects sodium current inactivation: purification, primary structure, and mode of action". Biochemistry, 1990, 29, p. 5941-5947.
ESTRADA, G., et al. "Spider venoms: a rich source of acylpolyamines and peptides as new leads for CNS drugs". Natural Products Reports, 2007, 24, p. 145-161.
FENG, G., et al. "Cloning and functional analysis of tipE, a novel membrane protein that enhances drosophila para sodium channel function". Cell, 1995, 82, p. 1001-1011.
FERRAT, G., et al. "Solution structure of two insect‐specific spider toxins and their pharmacological interaction with the insect voltage‐gated Na+ channel". Proteins: Structure, Function, and Bioinformatics, 2005, 59, p. 368-379.
FOX, J.L. (2013). "Antimicrobial peptides stage a comeback". Nature biotechnology, 2013, 31, p. 379-382.
FRANCKE, O.F. "Biodiversidad de Arthropoda (Chelicerata: Arachnida ex Acari) en México". Revista Mexicana de Biodiversidad, 2014, 85, p. S408-S418.
FRENCH, G.L. "Clinical impact and relevance of antibiotic resistance". Advanced drug delivery reviews, 2005, 57, p. 1514-1527.
FRY, B.G., et al. "Early evolution of the venom system in lizards and snakes". Nature, 2006, 439, p. 584-588.
GAO, B., et al. "Characterization of two linear cationic antimalarial peptides in the scorpion Mesobuthus eupeus". Biochimie, 2010, 92, p. 350-359.
GARCIA, F., et al. "Antimicrobial peptides from arachnid venoms and their microbicidal activity in the presence of commercial antibiotics". The Journal of antibiotics, 2013, 66, p. 3-10.
GAVRILESCU, M. "Fate of pesticides in the environment and its bioremediation". Engineering in Life Sciences, 2005, 5, p. 497-526.
GORDON, D., et al. "Functional anatomy of scorpion toxins affecting sodium channels". Toxin Reviews, 1998, 17, p. 131-159.
GORDON, D., et al. "The differential preference of scorpion α-toxins for insect or mammalian sodium channels: Implications for improved insect control". Toxicon, 2007, 49, p. 452-472.
GORDON, Y.J., et al. "A review of antimicrobial peptides and their therapeutic potential as anti-infective drugs." Current eye research, 2005, 30, p. 505-515.
GRAHAM, J.P., et al. "Growth promoting antibiotics in food animal production: an economic analysis". Public health reports, 2007, 122, p. 79-87.
GRIMALDI, D., Engel, M.S. Evolution of the Insects. New York: Cambridge University Press, primera edición, 2005.
GUREVITZ, M., et al. "The insecticidal potential of scorpion β-toxins". Toxicon, 2007, 49, p. 473-489.
HANCOCK, R.E., Sahl, H.G. (2006). "Antimicrobial and host-defense peptides as new anti-infective therapeutic strategies". Nature biotechnology, 2006, 24, p. 1551-1557.
HAWKEY, P.M. "The origins and molecular basis of antibiotic resistance". Bmj, 1998, 317, p. 657-660.
HUANG, Y., et al. "Crystallization and preliminary crystallographic study of rBmKIT1, a recombinant-insect toxin from the scorpion Buthus martensii Karsch". Acta Crystallographica Section D: Biological Crystallography, 2003, vol. 59, 9, p. 1635-1636.
JENSSEN, H., et al. "Peptide antimicrobial agents". Clinical microbiology reviews, 2006, 19, p. 491-511.
JONGEJAN, F., Uilenberg, G. "The global importance of ticks". Parasitology, 2004, 129, p. S3-S14.
KARBAT, I., et al. "Molecular basis of the high insecticidal potency of scorpion α-toxins". Journal of Biological Chemistry, 2004, 279, p. 31679-31686.
KARBAT, I., et al. X-ray structure and mutagenesis of the scorpion depressant toxin LqhIT2 reveals key determinants crucial for activity and anti-insect selectivity. Journal of molecular biology, 2007, 366, p. 586-601.
KOPRIVNJAK, T., Peschel, A. "Bacterial resistance mechanisms against host defense peptides". Cellular and Molecular Life Sciences, 2011, 68, p. 2243-2254.
LEE, K., et al. "Antibiotic activity and structural analysis of the scorpion-derived antimicrobial peptide IsCT and its analogs". Biochemical and biophysical research communications, 2004, 323, p. 712-719.
LEHR, P. Biopesticides: The Global Market; BCC Research: Wellesley, MA, USA, 2010; pp. 160.
LI, C., et al. "Structure of an excitatory insect-specific toxin with an analgesic effect on mammals from the scorpion Buthus martensii Karsch". Acta Crystallographica Section D: Biological Crystallography, 2004, 61, p. 14-21.
LI, D., et al. "Function and solution structure of hainantoxin-I, a novel insect sodium channel inhibitor from the Chinese bird spider Selenocosmia hainana". FEBS letters, 2003, 555, p. 616-622.
MANDARD, N., et al. "Androctonin, a novel antimicrobial peptide from scorpion Androctonus australis: solution structure and molecular dynamics simulations in the presence of a lipid monolayer". Journal of Biomolecular Structure and Dynamics, 1999, 17, p. 367-380.
MANDARD, N., et al. "The solution structure of gomesin, an antimicrobial cysteine‐rich peptide from the spider". European Journal of Biochemistry, 2002, 269, p. 1190-1198.
MATAVEL, A., et al. "Electrophysiological characterization and molecular identification of the Phoneutria nigriventer peptide toxin PnTx2-6". FEBS letters, 2002, 523, p. 219-223.
PENG, K., et al. "Function and solution structure of huwentoxin-IV, a potent neuronal tetrodotoxin (TTX)-sensitive sodium channel antagonist from Chinese bird spider Selenocosmia huwena". Journal of Biological Chemistry, 2002, 277, p. 47564-47571.
NICOLAS, P. "Multifunctional host defense peptides: intracellular‐targeting antimicrobial peptides". FEBS journal, 2009, 276, p. 6483-6496.
NISBET, A.J., Huntley, J.F. "Progress and opportunities in the development of vaccines against mites, fleas and myiasis‐causing flies of veterinary importance". Parasite immunology, 2006, 28, p. 165-172.
NORTON, R.S.; Pallaghy, P.K. "The cystine knot structure of ion channel toxins and related polypeptides". Toxicon, 1998, 36, p. 1573-1583.
NOVOTNY, V., Basset, Y. "Host specificity of insect herbivores in tropical forests". Proceedings of the Royal Society B: Biological Sciences, 2005, 272, p. 1083-1090.
OERKE, E.C.; Dehne, H.W. "Safeguarding production-losses in major crops and the role of crop protection". Crop Protection, 2004, 23, p. 275-285.
OMAR, H.E.D.M. "The biological and medical significance of poisonous animals". Journal of Biology and Earth Sciences, 2013, 3, p. M25-M41.
OPPENHEIM, J.J., et al. "Roles of antimicrobial peptides such as defensins in innate and adaptive immunity". Annals of the rheumatic diseases, 2003, 62, p. ii17-ii21.
PARRA-HENAO, G. "Sistemas de información geográfica y sensores remotos. Aplicaciones en enfermedades transmitidas por vectores". CES Medicina, 2010, 24, p. 75-89.
PEAT, J.K., et al. "House dust mite allergens. A major risk factor for childhood asthma in Australia". American journal of respiratory and critical care medicine, 1996,153, p. 141-146.
POSSANI, L.D., Rodríguez de la Vega, R. C. "Scorpion venom peptides". In Kastin A. J. (Ed). The Handbook of Biologically Active Peptides, Burlington: Academic press, 2006, pp. 339-354.
PUKALA, T.L., et al. "Solution structure and interaction of cupiennin 1a, a spider venom peptide, with phospholipid bilayers". Biochemistry, 2007, 46, p. 3576-3585.
QU, Y., et al. "Proton nuclear magnetic resonance studies on huwentoxin-I from the venom of the spider Selenocosmia huwena: 2. Three-dimensional structure in solution". Journal of protein chemistry, 1997, 16, p. 565-574.
QUISTAD, G.B., et al. "Insecticidal activity of spider (Araneae), centipede (Chilopoda), scorpion (Scorpionida), and snake (Serpentes) venoms". Journal of economic entomology, 1992, 85, p. 33-39.
RODRÍGUEZ, A., et al. "Amino acid substitutions in an alpha-helical antimicrobial arachnid peptide affect its chemical properties and biological activity towards pathogenic bacteria but improves its therapeutic index". Amino acids, 2011, 40, p. 61-68.
RODRÍGUEZ, A., et al. "Characterization of Antibacterial and Hemolytic Activity of Synthetic Pandinin 2 Variants and Their Inhibition against Mycobacterium tuberculosis". PloS one, 2014, 9, p. e101742.
SAEZ, N.J., et al. "Spider-venom peptides as therapeutics". Toxins, 2010, 2, p. 2851-2871.
SCUDDER, G.G.E. "The importance of insects". In Foottit, R.G., Peter H. Adler, P.H. (Eds.), Insect Biodiversity: Science and Society, Chichester: John Wiley & Sons, 2009, pp. 7-32.
SEO, M.D., et al. "Antimicrobial peptides for therapeutic applications: a review". Molecules, 2012, 17, p. 12276-12286.
SILVA, P.I., et al. "Isolation and characterization of gomesin, an 18-residue cysteine-rich defense peptide from the spider Acanthoscurria gomesiana hemocytes with sequence similarities to horseshoe crab antimicrobial peptides of the tachyplesin family. Journal of Biological Chemistry, 2000, 275, p. 33464-33470.
SKINNER, W.S., et al. "Purification and characterization of two classes of neurotoxins from the funnel web spider, Agelenopsis aperta". Journal of Biological Chemistry, 1989, 264, p. 2150-2155.
TÉLLEZ, G.A., Castaño, J.C. "Péptidos antimicrobianos". Infectio, 2010, 14, p. 55-67.
TUGARINOV, V., et al. "Solution structures of a highly insecticidal recombinant scorpion α-toxin and a mutant with increased activity". Biochemistry, 1997, 36, p. 2414-2424.
WANG, G., Wang, L.X. "The APD2: the updated antimicrobial peptide database and its application in peptide design". Nucleic acids research, 2009, 37, p. D933-D937.
WINDLEY, M.J., et al. "Spider-venom peptides as bioinsecticides". Toxins, 2012, 4, p. 191-227.
WRIGHT, G.D. "Molecular mechanisms of antibiotic resistance". Chemical Communications, 2011, 47, p. 4055-4061.
XIAO, Y,C., Liang, S.P. "Inhibition of neuronal tetrodotoxin-sensitive Na+ channels by two spider toxins: hainantoxin-III and hainantoxin-IV". European journal of pharmacology, 2003, 477, p. 1-7.
XIONG, Y.M., et al. "Molecular characterization of a new excitatory insect neurotoxin with an analgesic effect on mice from the scorpion Buthus martensi Karsch". Toxicon, 1999, 37, p. 1165-1180.
YEAMAN, M.R., Yount, N.Y. "Mechanisms of antimicrobial peptide action and resistance". Pharmacological reviews, 2003, 55, p. 27-55.
YOUNT, N.Y., Yeaman, M.R. "Multidimensional signatures in antimicrobial peptides". Proceedings of the National Academy of Sciences of the United States of America, 2004, 101, p. 7363-7368.
ZASLOFF, M. "Antimicrobial peptides of multicellular organisms". Nature, 2002, 415, p. 389-395.
ZENG, X.C., et al. "Scorpion venom peptides without disulfide bridges". IUBMB life, 2005, 57, p. 13-21.
ZHU, S., Tytgat, J. "The scorpine family of defensins: gene structure, alternative polyadenylation and fold recognition". Cellular and Molecular Life Sciences, 2004, 61, p. 1751-1763
COMENTARIOS
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
2013 Esta obra está bajo una licencia de Creative Commons 















