

Revista Digital Universitaria ISSN: 1607 - 6079 | Publicación mensual
1 de junio de 2014 vol.15, No.6
• TEMA DEL MES •
Medicina personalizada
Introducción
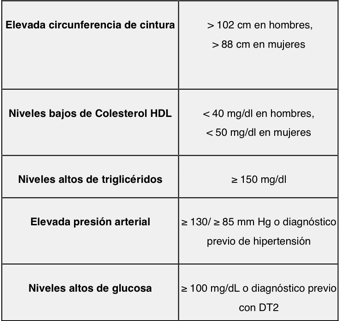
Tabla 1. Criterios clínicos para el diagnóstico de síndrome metabólico de acuerdo a la NCEP ATP III. Presencia de 3 o más de los componentes = Síndrome metabólico. Al igual que en todo el mundo, en México ha ocurrido una transición epidemiológica, con una disminución progresiva de las entidades infecciosas y parasitarias y un incremento de enfermedades crónicas-degenerativas. En especial, las enfermedades metabólicas (EMet) tales como: obesidad, diabetes y síndrome metabólico (tabla 1), se han convertido en un problema de salud pública y son consideradas la epidemia del siglo XXI, ya que aproximadamente más de la mitad de la población mundial las padece y son las principales causas de atención hospitalaria y de muerte. Por su frecuencia y ritmo acelerado en el crecimiento de su prevalencia, ésta es la primera vez que nuestro país se enfrenta a un proceso que compromete la esperanza de vida de futuras generaciones. De hecho, México es uno de los países con mayor prevalencia a nivel mundial de síndrome metabólico (SMet), con 36.8%; sobrepeso y obesidad, 71.3%; diabetes mellitus tipo 2 (DT2), 18%; e hipertensión arterial (HTA), 31.5% (Figura 1).
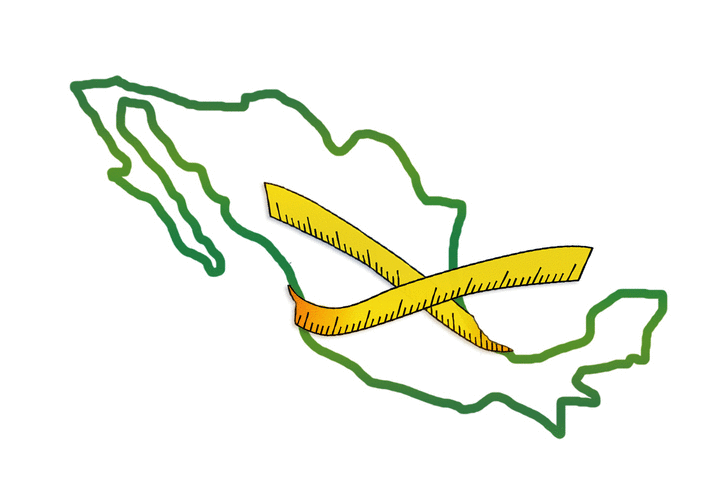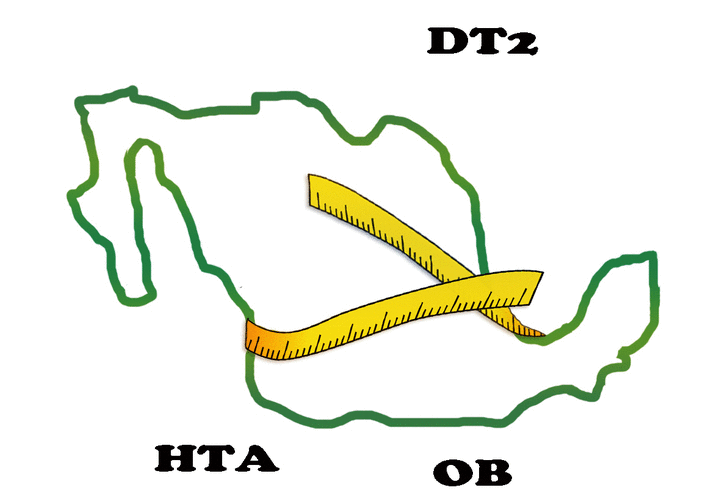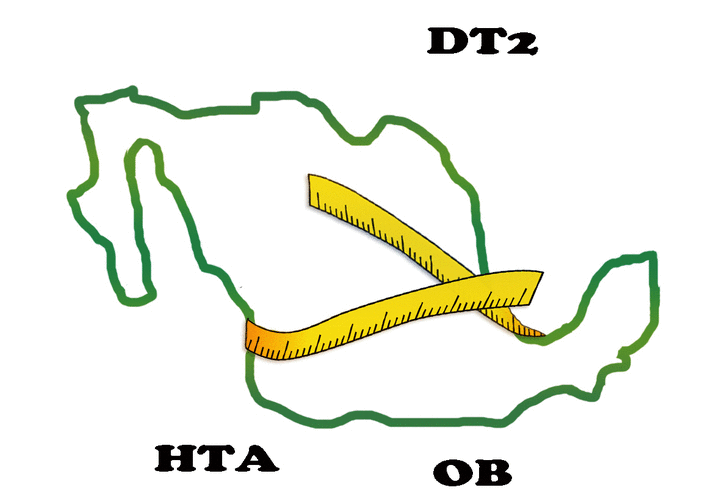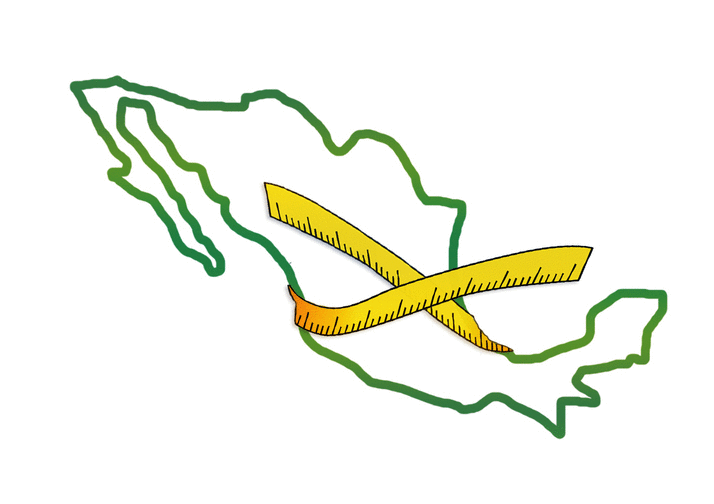
Figura 1. México en los primeros lugares en la prevalencia de EMet.
Los datos clínicos iniciales que podrían apoyar en el diagnóstico temprano de estos padecimientos son: poliuria (orinar frecuentemente), polidipsia (sed excesiva), polifagia (hambre constante), pérdida de peso, cefalea frecuente (dolor de cabeza), astenia (cansancio), dificultad para dormir, artralgias (dolores articulares), sudor excesivo, sensación constante de calor, resequedad e infecciones frecuentes en piel, disnea (falta el aire) y depresión. Sin embargo, uno de los principales problemas de las EMet es que en sus etapas iniciales son silenciosas, es decir, los síntomas pueden pasar desapercibidos y estas enfermedades son diagnosticadas tardíamente. El lapso que transcurre sin tratamiento entre la aparición de la enfermedad y el diagnóstico es de vital importancia, ya que las alteraciones metabólicas pueden generar daño irreversible en diferentes órganos y sistemas conduciendo a complicaciones como ceguera, insuficiencia renal, amputaciones de miembros, infartos al miocardio o cerebrales y un deterioro importante en la calidad y la esperanza de vida.

Figura 2. Obesidad como factor de riesgo para el desarrollo de hipertensión, diabetes e hipercolesterolemia. Dentro del gran espectro de las EMet, la obesidad (OB) es considerada como el factor de riesgo más importante para el desarrollo de HTA, hipercolesterolemia y DT2 (Figura 2); en el estudio prospectivo de Framingham se demostró que por cada 10% de incremento de peso, la presión arterial aumenta 6,5 mmHg, el colesterol plasmático 12 mg/dl y la glicemia 2 mg/dl, por lo que es importante entender todos los procesos fisiológicos, bioquímicos y conductuales que intervienen en el control del peso corporal. Actualmente las herramientas para el análisis amplio del genoma son altamente poderosas y han sido piedra angular para entender la complejidad de las rutas del metabolismo de carbohidratos y lípidos, así como de los procesos inflamatorios involucrados en EMet. En este artículo se consideran los aspectos genómicos más importantes en las EMet.
Genética de las EMet
La etiología de las EMet no se conoce con certeza, pero la agregación familiar y los estudios de gemelos han documentado que el componente genético juega un papel crucial en su desarrollo. Los estudios familiares que examinan la heredabilidad admiten que existe un reducido número de casos que presentan una forma de herencia monogénica (obesidad monogénica y diabetes tipo MODY). Sin embargo, en las formas comunes se requiere la interacción de factores genéticos (poligénicas) y ambientales para causar este tipo de padecimientos, los cuales claramente tienen una herencia de tipo multifactorial o compleja (Figura 3). El riesgo a padecer una EMet multifactorial es mayor en personas >45 años con antecedentes en familiares de primer grado. Por ejemplo, un individuo con un padre afectado con DT2 tiene un 30-40% más de riesgo para desarrollar la enfermedad, mientras que para aquel que tiene los dos padres afectados el riesgo se incrementa hasta el 70%.
Figura 3. Interacción medio ambiente-genética-epigenética en el desarrollo de las enfermedades metabólicas.
Entender la etiopatogenia de estos padecimientos es sumamente complicado y ésta se percibe cada vez más compleja a medida que se descubren las interacciones gen-gen y gen-ambiente. En aquellas poblaciones genéticamente heterogéneas como la mexicana, donde la gran mayoría de la población es mestiza (genes amerindios 56%, caucásicos 41% y africanos 3%), el entendimiento de las EMet es aún más complejo. Diversos estudios han mostrado que las poblaciones de origen africano y amerindio tienen las prevalencias más elevadas de EMet, como la diabetes. Esta aseveración se apoya en la hipótesis de un enriquecimiento de alelos “ahorradores de energía” en poblaciones que han padecido hambre y otras penurias. Así, es probable que los descendientes de poblaciones como la amerindia sean más eficientes en el uso y almacenamiento de nutrientes, pero en un ambiente de exceso calórico como el actual, esta característica puede ser parte fundamental del surgimiento de un problema de salud pública (Figura 4).

Figura 4. Exceso calórico y el surgimiento de un problema de salud pública.
Variantes alélicas asociadas a EMet

Figura 5. Síndrome metabólico y sus componentes. En los últimos años, en la búsqueda de los factores responsables de la susceptibilidad para desarrollar EMet se han identificado genes con un papel potencial (genes candidatos) en su etiopatogénesis y se sabe que algunos de estos genes presentan variantes alélicas (polimorfismos) que muestran asociación con la susceptibilidad, gravedad o respuesta al tratamiento de estas patologías. Varios polimorfismos asociados al riesgo en el desarrollo de las EMet están cercanos o en genes involucrados en la función del metabolismo, como en las vías de la insulina, leptina-melanocortina, termogénesis, etc. Existe evidencia de que alteraciones en la función de ciertos genes tienen efecto pleiotrópico al causar simultáneamente diferentes alteraciones funcionales en varias estirpes celulares, y que ésta podría ser una de las explicaciones de la presentación simultánea de diferentes EMet en un mismo individuo, como es el caso del síndrome metabólico (Figura 5).
Figura 6. Avance tecnológico en investigación genómica de las enfermedades metabólicas.
Actualmente, nuestra capacidad para dilucidar la base genética de la enfermedad continúa evolucionando gracias a los avances tecnológicos y a la capacidad de reunir grandes colecciones de muestras de pacientes (Figura 6), lo que ha permitido identificar más de un centenar de genes asociados con el riesgo de padecer EMet (Tabla 2). Además, con el advenimiento de las técnicas de secuenciación de nueva generación se han logrado identificar variantes raras o privativas en ciertas poblaciones. El Proyecto 1000 Genomas tiene la finalidad de generar un catálogo más amplio de las variaciones genéticas en los principales grupos étnicos del mundo y abre la oportunidad de comparar cientos de genotipos de personas enfermas con los de personas sanas, para identificar variantes genéticas de riesgo presentes en mayor abundancia en los enfermos, o bien, factores “protectores” presentes en mayor abundancia en las personas sanas. Este conocimiento está permitiendo profundizar en la biología de las enfermedades e identificar blancos terapéuticos para el tratamiento de muchas entidades como las metabólicas.
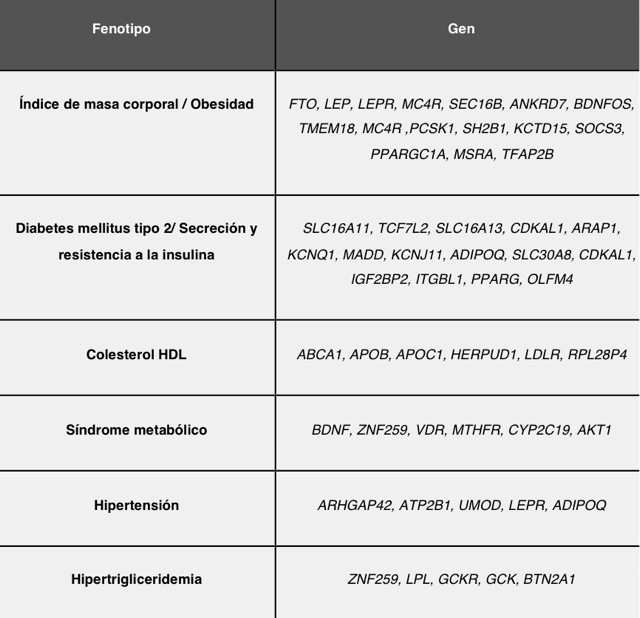
Tabla 1. Ejemplos de genes asociados a enfermedades metabólicas.
El primer gen de la era posgenómica asociado a OB fue el de masa grasa y obesidad (FTO), el cual está directamente implicado con problemas en el comportamiento alimenticio y la homeostasis de energía en la mayoría de las poblaciones (Figura 7). Aproximadamente el 16% de los caucásicos son homocigotos para el alelo de riesgo, los cuales muestran hiperfagia y pesan 3 Kg más que los que no heredaron los dos alelos de riesgo de sus padres. Existen evidencias de que el efecto principal de los alelos de riesgo de FTO es un incremento en la toma de energía y en la reducción de la saciedad. Por otra parte, se ha demostrado que la ausencia de genes como leptina (LEP) y su receptor (LEPR), causan obesidad mórbida en humanos y ratones. Estos genes juegan un papel fundamental en la regulación del peso corporal mediante la estimulación de la saciedad (efecto anorexigénico), la homeostasis de la glucosa y el balance energético. La leptina es una hormona producida y secretada por el tejido adiposo blanco y sus niveles circulantes están directamente relacionados con la adiposidad del individuo. Sin embargo, un exceso en la producción de leptina conlleva a la resistencia de su receptor, causando pérdida de la saciedad (efecto orexigénico) que condiciona hiperfagia compulsiva y poca utilización de la energía (Figura 8). En un gran número de poblaciones, incluyendo la mexicana, variantes en el gen LEP resultaron asociadas con OB y DT2. En población asiática un polimorfismo localizado entre los genes MIR129 -1 y LEP se asoció también con DT2, sugiriendo la presencia de un posible locus que pudiera haber estado bajo presión selectiva. Al igual que LEP, el gen del receptor 4 de melanocortina (MC4R) participa en la regulación del peso a través de la modulación en la ingesta del alimento y la utilización de la energía. Además, se ha observado que no sólo predispone a la obesidad común, sino que también causa obesidad monogénica.

Figura 7. El gen FTO y la obesidad.
En la DT2 se han reportado diversos genes implicados en la etiología de la enfermedad, en los que se incluyen aquellos que codifican principalmente para moléculas involucradas en algunas de las vías metabólicas de carbohidratos, lípidos y procesos inflamatorios. Las variantes genéticas más replicadas en todo el mundo, asociadas con DT2, se encuentran en genes como TCF7L2, KCNQ1, KCNJ11 y PPARG. El gen TCF7L2 participa activamente en el control de la producción de glucosa en el hígado. En ratones se ha observado que la ausencia de este gen incrementa los niveles de glucosa en sangre. Polimorfismos en TCF7L2 se asocian con intolerancia a la glucosa y un incremento en la regulación de los genes gluconeogénicos. Por su parte, PPARG se expresa en los tejidos adiposos blanco y marrón y es un regulador clave en la diferenciación del adipocito y metabolismo de lípidos. Polimorfismos en este gen están asociados con las concentraciones de triglicéridos, índice de masa corporal (IMC), adiposidad visceral y resistencia a la insulina. Por otro lado, mutaciones y polimorfismos en el gen KCNJ11 contribuyen a la diabetes neonatal y a la DT2 común.

Figura 8. La leptina en personas obesas.
Los estudios genómicos relacionados con EMet en poblaciones mexicanas son escasos y la mayoría de los análisis masivos con microarreglos de polimorfismos se han diseñado con base en lo observado en poblaciones de ancestría europea. Es por esto que es posible que muchos de los factores genéticos responsables de estas enfermedades en población mexicana aún no se hayan identificado, principalmente aquellas variantes exclusivas de la población o definidas como raras por su escasa frecuencia en otras poblaciones. Un ejemplo de esto es la variante R230C del gen ABCA1, específica de población con ancestría indígena americana y fuertemente asociada con bajos niveles de colesterol HDL, OB y DT2. En el mismo sentido, en un estudio realizado recientemente por el consorcio SIGMA (Slim Initiative in Genome Medicine for the Americas) para la DT2, se identificó un locus en el cromosoma 17q13.1 asociado a DT2 que abarca dos genes de la familia de transportadores de ácido monocarboxílico pobremente caracterizados: el gen SLC16A13, recientemente asociado a DT2 en asiáticos y el gen SLC16A11 que no había sido asociado con ninguna enfermedad en otras poblaciones. La señal más fuerte fueron 5 variantes que forman un haplotipo en el gen SLC16A11 (Figura 9). Este haplotipo tiene una alta frecuencia en poblaciones de origen amerindio (>50%), pero en otras poblaciones es poco frecuente o está ausente. Esta elevada frecuencia podría explicar el incremento del 20% en la prevalencia de la DT2 en poblaciones latinoamericanas. Resulta interesante que este sea el primer ejemplo de una variante génica que proviene de Neandertales, afectando la fisiología y susceptibilidad a desarrollar alguna enfermedad. Así, identificando las variantes raras o exclusivas de las poblaciones, en un futuro cercano seremos capaces de mejorar las estrategias del manejo y prevención de las EMet que afectan a la población mexicana.
Epigénetica

Figura 9. Variantes comunes en poblaciones con ancestría nativo americana. Diversos estudios han demostrado que las EMet se desarrollan en individuos genéticamente susceptibles, sin embargo, los factores genéticos identificados hasta ahora sólo explican una pequeña proporción de los casos con EMet. Investigaciones recientes proponen que procesos epigenéticos como la expresión de miRNAs, modificaciones de histonas y la metilación del DNA, también pueden asociarse a la OB y a la DT2. En pacientes obesos se han reportado alteraciones en la metilación de DNA en varios genes que codifican para proteínas que participan en el metabolismo de la glucosa o que están relacionados con el desarrollo de OB, como los transportadores de glucosa en tejido adiposo y músculo, la proteína desacoplante 2, leptina, el factor de transcripción PGC1A. Adicionalmente, la regulación epigenética es crucial en la diferenciación del preadipocito a adipocito y juega un papel importante en la salud metabólica. Resultados preliminares de nuestro grupo de trabajo muestran que la metilación de DNA en tejido adiposo de diabéticos se encuentra alterada principalmente en genes que participan en la diferenciación, moléculas de adiposidad y algunos de los genes que se han asociado a DT2 por otras tecnologías genómicas. De hecho, se ha propuesto que la epigenética podría explicar el vínculo entre los estímulos ambientales y la regulación génica.
Aplicaciones clínicas
La medicina personalizada tiene como objetivo proporcionar la información genética relevante para el manejo integral del paciente. Si bien el perfil genético permite apoyar el diagnóstico en entidades metabólicas monogénicas como MODY, las pruebas genéticas no están ampliamente disponibles para las otras formas de EMet. Sin embargo, a pesar de la complejidad de esta patología, el descubrimiento de loci involucrados ha permitido predecir, en algunos casos, los efectos clínicos de estas enfermedades. Por ejemplo, se ha demostrado que personas homocigotas para el alelo (AA) de la variante rs9939609 en el gen FTO, aumentan la ingesta de alimentos ricos en grasa y tienen un desbalance en la saciedad, lo que se traduce a largo plazo en un amento en el IMC, pero que esto puede ser atenuado en cerca del 27%, en adultos que son físicamente activos, demostrando la influencia de los factores ambientales en el efecto del riesgo genético. Otro ejemplo son los estudios en el gen hepatocito nuclear factor 4 alpha (HNF4A), que han revelado que el 56% de madres portadoras de mutaciones tienen productos macrosómicos (peso al nacer mayor de 4 kg) con un alto riesgo de desarrollar diabetes.Interesantemente, estudios recientes muestran que individuos delgados heterocigotos para el haplotipo (5 SNPs) del gen SLC16A11 tienen un incremento del 25% en el riesgo para desarrollar DT2 tempranamente y en los individuos que heredaron este haplotipo de ambos padres (homocigotos) este riesgo aumenta hasta el 50% en relación con los no portadores.
Blancos terapéuticos
La traducción de loci en nuevos blancos terapéuticos requiere de la identificación de genes y mutaciones causales, así como del conocimiento sobre la correlación entre la actividad de la proteína y el riesgo a la enfermedad. En la actualidad se conocen algunos blancos terapéuticos para las EMet. Por ejemplo, los hipoglucemiantes como las sulfonilureas son utilizados en pacientes con mutaciones en los genes HNF1A y KCNJ11. Este último gen causa entre el 30 al 58% de los casos con diabetes neonatal. Así mismo, pacientes con mutaciones heterocigotas en GCK (GCK-MODY) pueden ser mal diagnosticados como diabetes tipo 1 (DT1) y tratados con insulina. Sin embargo, se ha observado que los niveles de glucosa y hemoglobina glicosilada no disminuyen con el medicamento, por lo que en casos como éste, la administración de insulina no es necesaria.Otro de los parámetros más importantes para considerar un factor genético, como un blanco terapéutico, es la frecuencia de éste a nivel mundial o en una población determinada. Así, un blanco terapéutico potencial para el tratamiento personalizado de DT2 en poblaciones de ancestría nativo americana es el gen SLC16A11, el cual es un transportador de membrana de un metabolito, de función aún desconocida, involucrado con el metabolismo de triglicéridos. Por su alta frecuencia en poblaciones de origen nativo americanas (>50%), este gen es un blanco ideal para una terapia personalizada de DT2 en poblaciones como la mexicana, en la medida que se identifique el metabolito y su función.

Figura 10. Jarra del buen tomar y plato del buen comer.
Perfil genético pronóstico
A pesar de que ya existe un amplio conocimiento de la participación de los factores genéticos en las EMet, el ambiente sigue siendo el único factor modificable para tratar de prevenir, retrasar o disminuir las complicaciones de éstas (Figura 10). Existen evidencias de que el paciente con EMet ha transitado por diversas etapas biológicamente alteradas antes de llegar a padecer la enfermedad. En este sentido, definir las vías moleculares particulares que intervienen en cada paciente ha sido una gran limitante para facilitar la transición de la investigación genómica en aplicaciones clínicas. Idealmente, en un futuro, en el algoritmo pronóstico del "riesgo de EMet" se incluirán no sólo los antecedentes familiares, la antropometría y los niveles séricos de marcadores bioquímicos, sino también los marcadores genéticos que serán de gran utilidad para predecir las manifestaciones de la enfermedad o la gravedad y definir la terapia personalizada que tendrá éxito en cada uno de los individuos.Conclusiones
En los últimos años, los alcances obtenidos del excitante progreso tecnológico en la investigación genómica han sido fundamentales para el entendimiento de las EMet. Éstas son un espectro de padecimientos genéticamente heterogéneos y con una expresividad muy variable en sus manifestaciones clínicas. Existen fuertes evidencias de que esta heterogeneidad está influenciada por la participación de factores genéticos en las intrincadas rutas del metabolismo de carbohidratos y lípidos, así como de procesos inflamatorios, complejidad que puede ser limitante para establecer las correlaciones genéticas y fenotípicas. Así, aunque las herramientas actuales para el análisis amplio del genoma son altamente poderosas y proveen de invaluable conocimiento sobre la arquitectura genética de las enfermedades complejas, aún existen serias limitaciones en relación a las estrategias diagnósticas basadas en el genoma. Así, todavía estamos en la etapa en que los marcadores genéticos de la gran mayoría de las familias con EMet no son del todo suficientes para identificar con certeza a aquellos individuos en riesgo para desarrollar la condición. El pronóstico, diagnóstico y tratamiento personalizado del paciente con EMet seguirá mejorando a medida que la lista de marcadores y la identificación del número de interacciones gen-gen y gen-ambiente incrementen, de tal manera, que en un futuro seremos capaces de determinar el riesgo que tendrá un individuo en desarrollar alguna de las EMet y prevenir o retrasar sus complicaciones.Bibliografía
BELL, C.G., et al. “Integrated genetic and epigenetic analysis identifies haplotype-specific methylation in the FTO type 2 diabetes and obesity susceptibility locus”. PloS One, 2010, 5, e14040.
CAMPOS-NONATO, I., et al. “Hipertensión arterial: prevalencia, diagnóstico oportuno, control y tendencias en adultos mexicanos”. Salud Pública México, 2013, 55, p. S144-S150.
CARRETERO, M.V., et al. “Transformed but not normal hepatocytes express UCP2”. FEBS Lett, 1998, 439, p. 55-58.
CONSORTIUM, T. 1000 G.P. “An integrated map of genetic variation from 1,092 human genomes”. Nature, 2012, 491, p. 56-65
DUŠÁTKOVÁ, L., et al. “Association of obesity susceptibility gene variants with metabolic syndrome and related traits in 1,443 Czech adolescents”. Folia Biol. (Praha), 2013, 59, p. 123-133.
FRAYLING, T.M., and McCarthy, M.I. “Genetic studies of diabetes following the advent of the genome-wide association study: where do we go from here?” Diabetologia, 2007, 50, p. 2229-2233.
HERNÁNDEZ-ÁVILA, M., Gutiérrez, J.P., y Reynoso-Noverón, N. “Diabetes mellitus en México. El estado de la epidemia”. Salud Pública México, 2013, 55, p. S129-S136.
JIMÉNEZ-CORONA, A., Aguilar-Salinas, C.A., Rojas-Martínez, R., y Hernández-Ávila, M. “Diabetes mellitus tipo 2 y frecuencia de acciones para su prevención y control”. Salud Pública México, 2013, 55, p. S137-S143.
KARRA, E., et al. “A link between FTO, ghrelin, and impaired brain food-cue responsivity”. J. Clin. Invest. 2013, 123, p. 3539-3551.
LING, C., et al. “Epigenetic regulation of PPARGC1A in human type 2 diabetic islets and effect on insulin secretion”. Diabetologia, 2008, 51, p. 615-622.
McCARTHY, M.I. “Genomics, Type 2 Diabetes, and Obesity”. N. Engl. J. Med. 2010, 363, p. 2339-2350.
MEDINA, C., Janssen, I., Campos, I., and Barquera, S. “Physical inactivity prevalence and trends among Mexican adults: results from the National Health and Nutrition Survey (ENSANUT) 2006 and 2012”. BMC Public Health, 2013, 13, 1063.
PEARSON, E.R. “Recent advances in the genetics of diabetes”. Prim. Care Diabetes 2, 2008, p. 67-72.
PINNICK, K.E., and Karpe, F. “DNA methylation of genes in adipose tissue”. Proc. Nutr. Soc. 2011, 70, p. 57-63.
SCHWENK, R.W., Vogel, H., and Schürmann, A. (2013). “Genetic and epigenetic control of metabolic health”. Mol. Metab. 2013, 2, p. 337-347.
STÖGER, R. “In vivo methylation patterns of the leptin promoter in human and mouse”. Epigenetics: Off. J. DNA Methylation Soc. 2006, 1, p. 155-162.
SIGMA Type 2 Diabetes Consortium, Williams, A.L., et al. “Sequence variants in SLC16A11 are a common risk factor for type 2 diabetes in Mexico”. Nature, 2014, 506, p. 97-101.
XI, B., Chandak, G.R., Shen, Y., Wang, Q., and Zhou, D. “Association between Common Polymorphism near the MC4R Gene and Obesity Risk: A Systematic Review and Meta-Analysis”. PLoS ONE, 2012, 7, e45731.
YOKOMORI, N., Tawata, M., and Onaya, T. “DNA demethylation during the differentiation of 3T3-L1 cells affects the expression of the mouse GLUT4 gene”. Diabetes, 1999, 48, p. 685-690.
COMENTARIOS
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
2013 Esta obra está bajo una licencia de Creative Commons 














