Revista Digital Universitaria ISSN: 1607 - 6079 | Publicación mensual
1 de agosto de 2014 vol.15, No.8
• TEMA DEL MES •
Biotecnología de México para todos
Cápsides virales o VLPs
Introducción
La bionanotecnología se enfoca en la investigación y en el desarrollo de nuevos materiales a escala nanométrica, para fines específicos, basados en biomoléculas, tales como ácidos nucléicos, proteínas y carbohidratos. Dentro de estos materiales naturales se encuentran las cápisdes virales o VLPs (virus-like particles) que recientemente han recibido gran atención debido al alto potencial que presentan dentro de este campo, en particular en el área de la ciencia de materiales y la nanomedicina (Manchester y Steinmetz, 2009).Cápsides virales o VLPs
Las cápsides virales o VLPs (virus-like nanoparticles) se componen únicamente de las proteínas de la cápside viral, y a diferencia de los virus, no contienen el material genético natural de éstos, por lo que no son partículas infecciosas. Estas partículas pueden ser utilizadas como andamiajes básicos para el diseño y fabricación de materiales nanoestructurados. Dentro de este contexto, algunas de las características que hacen atractivas a las cápisdes virales son las siguientes (Lee et al., 2009; Strable y Finn, 2009): i) Presentan arquitecturas altamente ordenadas de dimensiones nanométricas que tienen la capacidad de autoensamblarse. ii) Se estima que alrededor de 1031 virus habitan la Tierra (Bamford et al., 2005), dentro de este vasto número existe una gran diversidad tanto de tamaños (17 - 1500 nm en cápsides icosaédricas); como de formas distintas, predominando las cápsides icosaédricas, filamentosas y helicoidales (Fig. 1). iii) Cuentan con estructuras monodispersas en tamaño y composición, bajo condiciones particulares de pH y fuerza iónica. iv) Poseen áreas superficiales grandes, con una variedad grupos funcionales expuestos en un alto número de copias, que permiten el acoplamiento de múltiples ligandos, ya sea de la misma molécula o diferentes moléculas. Esta característica los hace moléculas polivalentes, con la capacidad de participar en interacciones colectivamente más fuertes que sus contrapartes con sitios únicos de interacción, aumentando la afinidad de unión con los sitios blanco. v) Presentan cavidades que pueden ser utilizadas para encapsular moléculas con diversos fines. vi) Debido a su carácter proteíco son biocompatibles y biodegradables.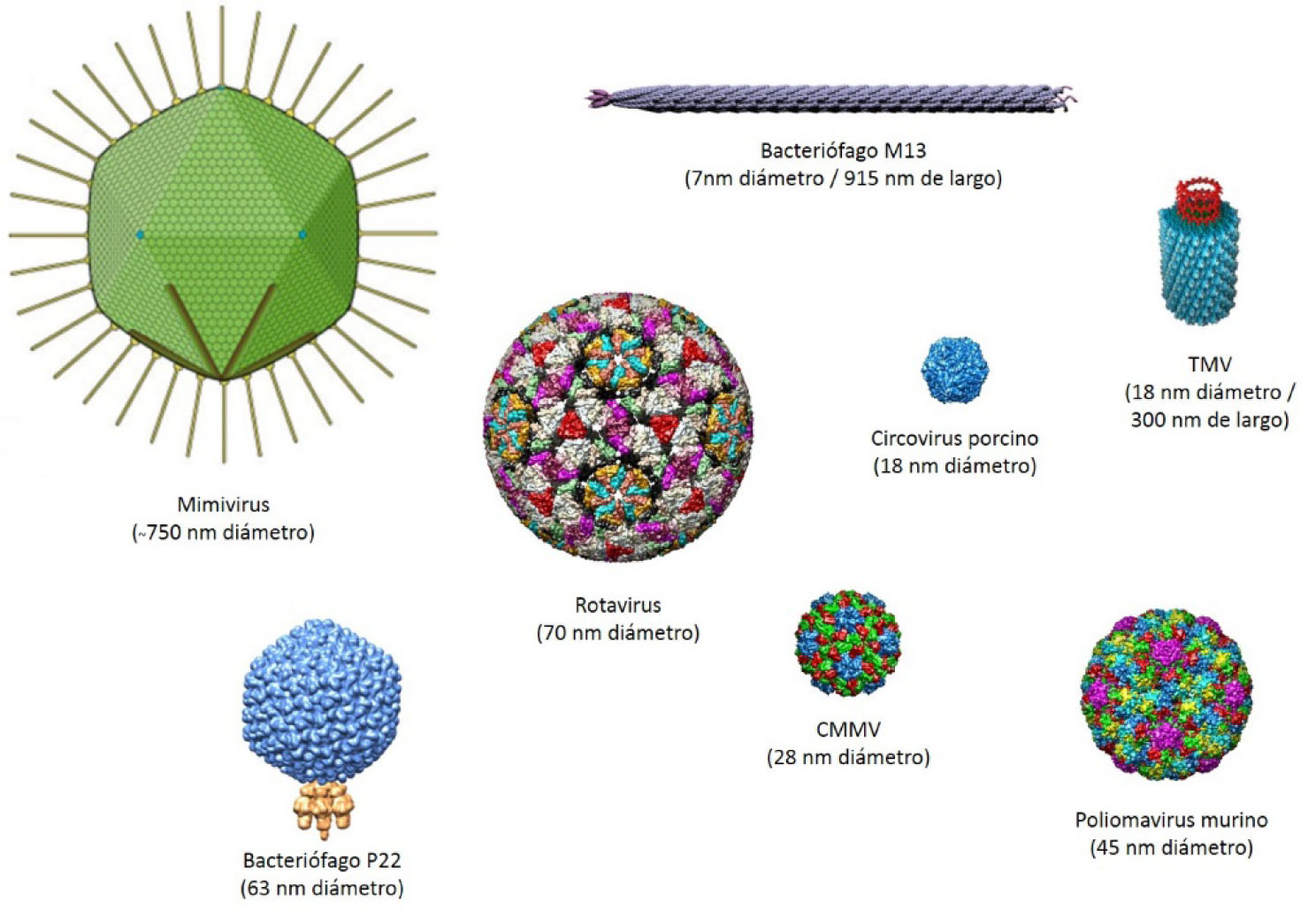
Figura 1. Estructuras tridimensionales de virus con distintas formas y tamaños. CCMV: Virus del moteado clorótico del frijol caupí. TMV: Virus del mosaico del tabaco. Los modelos fueron tomados de la base de datos VIPERdb
Las nanopartículas virales cuentan con tres interfaces disponibles para ser manipuladas ya sea químicamente o genéticamente: la superficie externa, la interface entre las subunidades protéicas y la cara interna (Douglas y Young, 2006). Esta última se ha utilizado para encapsular diversos materiales como metales (Hooker et al., 2007), medicamentos (Ren et al., 2007), DNA (Verma y Weitzma, 2005) y proteínas (Lipin et al., 2008) con el fin de generar nuevos materiales, catalizadores y sistemas de suministro. El encapsulamiento de proteínas se ha enfocado principalmente en la introducción de proteínas fluorescentes en nanoestructuras protéicas. El modelo más utilizado ha sido la proteína verde fluorescente (GFP) debido a su fácil detección (Günther et al., 2001; Abbing et al., 2004; Minten et al., 2010; O'Neil et al., 2012). Sin embargo, hoy en día, existen diversos trabajos en los que se han encapsulado enzimas dentro de estos contenedores, generando bionanorreactores con propiedades y capacidades catalíticas diferentes a sus contrapartes sin encapsular.
La encapsulación de proteínas dentro de estos vehículos de origen viral, ofrece una serie de ventajas para sobrepasar las limitaciones que presentan las proteínas como agentes terapéuticos. En primer lugar, las cápsides son vehículos con una alta capacidad de carga aptos para el transporte de cantidades considerables de proteína en su interior. Además, la nanoestructura viral es capaz de conferir a la proteína encapsulada protección frente a la degradación por proteasas (Fiedler et al., 2010; O'Neil et al., 2013), así como una barrera contra el reconocimiento por el sistema inmune (Inoue et al., 2008). La inmunogenicidad del virus puede ser abatida por distintos métodos entre los que sen encuentran los llamados "self-peptides", la modificación de los epítopes y el recubrimiento de la partícula con polietilenglicol (PEG). De esta manera se modifica químicamente la cápside y no el biofármaco en cuestión, evitando repercusiones negativas en la actividad biológica de la proteína terapéutica.
Debido a su tamaño, las cápisdes virales no pueden ser filtradas y eliminadas por el riñón (umbral de remoción <40 kDa), permaneciendo más tiempo circulando en el organismo (aumento del tiempo de residencia dentro del organismo). Finalmente y de importancia para la terapia contra el cáncer, se ha observado que las partículas en el orden nanométrico (100-500 nm) se acumulan preferentemente dentro de tumores sólidos debido a un fenómeno conocido como efecto de permeabilidad y retención aumentada (EPR effect) (Fig. 2). Esta acumulación se debe a que los vasos sanguíneos promovidos por el tumor y que rodean a éste, presentan una arquitectura desorganizada con una serie de huecos en su estructura (200-800 nm), permitiendo la extravasación de nanopartículas hacia el interior del tejido. Aunado a lo anterior, las partículas son retenidas en estos sitios debido a un drenaje linfático deficiente característico de los tumores (Iyer et al., 2006; Torchilin, 2011).
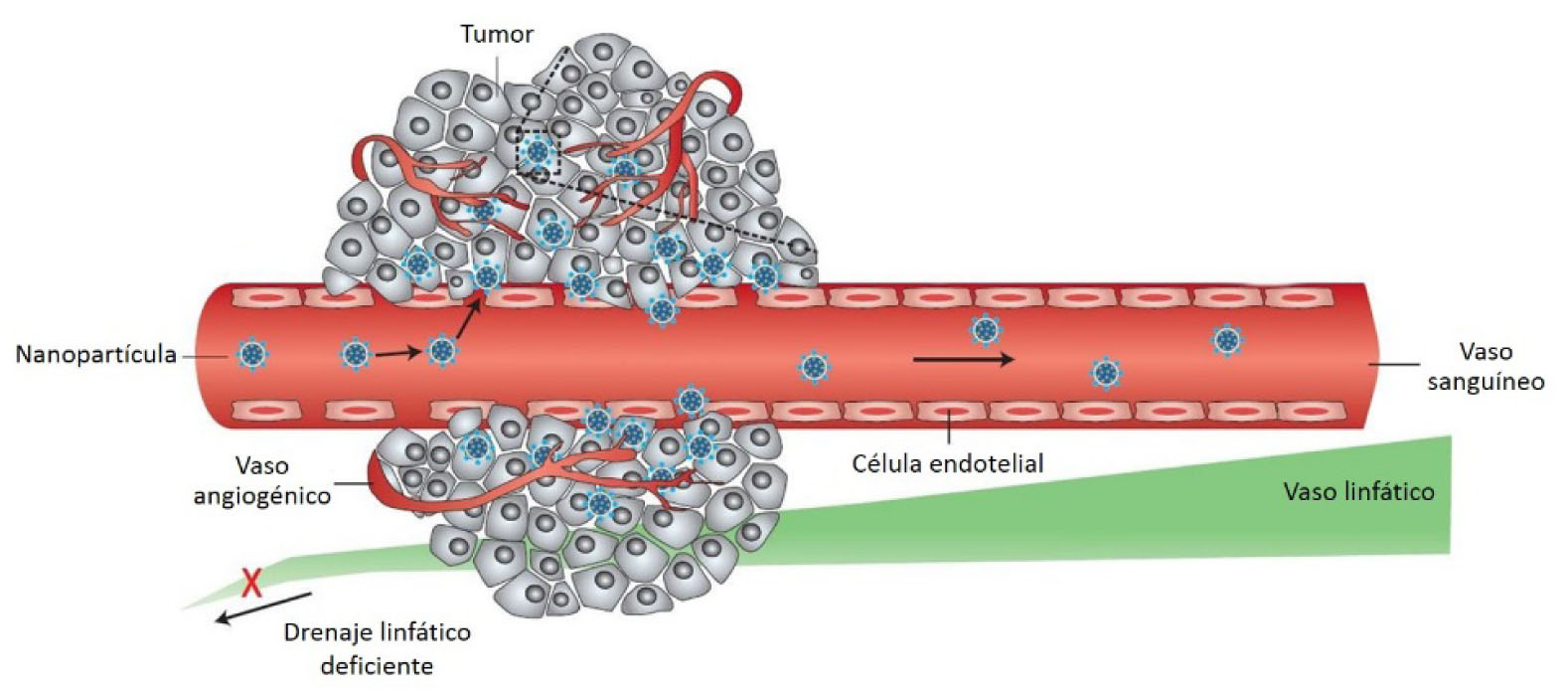
Figura 2. Efecto EPR. Acumulación de nanopartículas en tumores sólidos. Modificada de Peer et al., 2007.
Terapia de activación de profármacos vía enzimas
La terapia de activación de profármacos utilizando enzimas exógenas es una estrategia que se ha propuesto para aumentar la eficiencia de ciertos procedimientos médicos, como la quimioterapia, que aunque es uno de los tratamientos más utilizados hoy en día para combatir el cáncer (Al-Lazikani et al., 2012) presenta serios efectos secundarios. El objetivo final de esta estrategia es aumentar la concentración local de fármaco activo en las células tumorales, lo cual incrementaría la eficiencia del medicamento en el tumor y reduciría la toxicidad producida por el fármaco en el resto de las células del hospedero (Hetch y Waxman, 2000, Sánchez-Sánchez et al., 2014). Esta terapia se lleva a cabo en dos pasos, en el primero la enzima exógena debe ser dirigida a las células de interés y acumularse en el sitio; para posteriormente en un segundo paso, administrar el profármaco (ya sea de manera dirigida o sistémica), activándose selectivamente en las células blanco.Se han propuesto a grandes rasgos dos métodos para llevar a cabo el suministro de la enzima, capaz de activar el profármaco, a las células de interés: suministro de genes, conocidos por sus siglas en inglés como GDEPT (gene-directed enzyme prodrug therapy) y suministro de enzimas activas (Xu y McLeod, 2001).
La terapia génica suicida (GDEPT) involucra la introducción, a células tumorales específicas, de uno o varios genes que codifican para enzimas con la capacidad de transformar profármacos. Estos genes pueden ser suministrados a las células tumorales utilizando distintos vectores, entre los que se encuentran los de tipo viral (Xu y McLeod, 2001). Hasta la fecha se ha desarrollado una variedad de sistemas enzima-profármaco, siendo uno de los más explotados el que está basado en la activación de profármacos por CYP450s, que de manera general no se expresan en grandes cantidades en células tumorales y que son capaces de transformar medicamentos anticancerígenos usados clínicamente (Chen et al., 2002).
Para el caso del suministro de enzimas activas, la terapia basada en anticuerpos, conocida como ADEPT (antibody-directed enzyme prodrug therapy) ha sido una de las más desarrolladas. La enzima capaz de transformar el profármaco se dirige selectivamente a las células blanco, a través de la conjugación con un anticuerpo, que tiene la capacidad de unirse específicamente a antígenos que se expresan en la superficie de las células tumorales (Niculescu-Duvaz y Springer, 1997).
Para ambas estrategias, GDEPT y ADEPT, se han desarrollados sistemas enzima-profármaco que han llegado a ser probados en ensayos clínicos (Dachs et al., 2005; Francis et al., 2002); sin embargo, no existe aún ningún tratamiento en uso basado en estas terapias.
Encapsulación de enzimas dentro de cápisdes virales
La encapsulación de enzimas dentro de cápisdes virales se ha realizado principalmente para la producción de bionanorreactores enfocados al estudio de fenómenos de catálisis (Comellas-Aragones et al., 2007; Fiedler et al., 2010; Minten, 2011; Patterson et al., 2012; 2012b, 2014 O'Neil et al., 2013), aunque también se ha propuesto su utilización como posibles agentes terapéuticos (Inoue et al., 2008).El primer artículo reportado sobre la encapsulación de enzimas en cápisdes virales fue en el 2007, en donde Comellas-Aragonès y colaboradores diseñaron un sistema para estudiar el comportamiento cinético de enzimas a nivel individual, basado en la encapsulación de una peroxidasa de rábano blanco en cápisdes virales derivadas del virus CCMV. Por un lado, encontraron que un parámetro que afecta de manera importante la catálisis es el tiempo de difusión del sustrato hacia el interior de la nanoestructura, el cual puede ser manipulado al cambiar el pH en el que se encuentran las cápsides (apertura de poros a pH > 7). Por otro lado, fueron capaces de detectar una serie de fluctuaciones en la transformación de sustrato a producto a través del tiempo; este comportamiento de prendido-apagado que se observa al trabajar con moléculas de enzima individuales, está relacionado con el hecho de que las enzimas presentan una serie de cambios conformacionales a través del tiempo en donde sólo algunas de ellas presentan una alta actividad catalítica (Engelkamp et al., 2006).
Posterior a este primer trabajo, se ha llevado a cabo la encapsulación de múltiples enzimas (varias de un solo tipo) en distintas cápisdes virales utilizando estrategias diferentes para la encapsulación (Tabla 1).
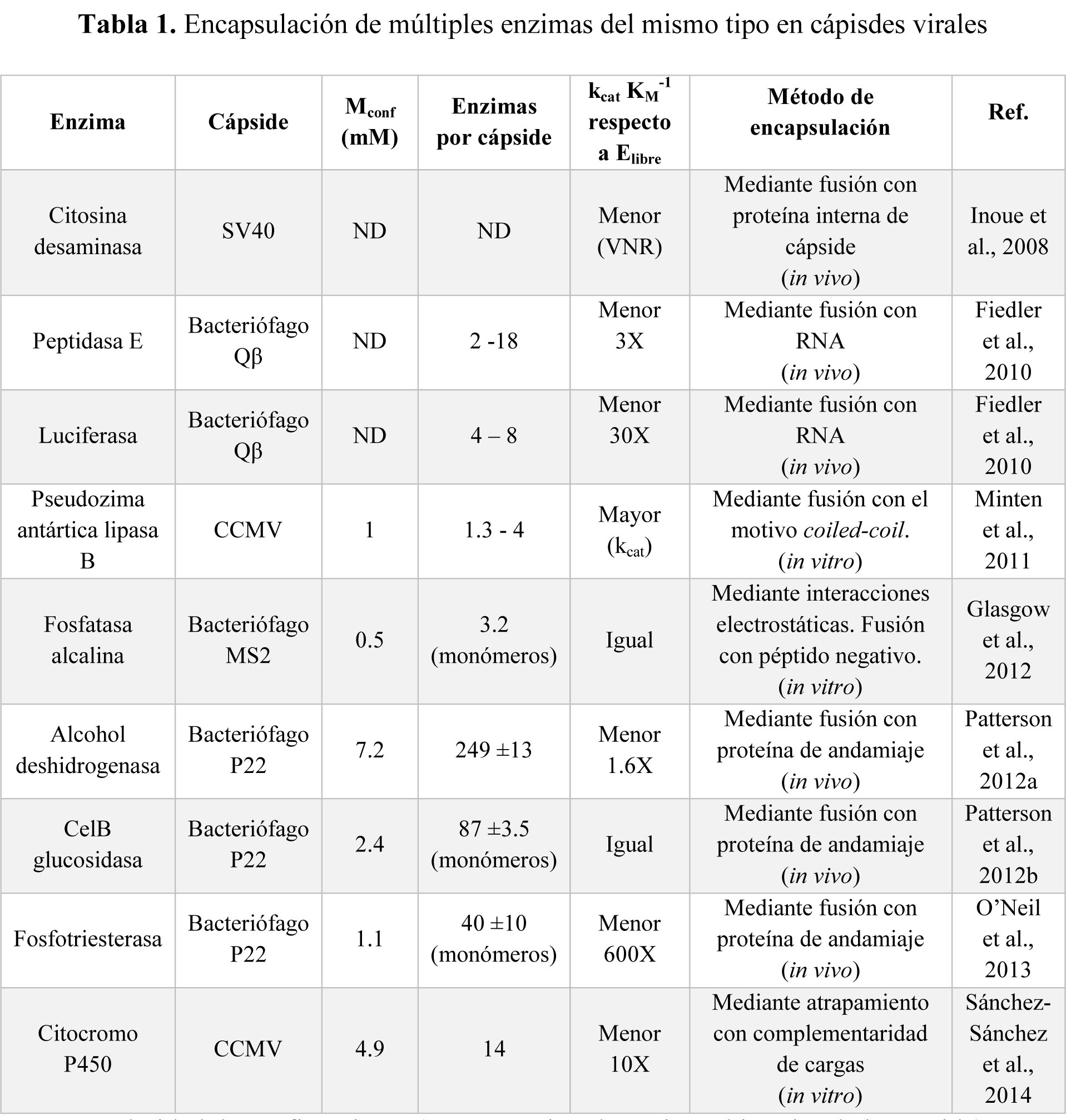
Mconf: Molaridad de confinamiento (concentración de enzima al interior de la cápside). ND: No determinado. VNR: Valor no reportado
Las altas concentraciones de enzima alcanzadas dentro de las cápsides virales, en el orden milimolar, permiten estudiar fenómenos de catálisis en ambientes hacinados simulando los encontrados a nivel celular, lo que permitiría entender de mejor manera el funcionamiento de estos biocatalizadores dentro de las células.
A pesar de encontrar para la mayoría de las enzimas encapsuladas un decremento en la actividad, se generan para algunos de estos sistemas nuevas propiedades en el bionanorreactor, como un aumento en la termoestabilidad (Fiedler et al., 2010; O'Neil et al., 2013), resistencia a proteólisis (Fiedler, 2010; O'Neil, 2013), protección ante el proceso de liofilización (O'Neil, 2013), reversión de la inhibición por sustrato (Patterson, 2012a) y la disminución a la desnaturalización bajo ciertas condiciones operativas (Comellas-Aragonès et al., 2007). Para el caso particular de la citosina desaminasa, que convierte el profármaco 5-fluorocitosina al fármaco activo 5-fluorouracil, la cápside del SV40 fue utilizada como vehículo para el suministro de actividad enzimática a células CV-1 (línea celular procedente de riñón de mono), con el fin de sensibilizarlas al tratamiento por el profármaco e inducir la muerte celular (Inoue et al., 2008).
Recientemente, fue publicado el primer artículo en el que múltiples copias de enzimas distintas fueron encapsuladas en una partícula pseudoviral (bacteriófago P22). Las tres enzimas encapsuladas, CelB glucosidasa, ATP-galactosidasa y ADP-glucocinasa, tienen la particularidad de llevar a cabo una serie de reacciones en cascada en el metabolismo de azúcares de Pyrococcus furiosus (Patterson et al., 2014). Contrario a lo que se esperaba, no se encontró un aumento en la eficiencia de la cascada de reacción; es fundamental poner especial atención en el balance adecuado de los parámetros cinéticos de cada una de las enzimas involucradas, para diseñar un sistema catalítico eficiente. La construcción de metabolomas sintéticos a base de la encapsulación de enzimas en partículas pseudovirales, podría generar sistemas catalíticos complejos con diversas aplicaciones prácticas.
En la naturaleza, la encapsulación de enzimas dentro de compartimientos, ya sea en organelos u otros contenedores de origen proteico (Fig. 3), es un mecanismo altamente utilizado a nivel celular, tanto en eucariontes como en procariontes, en donde las enzimas encargadas de llevar a cabo una serie de reacciones consecutivas en una vía metabólica, se encuentran espacialmente separadas de otros componentes en la célula (Kang y Douglas, 2010). Se sugiere que esta compartamentalización puede aumentar la eficiencia para llevar a cabo la cascada de reacción ya que las enzimas se encuentran co-localizadas en un ambiente de alta concentración local de sustrato, se previene la pérdida de intermediarios poco estables o tóxicos (Tanaka et al., 2010), y da lugar a que procesos metabólicos incompatibles pueden proceder simultáneamente dentro de la célula (Wörsdörfer et al., 2011).
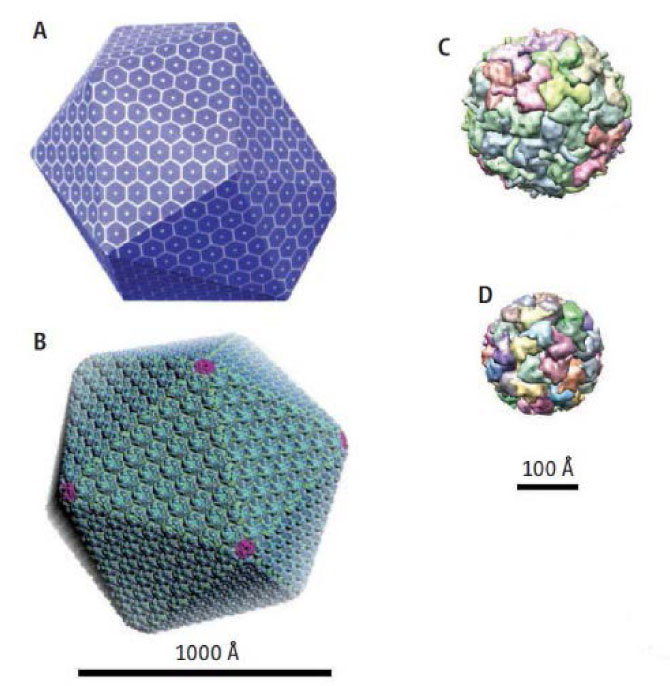
Figura 3. Modelos de microcompartimientos protéicos encontrados en bacterias. Las estructuras son semejantes a cápsides virales icosaédricas. A) Microcompartimiento de utilización de etanolamina en E. coli. B) Carboxisoma. C) Encapsulina T. marítima. D) Lumazina sintasa B. subtilis. Modificado de Kang et al., 2010
Citocromo P450 de Bacillus megaterium (CYPBM3 "21B3")
El citocromo P450 de Bacillus megaterium (Cirino et al. 2003) fue encapsulado dentro de cápisdes virales con el fin de aprovechar las características de estas nanopartículas como un modelo para el diseño de nanovehículos para el transporte de enzimas con aplicaciones médicas (Sánchez-Sánchez et al., 2014).Previamente se evaluó la capacidad del CYP para transformar una serie de profármacos anticancerígenos, con el fin de proponer un uso práctico a las partículas pseudovirales con CYP en su interior bajo el contexto de la terapia de activación de profármacos por medio de enzimas. Seis profármacos fueron seleccionados con base a reportes previos de CYP humanos con la capacidad de transformar estos medicamentos (Huttunen et al., 2008; McFadyen et al., 2004): tamoxifen, ifosfamida, ciclofosfamida, tegafur, dacarbazina y resveratrol. De estos profármacos ensayados, únicamente el tamoxifen y el resveratrol fueron transformados por el CYPBM3 "21B3" (Sánchez-Sánchez et al., 2014).
El tamoxifen es el medicamento más utilizado para el tratamiento de cáncer de mama dependiente de hormonas (Hoskins, et al., 2009). Actúa como un modulador selectivo del receptor de estrógeno, inhibiendo la proliferación de las células tumorales (Osborne, 1998). Este anticancerígeno es metabolizado por distintos CYP450 en el organismo (Fig. 16), principalmente CYP2D6 y CYP3A4, para dar lugar a los fármacos activos 4-hidroxitamoxifen y endoxifen, así como a una serie de metabolitos clínicamente no activos (Rochat, 2005 y Brauch et al., 2009).
Se llevó a cabo la determinación de los parámetros cinéticos para la transformación de este profármaco con el CYPBM3 "21B3" encontrando una kcat = 41.9 ±4.2 min-1 y una KM = 106.9 ±23 µM (Sánchez-Sánchez et al., 2014). El CYP bacteriano fue capaz de transformar al medicamento en cuatro productos (Fig. 4), los cuales fueron detectados por una nanocromatografía de líquidos acoplada a espectrometría de masas en tándem (nanoLC/MSMS). Los compuestos identificados corresponden al 4-hidroxitamoxifen, 4-hidroxi-N-demitiltamoxifen (endoxifen), N-demetiltamoxifen y dihidroxitamoxifen. Es importante mencionar que el control de tamoxifen con peróxido de hidrógeno (sin enzima) no genera ningún perfil de productos.
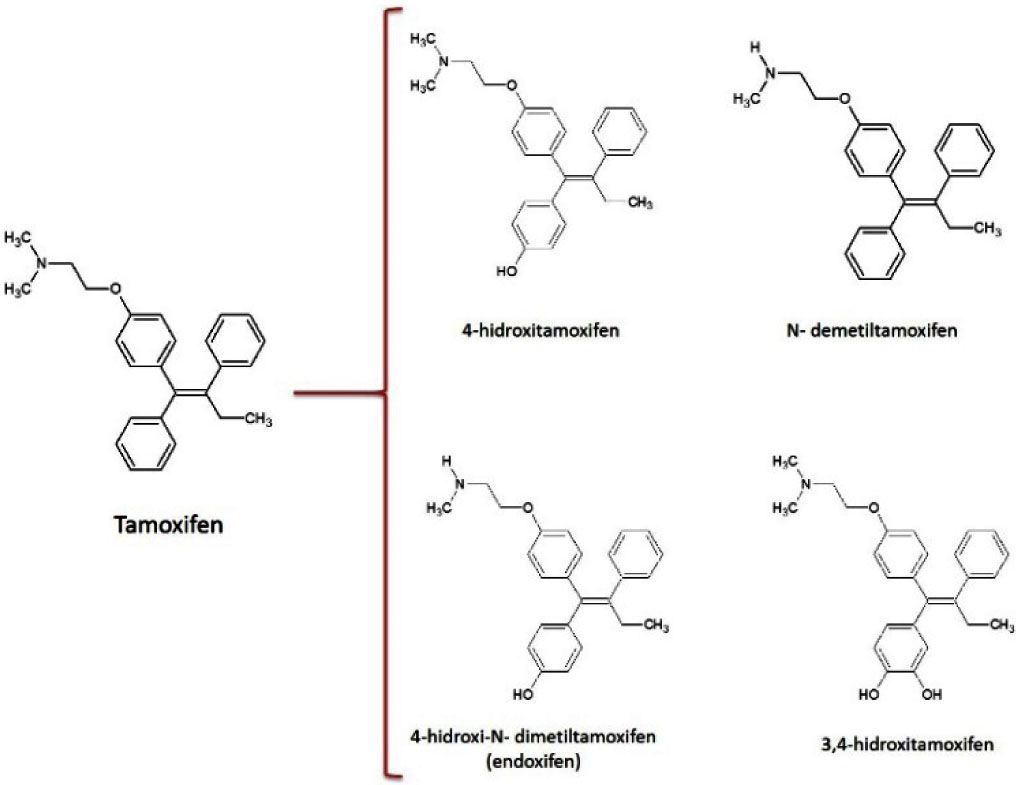
Figura 4. Productos de transformación identificados para la reacción del CYPBM3 "21B3" con el profármaco tamoxifen
La mutante del CYP que se usó como modelo fue capaz de generar los dos fármacos clínicamente activos: 4-hidroxitamoxifen y endoxifen (Johnson et al., 2004). El N-demetiltamoxifen es un precursor para formar el endoxifen. Finalmente, el compuesto dihidroxilado pudiera tratarse del 3,4-dihidroxitamoxifen, una especie reactiva que puede generar epóxidos y/o quinonas que tienen la capacidad de unirse covalentemente a DNA o proteínas causando un efecto tóxico en las células (Notley et al., 2002). Este efecto tóxico ayudaría a incrementar la muerte de las células tumorales.
La terapia de activación de profármacos utilizando cápisdes virales con CYP en su interior podría ser especialmente útil para hacer más eficiente el tratamiento de cáncer de mama basado en el tamoxifen debido principalmente a dos razones. La primera está relacionada a que el gen que codifica para el CYP2D6 es altamente polimórfico, por lo que existe una fracción de la población que no puede ser beneficiada con la terapia basada en tamoxifen debido a que son deficientes en la expresión de CYP2D6, el principal responsable en la generación de endoxifen (Ingelman-Sundberg, 2005); por lo que llevar actividad CYP a los tumores de estos pacientes sería de gran beneficio.
La segunda razón es que se ha encontrado que el uso a largo plazo de la terapia con tamoxifen genera daños severos en ciertos tejidos, por lo que su uso se ha limitado a no más de 5 años (Perez, 2007). La activación selectiva del profármaco en el tumor vía CYP-VLPs podría disminuir significativamente las dosis y el tiempo requerido para alcanzar el efecto terapéutico deseado reduciendo así los severos efectos secundarios asociados a otros tejidos.
Por otro lado, el resveratrol es un compuesto polifenólico producido naturalmente en plantas. Además de su rol como fitoalexina (actividades antimicrobianas y antioxidativas), se le han atribuido una serie de propiedades antiinflamatorias, cardioprotectoras y anticancerígenas, tanto para prevenir el desarrollo del tumor como para tratarlo (Pirola y Fröjdö, 2008). Se ha encontrado que un derivado hidroxilado del resveratrol, el picetanol, tiene entre otras muchas actividades biológicas, la capacidad de funcionar como un agente quimioterapéutico más potente que el resveratrol (Lin et al., 2007). Este compuesto es capaz de suprimir la proliferación de células cancerosas e inducir apoptosis. Estas propiedades hacen al picetanol un fármaco potencial interesante en el tratamiento del cáncer.
El CYPBM3 "21B3" fue capaz de transformar el resveratrol en un producto tetrahidroxilado, probablemente el picetanol (Fig. 5), con una kcat = 69.8 ±11.4 min-1 y una KM = 119 ±39.8 µM (Sánchez-Sánchez et al., 2014). El producto fue identificado por nanoLC/MSMS. No se encontró transformación del resveratrol con solo peróxido de hidrógeno.
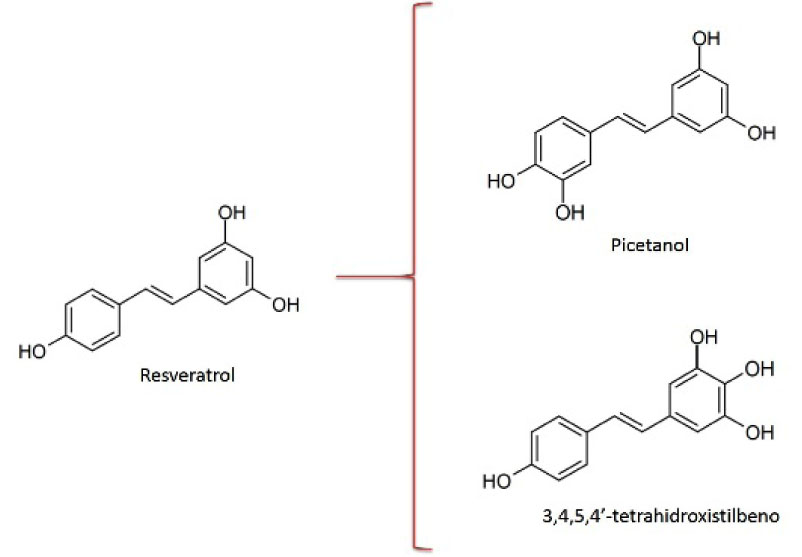
Figura 5. Productos de transformación identificados para la reacción del CYPBM3 "21B3" con el profármaco resveratrol.
Comparado con otras mutantes derivadas del CYPBM3, en donde el picetanol es el único producto de la reacción, este CYP presenta una eficiencia catalítica ligeramente mayor a las encontradas por Kim et al. (2009); debido al incremento de un orden de magnitud en la velocidad de transformación de sustrato, aunque la constante de afinidad también es significativamente mayor; lo que da como resultado un eficiencia catalítica de 0.59 min-1µM-1.
Encapsulación del CYP en cápsides virales del CCMV
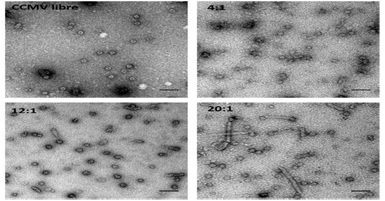
La ventaja fundamental al utilizar el CCMV para la encapsulación del CYP, se debe a que el interior de esta cápside se encuentra cargado fuertemente de manera positiva debido a la composición de aminoácidos básicos del N-terminal (Douglas et al., 2002), por lo que por complementariedad de cargas, el CYP deberá interactuar con la superficie interna de la cápside viral ya que la enzima está cargada negativamente a pH neutro. El N-terminal de la proteína de capa del CCMV utilizado para este trabajo contiene un cola de 6 histidinas, que fue utilizado para la purificación de la proteína. Es importante mencionar que la superficie externa del virus posee carga negativa a pH neutro, por lo que la interacción de la superficie externa del CCMV con el CYP es muy poco probable (Liepold et al., 2005).Las cápsides virales del CCMV fueron desensambladas y re-ensambladas en presencia de CYP. Se llevó a cabo una serie de ensayos de encapsulación probando diferentes relaciones CYP:Proetína viral (Sánchez-Sánchez et al., 2014). Se corroboró por microscopía electrónica de transmisión la formación de nanoestructuras para todas las relaciones molares ensayadas. A diferencia de las cápsides vacías, dónde el interior se tiñó por la entrada de acetato de uranilo (Fig. 6), las cápsides en presencia de biocatalizador se encuentran libres de tinción; lo cual puede ser resultado de una obstrucción en los poros de la estructura o de que el interior no está vacío, sugiriendo una posible encapsulación del CYP.
Además de encontrar cápsides esféricas para los encapsulados provenientes de las tres relaciones molares examinadas, se observan también para los encapsulados 12:1 y 20:1 la presencia de nanoestructuras tubulares, con una mayor proporción y tamaño cuando se utiliza una concentración inicial de 45 µM de proteína viral. La formación de nanotubos ha sido previamente reportada para cápisdes virales vacías del CCMV bajo condiciones de pH neutro y baja fuerza iónica (Adolph et al., 1974; Lavalle et al., 2009), condiciones de ensamblaje similares a las usadas para estos experimentos. Sin embargo, de acuerdo con los diagramas de fase reportados para el ensamblaje del CCMV (Lavalle et al., 2009) y las condiciones de pH y fuerza iónica utilizados en este trabajo (pH 7.2, 0.05M NaCl), no se reportan estructuras esféricas. El haber encontrado cápsides a pH neutro en las relaciones molares ensayadas PV a CYP, nos sugiere una estabilización de la cápside por la asociación del CYP con la capa interna del CCMV.
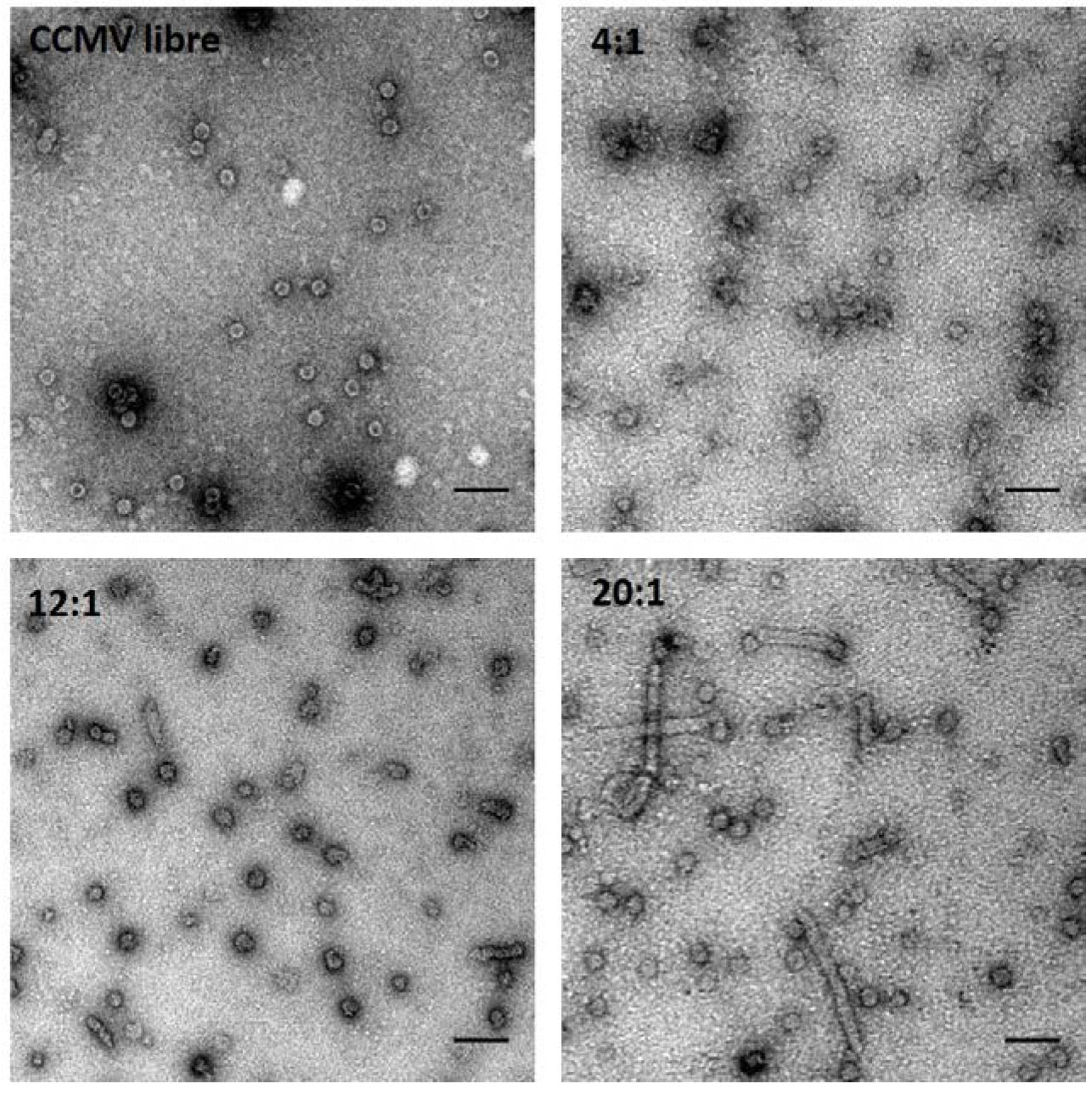
Figura 6. Ensamblados CCMV-CYP. Imágenes de TEM del CCMV vacío (pH 5) y las 3 encapsulaciones CCMV:CYP (pH 7). Tinción negativa con acetato de uranilo. Barra de escala = 50 nm
Se llevó a cabo la caracterización de los ensamblados correspondientes a la relación molar 12:1, ya que se observa una mayoría de cápsides bien definidas y una baja población de nanotubos (Fig. 6). Las cápisdes virales esféricas tienen un diámetro promedio de 27 ± 2.4 nm; un diámetro muy cercano al del CCMV nativo con número de triangulación igual a 3. Por otro lado, se encontró para los nanotubos un diámetro promedio de 20.8 ± 1.7 nm con un largo que está dentro del rango de los 40 a los 170 nm. La mayoría de los nanotubos encontrados se encuentran cerrados en los extremos.
Una evidencia más de la encapsulación de CYP en cápisdes virales del CCMV fue el haber detectado, en un gel SDS-PAGE, dos bandas correspondientes a los pesos moleculares de ambas proteínas involucradas. Por medio de un análisis por densitometría se determinó el número de enzimas empaquetadas por cápside, dando como resultado un promedio de 14 CYPBM3 por cápside, correspondiente a una concentración efectiva (molaridad de confinamiento) de 4.9 mM (considerando un volumen interno para el CCMV de 4.7x10-21 L).
Finalmente, se evaluó la capacidad catalítica de la partícula CCMV-CYP para transformar el sustrato tamoxifen (Fig. 7). Las cápisdes virales fueron biocatalíticamente activas, encontrando una actividad específica de 3.58 min-1 para la transformación del profármaco. La actividad específica encontrada es un orden de magnitud más pequeña comparada con la encontrada para el CYP libre (kcat = 41.9 min-1). A pesar de la diminución en la velocidad de transformación del tamoxifen obtenida con las cápsides CCMV-CYP, esta actividad catalítica es similar a la reportada para citocromos P450 humanos. El CYP2D6, uno de los citocromos que participa más activamente en metabolizar el tamoxifen, fue capaz de transformar el profármaco en 4-hidroxitamoxifen y N-desmetiltamoxifen a una velocidad de 1.17 nmoles nmoles-1 CYP min-1 y 2.6 nmoles nmoles-1 CYP min-1 respectivamente, la actividad fue medida utilizando al NADPH como donador de electrones (Crewe et al., 2002). Asimismo, el CYP3A4 mostró una velocidad de transformación del tamoxifen a N-desmetiltamoxifen de 1.2 nmoles nmoles-1 CYP min-1 (Boocock et al., 2002). Los reportes de actividad por CYP humanos para la transformación del tamoxifen son limitados y en muchos casos díficiles de extrapolar a las unidades de actividad utilizadas en este trabajo (min-1) (Coller et al., 2002; Desta et al., 2004) debido a que la mayoría de las mediciones se reportan en miligramos de proteína total provenientes de microsomas de hígado humano, en donde se encuentran otras proteínas presentes además del CYP.
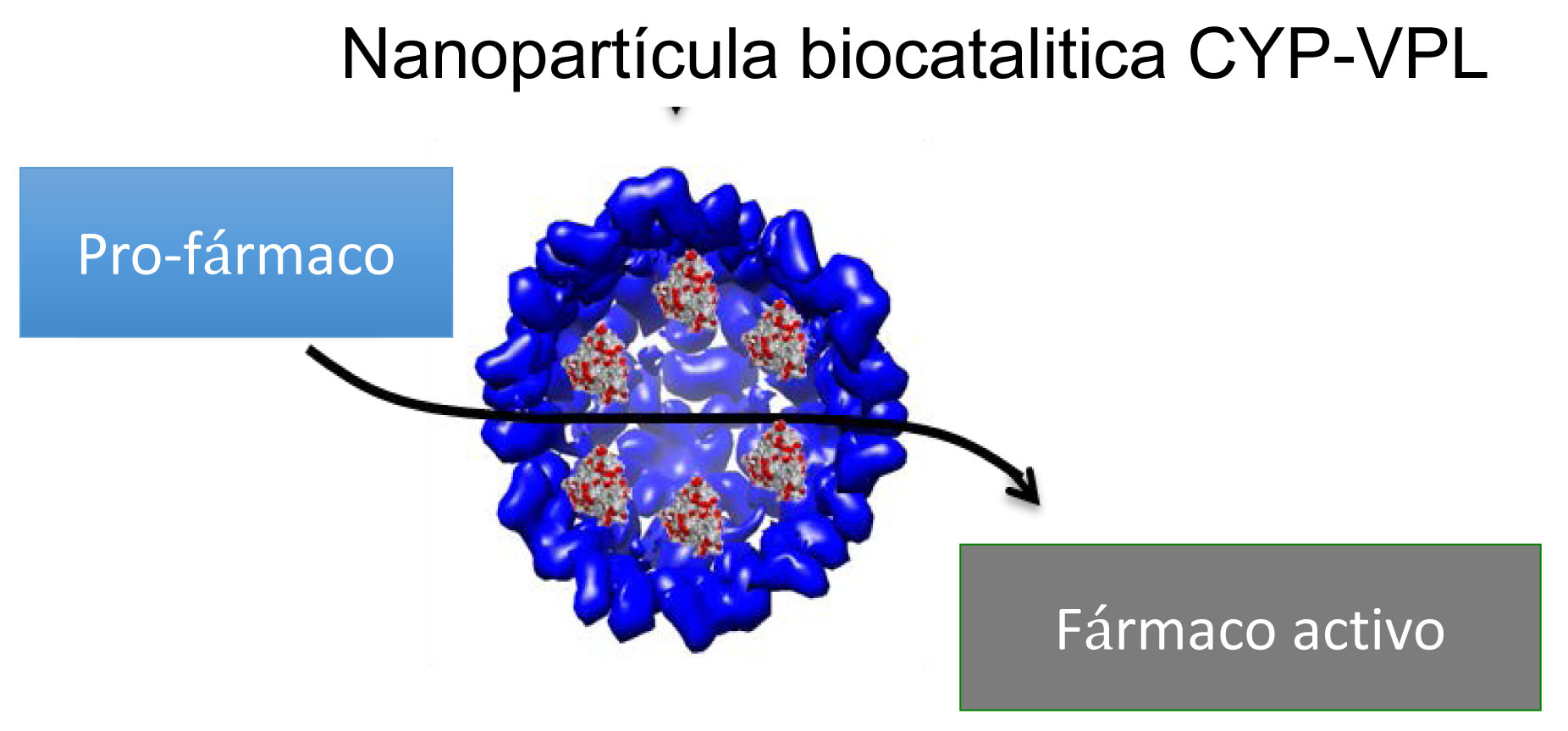
Figura 7. Diagrama de la transformación de pro-fármacos por medio de las nanopartículas biocataliticas conteniendo actividad citocromo P450
Conclusiones
Se llevó a cabo con éxito la encapsulación del CYPBM3 "21B3" en cápisdes virales de CCMV. La estrategia involucró una fuerza motriz que dirige la incorporación de la enzima al interior de las cápsides de manera selectiva. Por un lado, cargas electrostáticas complementarias permitieron dirigir la encapsulación del CYP selectivamente hacia el interior de la cápside del CCMV para generar partículas con actividad catalítica. La ventaja fundamental de esta estrategia radicó en que no fue necesaria ninguna modificación química ni genética a ninguna de las proteínas involucradas.
El CYPBM3 "21B3" fue una excelente enzima modelo para probar el principio de encapsulación de actividad CYP dentro de cápisdes virales, debido a su fácil producción, solubilidad, capacidad de utilizar peróxido de hidrógeno como ventaja operacional, y capacidad de transformar una variedad de sustratos, entre ellos medicamentos anticancerígenos en sus metabolitos activos.
La construcción de nanoreactores, a base de cápsides virales con CYP en su interior, presentan el primer paso en la generación de sistemas para el transporte y suministro de actividad enzimática CYP, que tienen potencial para ser utilizados para hacer más eficientes las terapias actuales contra el cáncer. Sin embargo, aún quedan varios desafios antes de poder desarrollar una terapia para la activación de profármacos in situ. Es necesario suministrar junto con esta mutante del CYP una enzima que genere cantidades importantes de peróxido, o bien, encapsular el CYPBM3 con el dominio reductasa incluido, con la finalidad de contar con un sistema autosuficiente dentro de la célula que pueda generar el medicamento activo dentro del tumor. Además, en una etapa posterior, la cápside deberá ser funcionalizada para dirigir la nanopartícula a los sitios de interés, acoplando ligandos afines a receptores que se encuentren presentes en células tumorales; así como para contender con su inmunogenicidad, recubriendo la partícula con polímeros biocompatibles.
Bibliografía
Abbing A, Blaschke U, Grein S, Kretschmar M, Stark CMB, Thies MJW, Walter J, Weigand M, Woith DC, Hess J, Reiser COA. (2004). Efficient intracellular delivery of a protein and a low molecular weight substance via recombinant polyomavirus-like particles. Journal of Biological Chemistry 279: 27410-27421.
Adolph KW, Butler PJG. (1974). Studies on the assembly of a spherical plant virus: I. States of aggregation of the isolated protein. Journal of Molecular Biology 88: 327–341.
Al-Lazikani B, Banerji U, Workman P. (2012) Combinatorial drug therapy for cancer in the post-genomic era. Nature Biotechnology 30: 679-692.
Bamford DH, Grimes JM, Stuart DI. (2005). What does structure tell us about virus evolution? Current Opinion in Structural Biology 15: 655-663.
Boocock DJ, Brown K, Gibbs AH, Sanchez E, Turteltaub KW, White IN. (2002). Identification of human CYP forms involved in the activation of tamoxifen and irreversible binding to DNA. Carcinogenesis 23: 1897-1901.
Brauch H, Mürdter T, Eichelbaum M, Schwab M. (2009). Pharmacogenomics of Tamoxifen Therapy. Clinical Chemistry 55: 1770-1782.
Chen L, Waxman D. (2002). Cytochrome P450 Gene-directed Enzyme Prodrug Therapy (GDEPT) for Cancer. Current Pharmaceutical Design 8: 1405-1416.
Cirino P, Arnold F. (2003). A Self-Sufficient Peroxide-Driven Hydroxylation Biocatalyst. Angewandte Chemie International Edition 42: 3299-3301.
Coller J.K., Krebsfaenger N., Klein K., Endrizzi K., Wolbold R., Lang T., Nüssler A., Neuhaus P., Zanger U.M., Eichelbaum M., Mürdter T.E. (2002) The influence of CYP2B6, CYP2C9 and CYP2D6 genotypes on the formation of the potent antioestrogen Z-4-hydroxy-tamoxifen in human liver. British Journal of Clinical Pharmacology, 54: 157-167.
Comellas-Aragones M, Engelkamp H, Claessen VI, Sommerdijk NA, Rowan AE, Christianen PC, Maan JC, Verduin BJ, Cornelissen JJ, Nolte RJ. (2007). A virus-based single-enzyme nanoreactor. Nature Nanotechnology 2: 635-639.
Crewe H.K., Ellis S.W.,. Lennard M.S., Tucker G.T. (1997) Variable contribution of cytochromes P450 2D6, 2C9 and 3A4 to the 4-hydroxylation of tamoxifen by human liver microsomes. Biochemical Pharmacology 53: 171-178.
Dachs GU, Tupper J, Tozer GM. (2005). From bench to bedside for gene-directed enzyme prodrug therapy of cancer. Anticancer Drugs 16: 349-359.
Desta Z., Ward B.A., Soukhova N.V., Flockhart D.A. (2004) Comprehensive evaluation of tamoxifen sequential biotransformation by the human cytochrome P450 system in vitro: Prominent roles for CYP3A and CYP2D6. Journal of Pharmacology and Experimental Therapeuthics 310: 1062-1075.
Douglas T, Young M. (2006). Viruses: Making friends with old foes. Science 312: 873-875.
Douglas T, Strable E, Willits D, Aitouchen A, Libera M, Young M. (2002). Protein Engineering of a Viral Cage for Constrained Nanomaterial Synthesis. Advanced Materials 14: 415-418.
Engelkamp H, Hatzakis NS, Hofkens J, De Schryver FC, Nolte RJ, Rowan AE. (2006). Do enzymes sleep and work? Chemical Communications: 935-940.
Fiedler J, Brown S, Brown SD, Lau JL, Finn MG. (2010). RNA-directed packaging of enzymes within virus-like particles. Angewandte Chemie International Edition 49: 9648-9651.
Francis RJ, Sharma SK, Springer C, Green AJ, Hope-Stone LD, Sena L, Martin J, Adamson KL, Robbins A, Gumbrell L, O'Malley D, Tsiompanou E,Shahbakhti H, Webley S, Hochhauser D, Hilson AJ, Blakey D, Begent RH. (2002). A phase I trial of antibody directed enzyme prodrug therapy (ADEPT) in patients with advanced colorectal carcinoma or other CEA producing tumours. British Journal of Cancer 87: 600-607.
Günther C, Schmidt U, Rudolph R, Böhm G. (2001). Protein and peptide delivery via engineered polyomavirus-like particles. FASEB Journal 15: 1646-1648
Hetch J, Waxman D. (2000). Selection of Cytochrome P450 Genes for Use in Prodrug Activation-Based Cancer Gene Therapy. Methods in Molecular Medicine 35: 77-83.
Hooker J, Datta A, Botta M, Raymond KN, Francis MB. (2007). Magnetic Resonance Contrast Agents from Viral Capsid Shells: A Comparison of Exterior and Interior Cargo Strategies. Nano Letters 7: 2207-2210.
Hoskins JM, Carey LA, McLeod HL. (2009). CYP2D6 and tamoxifen: DNA matters in breast cancer. Nature Reviews Cancer 9: 576-586.
Huttunen K, Mähönen N, Raunio H, Rautio J. (2008). Cytochrome P450-Activated Prodrugs: Targeted Drug Delivery. Current Medicinal Chemistry 15: 2346-2365.
Ingelman-Sundberg, M. (2004). Genetic polymorphisms of cytochrome P450 2D6 (CYP2D6): clinical consequences; evolutionary aspects and functional diversity. Pharmacogenomics Journal 5: 6-13.
Inoue T, Kawano MA, Takahashi RU, Tsukamoto H, Enomoto T, Imai T, Kataoka K, Handa H. (2008). Engineering of SV40-based nano-capsules for delivery of heterologous proteins as fusions with the minor capsid proteins VP2/3. Journal of Biotechnology 134: 181-192.
Iyer AK, Khaled G, Fang J, Maeda H. (2006). Exploiting the enhanced permeability and retention effect for tumor targeting. Drug Discovery Today 11: 812-818.
Johnson MD, Zuo H, Lee K-H, Trebley JP, Rae JM, Weatherman RV, Desta Z, Flockhart DA, Skaar TC. (2004). Pharmacological characterization of 4-hydroxy-N-desmethyl tamoxifen; a novel active metabolite of tamoxifen. Breast Cancer Research Treatment 85: 151-159.
Kang S, Douglas T. (2010). Some enzymes just need a space of their own. Science 327: 42-43.
Kim DH, Ahn T, Jung H-C, Pan J-G, Yun C-H. (2009) Generation of the human metabolite piceatannol from the anticancer-preventive agent resveratrol by bacterial cytochrome P450 BM3. Drug Metab Dispos 37: 932-6.
Lavelle L, Gingery M, Phillips M, Gelbart WM, Knobler CM, Cadena-Nava RD, Vega-Acosta JR, Pinedo-Torres LA, Ruiz-Garcia J. (2009). Phase diagram of self-assembled viral capsid protein polymorphs. Journal of Physical Chemistry B 113: 3813-3819.
Lee A, Z Niu, Wang Q. (2009). Viruses and Virus-Like Protein Assemblies—Chemically Programmable Nanoscale Building Blocks. Nano Research 2: 349-364.
Liepold LO, Revis J, Allen M, Olrtogge L, Young M y Douglas T. (2005). Structural Transitions in Cowpea chlorotic mottle virus (CCMV). Physical Biology 2: S166–S172.
Lin LL, Lien CY, Cheng YC, Ku KL. (2007). An effective sample preparation approach for screening the anticancer compound piceatannol using HPLC coupled with UV and fluorescence detection. Journal of Chromatography B 853: 175-182.
Lipin DI, Chuan YP, Lua LH, Middelberg AP. (2008). Encapsulation of DNA and non-viral protein changes the structure of murine polyomavirus virus-like particles. Archives of Virology 153: 2027-39.
Manchester M, Steinmetz N. (2009). Virus and Nanotechnology. Current Topics in Microbiology and Immunology 327: v-vi.
McFadyen M, Melvin W, Murray GI. (2004). Cytochrome P450 enzymes: Novel options for cancer therapeutics. Molecular Cancer Therapeutics 3: 363-371.
Minten IJ, Claessen V, Blank K, Rowan AE, Nolte RJ, Cornelissen JJ. (2011). Catalytic capsids: the art of confinement. Chemical Science 2: 358-362.
Minten IJ, Nolte RJ, Cornelissen JJ. (2010). Complex assembly behavior during the encapsulation of green fluorescent protein analogs in virus derived protein capsules. Macromolecular Bioscience 10: 539 – 545.
Niculescu-Duvaz I, Springer CJ. (1997). Antibody-directed enzyme prodrug therapy (ADEPT): a review. Advanced Drug Delivery Reviews 26: 151-172.
Notley L, de Wolf C, Wunsch R, Lancaster R, Gillam E. (2002). Bioactivation of tamoxifen by recombinant human cytochrome P450 enzymes. Chemical Research in Toxicology 5: 614-622.
O'Neil A, Prevelige PE, Douglas T. (2013). Stabilizing viral nano-reactors for nerve-agent degradation. Biomaterials Science 1: 881-886.
O'Neil A, Prevelige PE, Basu G, Douglas T. (2012). Coconfinement of fluorescent proteins: spatially enforced communication of GFP and mCherry encapsulated within the P22 capsid. Biomacromolecules 13: 3902-3907.
O'Neil A, Reichhardt C, Johnson B, Prevelige Jr PE, Douglas T. (2011). Genetically Programmed In Vivo Packaging of Protein Cargo and Its Controlled Release from Bacteriophage P22. Angewandte Chemie International Editon 50: 7425-7428.
Osborne CK. (1998). Tamoxifen in the treatment of breast cancer. New England Journal of Medicine 339: 1609-1618.
Patterson DP, Schwarz B, Waters RS, Gedeon T, Douglas T. (2014). Encapsulation of an Enzyme Cascade within the Bacteriophage P22 Virus-Like Particle. ACS Chemmical Biology 9: 359-365.
Patterson D, Prevelige P, Douglas T. (2012). Nanoreactors by programmed enzyme encapsulation inside the capsid of the bacteriophage P22. ACS Nano 6: 5000-5009.
Patterson D, Shwarz B, El-Boubbou K, Oost J, Prevelige P, Douglas T. (2012 b). Virus-like particle nanoreactors: programmed encapsulation of the thermostable CelB glycosidase inside the P22 capsid. Soft Matter 8: 10158-10166.
Peer D, Karp JM, Hong S, Farokhzad OC, Margalit R, Langer R. (2007). Nanocarriers as an emerging platform for cancer therapy. Nature Nanotechnology 2: 751-760.
Perez EA. (2007). Safety profiles of tamoxifen and the aromatase inhibitors in adjuvant therapy of hormone responsive early breast cancer. Annals of Oncology 18 (Suppl. 8): 26-35.
Pirola L, Fröjdö S. (2008). Resveratrol: one molecule, many targets. International Union of Biochemistry and Molecular Biology Life 60: 323-332.
Ren Y, Wong S, Lim L. (2007). Folic Acid-Conjugated Protein Cages of a Plant Virus: A Novel Delivery Platform for Doxorubicin. Bioconjugate Chemistry 18: 836-843.
Rochat B. (2005). Role of cytochrome P450 activity in the fate of anticancer agents and in drug resistance. Focus on Tamoxifen, Paclitaxel and Imatinib metabolism. Clinical Pharmacokinetics 44: 349-366.
Sánchez-Sánchez L., Cadena R.D., Palomares L.A., Ruiz-Garcia J., Koay M.S.T., Cornelissen J.J.M.T. and Vazquez-Duhalt R. (2014) Chemotherapy pro-drug activation by biocatalytic virus-like nanoparticles containing cytochrome P450. Enzyme Microb. Technol. 60: 24-31.
Strable E, Finn MG. (2009). Chemical Modification of Viruses and Virus-Like Particles. Current Topics in Microbiology and Immunology 327: 1-18.
Tanaka S, Sawaya MR, Yeates TO. (2010). Structure and mechanisms of a protein-based organelle in Escherichia coli. Science 327: 81-84.
Torchilin V. (2011). Tumor delivery of macromolecular drugs based on the EPR effect. Advanced Drug Delivery Reviews 63: 131-135.
Verma I, Weitzma M. (2005). Gene therapy: Twenty-first century medicine. Annual Review of Biochemistry 74: 711-738.
Wörsdörfer B, Woycechowsky KJ, Hilvert D. (2011). Directed evolution of a protein container. Science 331: 589-592.
Xu G, McLeod H. (2001). Strategies for Enzyme/Prodrug Cancer Therapy. Clinical Cancer Research 7: 3314-3324.
COMENTARIOS
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
2013 Esta obra está bajo una licencia de Creative Commons