Revista Digital UniversitariaPublicación bimestral
Vol. 18, Núm. 6julio-agosto 2017ISSN: 1607 - 6079
Resumen
Los hongos producen una gran variedad de compuestos tóxicos, conocidos como micotoxinas, que son de gran importancia debido a que se encuentran presentes como contaminantes de alimentos de consumo humano y animal, principalmente en cereales los cuales son la base de la alimentación en México y en países en desarrollo. Los efectos adversos de las micotoxinas incluyen problemas en el crecimiento infantil, defectos en el desarrollo del tubo neuronal, daños al sistema inmunológico, enfermedades renales, y mayores probabilidades de desarrollar cáncer de hígado y esófago. Por lo cual, su estudio es de gran importancia en lo que respecta a la salud pública.Palabras clave: micotoxina, aflatoxinas, fumonisinas, tricotecenos, ocratoxina, salud pública.
Mycotoxins: What are they and how do they affect public health?
Fungi produce a variety of toxic compounds, known as mycotoxins, which are of great importance because they are found as contaminants of foodstuffs for human and animal consumption, mainly cereals which are the basis of nutrition in Mexico and in developing countries. The adverse effects of mycotoxins include child growth impairment, defects in neural tube development, damage to the immune system, kidney diseases, and increased chance of developing liver and esophageal cancer. Therefore, its study is of great importance in terms of public health.Keywords: mycotoxin, aflatoxins, fumonisins, trichothecenes, ochratoxin, public health.
Introducción
 |
[...] varias especies de hongos pueden representar un peligro para la salud humana y animal, así como una amenaza para la actividad agrícola, debido a que pueden ser patógenos de una gran variedad de especies de todos los grupos biológicos, y son capaces de producir compuestos tóxicos con efectos negativos [...] | |
 |
||
Estos efectos adversos pueden deberse en particular a toxinas que varias especies de hongos son capaces de producir. Una toxina es una sustancia venenosa producida por células vivas de animales, plantas, bacterias, hongos y otros organismos biológicos (Desjardins y Hohn, 1997). Las toxinas de los hongos son conocidas como micotoxinas, y son producidas principalmente por mohos. Las micotoxinas se encuentran entre los contaminantes de alimentos más importantes que deben ser controlados con el objetivo de proteger la salud pública en todo el mundo (Wu, Groopman y Pestka, 2014).
El impacto económico incluye la pérdida de vidas humanas y animales, aumento en tratamientos médicos y veterinarios, eliminación de alimentos contaminados, la pérdida de producción agrícola, entre otros (Wu et al., 2014). A continuación se describen brevemente las principales micotoxinas producidas por hongos patógenos de plantas, comúnmente encontradas en alimentos de origen vegetal, y se comentan sus efectos adversos sobre la salud humana y animal.
Aspectos generales de las micotoxinas
Bennett (1987) definió las micotoxinas como “compuestos naturales de bajo peso molecular producidos por hongos microscópicos que generan una respuesta tóxica cuando son introducidos en concentraciones bajas en animales por una ruta natural”. Las rutas naturales incluyen la ingestión, el contacto con la piel, la inhalación, entre otros (Bennett, 1987). En la definición, se excluyen otros compuestos fúngicos que son tóxicos contra bacterias, protozoarios y animales menos complejos como insectos (Frisvad, Thrane, Samson y Pitt, 2006). Además, se excluyen las toxinas producidas por setas debido a que, aunque son compuestos producidos por hongos que pueden causar enfermedades y la muerte en humanos y otros animales, la ingestión de éstas no es accidental como se da en alimentos contaminados con mohos, sino que es dada por errores en la diferenciación entre una especie fúngica comestible y una especie venenosa (Moss, 1996).A pesar de que existen diferencias geográficas y climáticas en la producción y presencia de micotoxinas en los cultivos, la exposición a dichas sustancias ocurre a nivel mundial (Kuiper-Goodman, 2004). Las enfermedades que causan las toxinas de hongos son llamadas micotoxicosis (Bryden, 2012) y el consumo de una dieta contaminada produce efectos agudos y crónicos; generalmente los efectos son teratogénicos (defectos congénitos durante la gestación), carcinogénicos, estrogénicos e inmunosupresivos (Abrunhosa et al., 2014).
Dentro del ámbito pecuario, el principal problema asociado con la intoxicación por toxinas fúngicas es la reducción en la productividad de los animales, esto debido a una disminución o al rechazo total del consumo de alimento, a la baja conversión (aprovechamiento) de los alimentos, la disminución del peso corporal, el aumento de la susceptibilidad a enfermedades y la reducción de la capacidad reproductiva, lo que conduce a grandes pérdidas económicas. Debido a que las micotoxinas afectan principalmente a los granos usados como alimento animal y de ahí pasa a la carne, leche y huevos, el consumo de tales productos tiene consecuencias directas para los humanos, ya que son la base de su dieta (Nesic, Ivanovic y Nesic, 2014).
Las micotoxinas contaminan principalmente cereales, los cuales se infestan con el hongo antes y durante la cosecha o el almacenamiento. Actualmente, más de 400 toxinas producidas por 350 especies de hongos han sido aisladas y caracterizadas; de éstas, las investigaciones se han enfocado en aquellas que causan daños significativos a humanos y animales (Brase, Encinas, Keck y Nising, 2009). Ejemplos de micotoxinas de gran importancia en salud pública incluyen aflatoxinas, tricotecenos, fumonisinas, ocratoxinas y zearalenona (Abrunhosa et al., 2014). Los efectos de dichas toxinas cuestan millones de dólares anualmente en pérdidas a nivel mundial en salud humana, animal y productos agrícolas (Vasanthi y Bhat, 1998).
Hongos que producen toxinas
A excepción de las fumonisinas, las micotoxinas tienen afinidad por los lípidos, por lo tanto, tienden a acumularse en la fracción grasa de plantas y animales (Zain, 2011). En general, las toxinas se clasifican de acuerdo a la especie fúngica de la que se aislaron, a su estructura química y al modo de acción. Sin embargo, una sola especie puede producir varias toxinas y una toxina puede ser producida por diferentes especies fúngicas (Fernández, Belío, Ramos, Sanz y Sáez, 1997; Zain, 2011).Las diferentes micotoxinas son producidas principalmente por cuatro géneros de hongos: Aspergillus, Fusarium, Penicillium y Alternaria (ver figura 1). Aunque existen otros géneros como Petromyces, Rosellina, Claviceps, Phomopsis, Pithomyces, Stachybotrys y Monascus, que presentan especies productoras de micotoxinas (véase cuadro 1). A diferencia de los efectos negativos sobre la salud humana y animal, las funciones naturales de las micotoxinas no han sido claramente establecidas, pero se cree que participan en la eliminación de otros microorganismos que compiten en el mismo ambiente. Además, se piensa que ayudan a los hongos patógenos a invadir los tejidos del hospedero (Brase et al., 2009).

Figura 1. Ejemplo de los principales hongos productores de micotoxinas en alimentos de consumo humano y animal. a) cacahuate contaminado con Aspergillus sp., b) mazorca de maíz infestada con Fusarium sp., c) daños ocasionados por Penicillium sp. en espiga de sorgo, y d) jitomate contaminado con Alternaria sp.
Cuadro 1. Especies fúngicas productoras de micotoxinas de importancia biológica y económica en humanos, animales y agricultura.
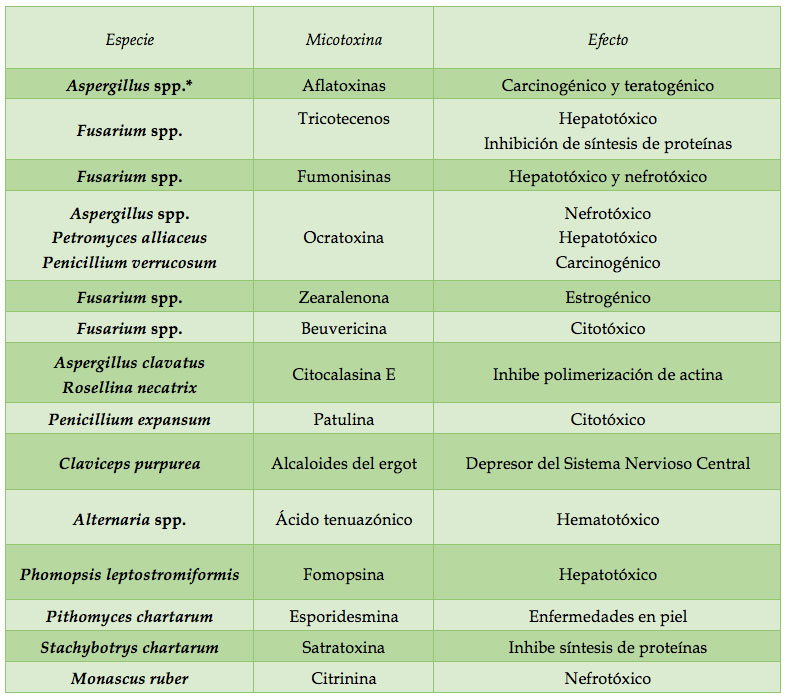
Fuente: la información de la tabla fue obtenida de: Desjardins y Hohn, 1997; Frisvad et al., 2006; Richard, 2007; Brase et al., 2009; Abrunhosa et al., 2014; Adam, Wiesenberger y Guldener, 2015.
*spp. indica que son varias las especies del género las que producen esa toxina.
Tipos y descripción de micotoxinas
Aflatoxinas
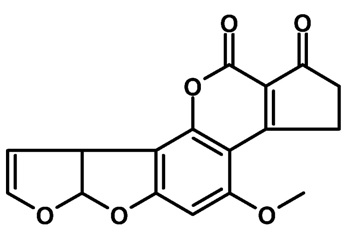
Figura 2. Estructura química de la aflatoxina B1 causante de la enfermedad X en guajolotes. Las aflatoxinas son un grupo de aproximadamente 20 compuestos, producidos por especies del género Aspergillus. El término “aflatoxina” fue acuñado en Inglaterra en la década de 1960, cuando miles de guajolotes que fueron alimentados con harina de cacahuate contaminada con la micotoxina murieron a causa de una enfermedad desconocida que se denominó enfermedad “X” de los guajolotes (Blount, 1961). Posteriormente se confirmó la presencia de una toxina del hongo Aspergillus flavus en el extracto del medio de crecimiento, la cual mostró toxicidad en ratas y patos (Lancaster, Jenkins y Philp, 1961). Las aflatoxinas contaminan cultivos básicos para la alimentación, incluyendo el maíz, el cacahuate y la nuez, causando trastornos agudos y crónicos sobre la población humana. La aflatoxina B1 (véase figura 2) es la más tóxica de todas, y se ha correlacionado con el carcinoma hepatocelular en humanos y en una amplia variedad de especies animales (Richard, 2007; Wu et al., 2014).
Fumonisinas
Las fumonisinas son producidas por especies del género Fusarium, siendo el maíz el cereal principalmente afectado por este grupo de toxinas, aunque se han encontrado en sorgo y arroz (Richard, 2007). Éstas fueron las primeras micotoxinas implicadas en enfermedades en humanos desde 1988; posteriormente, en Estados Unidos se observó que el maíz contaminado con mohos productores de fumonisinas causó la muerte de centenas de caballos y cerdos (Missmer et al., 2006). La fumonisina más común encontrada en maíz es la fumonisina B1 (FB1) (véase figura 3); mientras que las fumonisinas B2 y B3 (FB2 y FB3) son co-contaminantes comunes de cereales. Las condiciones exactas para que se dé la producción de micotoxinas en cereales no se conocen por completo, pero el estrés hídrico, seguido por clima cálido y, al final del crecimiento, clima húmedo parecen ser importantes para la producción (Richard, 2007).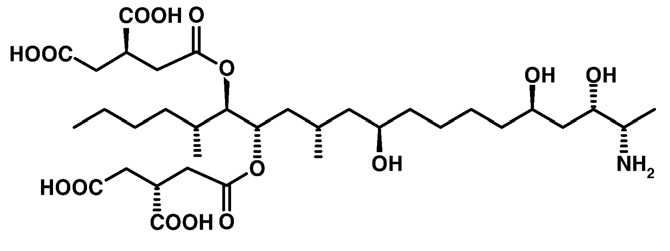
Figura 3. Estructura química de la fumonisina B1.
Tricotecenos
Además de las fumonisinas, el género Fusarium produce una familia diversa de toxinas (>200 metabolitos) conocida como tricotecenos, los cuales son ésteres de alcoholes sesquiterpenoides (molécula con 15 átomos de carbón) posicionados alrededor de un anillo tetracíclico (ver figura 4) que se caracteriza por un doble enlace entre el carbono 9 y 10 y un epóxido en el carbono 12 y 13 (Pestka, 2010). Los tricotecenos se producen en trigo, maíz, cebada, centeno y arroz después de la infección fúngica en el campo o como parte del deterioro poscosecha. La incidencia a nivel mundial de infecciones causadas por Fusarium en cereales, relacionada con la contaminación con tricotecenos, aumenta debido al cambio climático, el uso de cultivares de cereales altamente susceptibles, la rotación inapropiada de cultivos, y por la aplicación inadecuada de fungicidas (Starkey et al., 2007). Los tricotecenos del tipo A, son producidos por hongos del suelo y patógenos vegetales, y en el grupo se incluyen la toxina T-2 (ver figura 4a) y la toxina HT-2, las cuales se encuentran entre los miembros más tóxicos de esta familia de micotoxinas. Los tricotecenos del tipo B incluyen la toxina mejor estudiada y regulada, el deoxinivalenol (DON), también conocida como vomitoxina (ver figura 4b). Los metabolitos de este grupo son producidos por especies patógenas de cereales, presentan menor toxicidad que los miembros del grupo A, pero se producen en grandes concentraciones (Richard, 2007; Wu et al., 2014).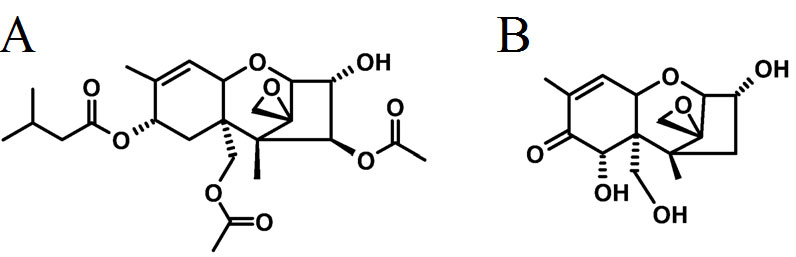
Figura 4. Estructura química de los tricotecenos de mayor importancia en salud pública. a) Toxina T-2 y b) Deoxinivalenol.
Ocratoxina
Las ocratoxinas (figura 5) son producidas principalmente por las especies fúngicas Penicillium verrucosum y Aspergillus ochraceus. Estas toxinas, pueden contaminar una amplia variedad de alimentos. Además, tienen la capacidad de acumularse en la sangre y leche de los animales expuestos a ellas. Entre los productos contaminados se encuentran los cereales y sus productos finales, nueces, frutos secos, especias, carne, leche, vino, cerveza, fórmulas infantiles y alimentos para bebés. Como la solubilidad de las ocratoxinas en agua es baja, se absorben por el tracto gastrointestinal uniéndose fuertemente a las proteínas de membrana. Esto resulta en la reabsorción en el riñón, y la recirculación enterohepática, por lo que la biotransformación y eliminación renal se disminuye, resultando en un tiempo de vida largo de las ocratoxinas en el cuerpo, de aproximadamente 35 días (Ringot, Chango, Schneider y Larondelle, 2006; Richard, 2007; Wu et al., 2014).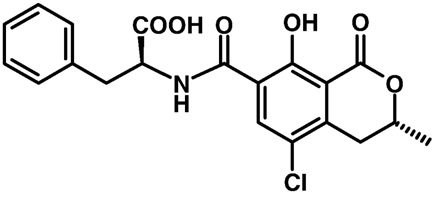
Figura 5. Estructura química de la ocratoxina A, micotoxina principal de este grupo.
Efecto de las micotoxinas en humanos y animales
En lo que se refiere a las aflatoxinas en humanos, se ha observado una correlación entre el consumo de alimento contaminado con estas toxinas y el desarrollo de cáncer de hígado. Por tal motivo, la Organización Mundial de la Salud (OMS) en conjunto con la Agencia Internacional para la Investigación en Cáncer (WHO-IARC, por sus siglas en inglés) han evaluado los efectos de las aflatoxinas, y para 1993, las clasificaron en grupos, destacando al grupo 1 como una mezcla que ocurre naturalmente y que probablemente favorece el desarrollo del cáncer de hígado (WHO-IARC, 1993). Además, existen casos de aflatoxicosis agudas con manifestaciones clínicas que incluyen vómito, dolor abdominal, edema pulmonar e infiltración de grasa (Wu et al., 2014).Un ejemplo reportado sobre el consumo de alimentos contaminados con aflatoxinas se dio en el occidente de la India en la década de 1970, donde el consumo de maíz contaminado causó envenenamiento y provocó la muerte de al menos 97 personas (Krishnamachari, Bhat, Nagarajan y Tilak, 1975). En reportes más recientes, en el año 2004, maíz contaminado con aflatoxinas causó uno de los brotes más grandes de aflatoxicosis en Kenia, resultando en 317 casos de intoxicación y 125 muertes (Azziz-Baumgartner et al., 2005).
La exposición a aflatoxinas (dosis-dependiente) también ha sido relacionada con el retraso en el crecimiento infantil, una condición en la cual la altura de los niños está por debajo de la referencia de crecimiento establecida por la Organización Mundial de la Salud (WHO-IARC, 1993). Este tipo de estudio es importante desde el punto de vista de salud pública, debido a que se ha asociado la intoxicación infantil con vulnerabilidad a enfermedades infecciosas y deficiencias en el aprendizaje (Khlangwiset, Shephard y Wu, 2011). Además, se ha demostrado que la ingesta de alimentos contaminados con aflatoxinas en mujeres en etapa de lactancia condujo a un menor peso y talla de los bebés lactantes (Mahdavi, Nikniaz, Arefhosseini y Vahed-Jabbari, 2010).
Por otro lado, las fumonisinas inhiben la síntesis de ceramida, sustancia que es importante para la biosíntesis de esfingolípidos, los cuales tienen múltiples funciones en el cuerpo (formando membranas, induciendo o inhibiendo la proliferación celular, etc.). La exposición prolongada a las fumonisinas causa enfermedades como leucoencefalomalacia en caballos, edema pulmonar, reducción de la ganancia de peso y daño del hígado en cerdos (Sydenham, Marasas, Shephard, Thiel y Hirooka, 1992; Rotter et al., 1996). La exposición a las fumonisinas puede ser un factor de riesgo para el desarrollo de cáncer de esófago en humanos. Esta asociación fue propuesta por primera vez en poblaciones de Sudáfrica que desarrollaron cáncer de esófago de manera inusual cuando su consumo de maíz contaminado con grandes cantidades de fumonisinas aumentó (Missmer et al., 2006).
Otra patología observada en humanos causada por el consumo de fumonisinas son los defectos en los tubos neurales (DTN), alteraciones embriónicas y de la médula espinal que resultan en la falla del cierre del tubo neural en el útero (Marasas et al., 2004). Dos DTN comunes son la espina bífida, en la cual la columna espinal fetal no cierra completamente en el primer mes de desarrollo, resultando comúnmente en daño nervioso y en la parálisis de las piernas, y la anencefalia, en la cual una gran porción del cerebro no se desarrolla, conduciendo a la muerte del feto o a la muerte poco después del nacimiento. En términos de salud pública, el consumo del folato materno, especialmente en el primer trimestre, es crítico para reducir los riesgos de DTN en fetos. Debido a que las fumonisinas alteran el metabolismo de esfingolípidos, y por lo tanto el transporte de folato a través de las membranas celulares (Missmer et al., 2006), dichas toxinas pueden ser un factor de riesgo para el desarrollo de DTN en poblaciones humanas donde el consumo de folato es bajo, el consumo de maíz es alto, y el clima y la contaminación del ambiente son favorables para la acumulación de fumonisinas (Wu et al., 2014).
 |
[...] la contaminación de alimentos con micotoxinas a nivel mundial es un problema importante para la salud pública, ya que dichas sustancias ponen en riesgo la vida de quienes las consumen en alimentos contaminados. Además, los tratamientos, las medidas preventivas y el manejo de los productos agrícolas infestados causan pérdidas económicas de millones de dólares anualmente. | |
 |
||
Por último, las ocratoxinas han sido asociadas con problemas renales. Estudios de laboratorio mostraron que la exposición a estas toxinas causa una disminución en el funcionamiento del riñón, pudiendo llegar a inducir adenomas renales o carcinomas (Wu et al., 2014). Aunque el riñón es el órgano principalmente afectado por las ocratoxinas, otros efectos adversos han sido observados en hámsteres, incluyendo anomalías cardiacas y hepáticas, así como lesiones del tracto gastrointestinal y de tejido linfoide (Hagelberg, Hult y Fuchs, 1989). Además, estas micotoxinas pueden cruzar la placenta y acumularse en el tejido fetal, induciendo malformaciones del feto (Wu et al., 2014). Debido a la evidencia en estudios animales, las ocratoxinas están consideradas como un grupo 2B de posibles carcinógenos para humanos (WHO-IARC, 1993).
Para contestar a la pregunta inicial, la contaminación de alimentos con micotoxinas a nivel mundial es un problema importante para la salud pública, ya que dichas sustancias ponen en riesgo la vida de quienes las consumen en alimentos contaminados. Además, los tratamientos, las medidas preventivas y el manejo de los productos agrícolas infestados causan pérdidas económicas de millones de dólares anualmente.
Bibliografía
Abrunhosa, L., Morales, H., Soares, C., Calado, T., Vila-Chã, A. S., Pereira, M. y Venâncio A. (2014). A review of mycotoxins in food and feed products in Portugal and estimation of probable daily intakes. Critical Reviews in Food Science and Nutrition. DOI: 10.1080/10408398.2012.720619.
Azziz-Baumgartner, E., Lindblade, K., Gieseker, K., Schurz-Rogers, H., Kieszak, S., Njapau, H., Aflatoxin Investigative Group (2005). Case-control study of an acute aflatoxicosis outbreak, Kenya, 2004. Environmental Health Perspectives. 113(12), 1779-1783.
Bennett, J. W. (1987). Mycotoxins, mycotoxicoses, mycotoxicology and mycopathologia. Mycopathologia. 100(1), 3-5.
Blount, W. P. (1961). Turkey “x” disease. Journal of British Turkey Federation. 9(52), 52-61.
Brase, S., Encinas, A., Keck, J. y Nising, C. F. (2009). Chemistry and biology of mycotoxins and related fungal metabolites. Chemical Reviews. 109(9), 3903-3990.
Bryden, W. L. (2012). Mycotoxin contamination of the feed supply chain: implications for animal productivity and feed security. Animal Feed Science and Technology. 173(1-2), 134-158.
Desjardins, A. E. y Hohn, T. M. (1997). Mycotoxins in Plant Pathogenesis. Molecular Plant Microbe Interactions. 10(2), 147-152.
Fernández, A., Belío, R., Ramos, J. J., Sanz, M. C. y Sáez, T. (1997). Aflatoxins and their metabolites in the tissues, faeces and urine from lambs feeding on an aflatoxin-contaminated diet. Journal of the Science of Food and Agriculture. 74(2), 161-168.
Frisvad, J. C., Thrane, U., Samson, R. A. y Pitt, J. I. (2006). Importance mycotoxins and the fungi which produce them. En A. D. Hocking, J. I. Pitt, R. A. Samson, y U. Thrane (eds.), Advances in Food Mycology. Volume 571 of the series Advances in Experimental Medicine and Biology (pp. 3-31). Estados Unidos: Springer.
Hagelberg, S., Hult, K. y Fuchs, R. (1989). Toxicokinetics of ochratoxin A in several species and its plasma-binding properties. Journal Applied Toxicology. 9(2), 91-96.
Keller, N. P., Turner, G. y Bennett, J. W. (2005). Fungal secondary metabolism - from biochemistry to genomics. Nature Reviews Microbiology. 3, 937-947.
Khlangwiset, P., Shephard, G. S. y Wu, F. (2011). Aflatoxins and growth impairment: a review. Critical Reviews in Toxicology. 41(9), 740-755.
Knox, B. y Keller, N. (2015). Key players in the regulation of fungal secondary metabolism. En S. Zeilinger, J. F. Martín, y C. García-Estrada (eds.), Biosynthesis and Molecular Genetics of Fungal Secondary Metabolites (pp. 13-28). New York: Springer.
Krishnamachari, K. A. V. R., Bhat, R. V., Nagarajan, V. y Tilak, T. B. G. (1975). Hepatitis due to aflatoxicosis an outbreak in western India. The Lancet. 305(7915), 1061-1063.
Kuiper-Goodman, T. (2004). Risk assessment and risk management of mycotoxins in food. En N. Magan, y M. Olsen (eds.), Mycotoxins in food. Detection and control (pp. 3-31). Reino Unido: Woodhead Publishing Limited, Cambridge.
Lancaster, M. C., Jenkins, F. P. y Philp, J. M. (1961). Toxicity associated with certain samples of groundnuts. Nature. 192, 1095-1096.
Mahdavi, R., Nikniaz, L., Arefhosseini, S. R. y Vahed-Jabbari, M. (2010). Determination of aflatoxinM1 in breast milk samples in Tabriz–Iran. Maternal and Child Health Journal. 14, 141-145.
Marasas, W. F. O., Riley, R. T., Hendricks, K. A., Stevens, V. L., Sadler, T. W., van Waes, J. G. y Merril Jr, A. H. (2004). Fumonisins disrupt sphingolipid metabolism, folate transport, and neural tube development in embryo culture and in vivo: a potential risk factor for human neural tube defects among populations consuming fumonisin-contaminated maize. The Journal of Nutrition. 134(4), 711-716.
Missmer, S. A., Suarez, L., Felkner, M., Wang, E., Merril Jr, A. H., Rothman, K. J. y Hendricks, K. A. (2006). Exposure to fumonisins and the occurrence of neural tube defects along the Texas–Mexico border. Environmental Health Perspectives. 114(2), 237-241.
Moss, M. O. (1996). Mycotoxins. Mycological Research, 100(5), 513-523.
Nesic, K., Ivanovic, S. y Nesic, V., (2014). Fusarial Toxins: Secondary Metabolites of Fusarium Fungi. En: D. M. Whitacre (Ed.), Reviews of Environmental Contamination and Toxicology. Vol. 228 (pp. 101-120). Suiza: Springer.
Pestka, J. J. (2010). Toxicological mechanisms and potential health effects of deoxynivalenol and nivalenol. World Mycotoxin Journal. 3(4), 323-347.
Richard, J. L. (2007). Some major mycotoxins and their mycotoxicose - An overview. International Journal of Food Microbiology. 119(1-2), 3-10.
Ringot, D., Chango, A., Schneider, Y. J. y Larondelle, Y. (2006). Toxicokinetics and toxicodynamics of ochratoxin A, an update. Chemico-Biological Interactions. 159(1), 18-46.
Rotter, B. A., Thompson, B. K., Prelusky, D. B., Trenholm, H. L., Stewart, B., Miller, J. D. y Savard, M. E. (1996). Response of growing swine to dietary exposure to pure fumonisin B1 during an eight-week period: growth and clinical parameters. Natural Toxins. 4(1), 42-50.
Starkey, D. E., Ward, T. J., Aoki, T., Gale, L. R., Kistler, H. C., Geiser, D. M. y O´Donnell, K. (2007). Global molecular surveillance reveals novel Fusarium head blight species and trichothecene toxin diversity. Fungal Genetics and Biology. 44(11), 1191-1204.
Sydenham, E. W., Marasas, W. F. O., Shephard, G. S., Thiel, P. G. y Hirooka, E. Y. (1992). Fumonisin concentrations in Brazilian feeds associated with field outbreaks of confirmed and suspected animal mycotoxicoses. Journal of Agricultural and Food Chemistry. 40(9), 94-997.
Vasanthi, S. y Bhat, R. V. (1998). Mycotoxins in foods-occurrence, health & economic significance and food control measures. Indian Journal of Medical Research. 108, 212-224.
World Health Organization-International Agency for Research on Cancer (WHO-IARC) (1993). Toxins derived from Fusarium moniliforme: fumonisins B1 and B2 and fusarin C. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. 56, 445-462.
Wu, F., Groopman, J. D. y Pestka, J. J. (2014). Public health impacts of foodborne mycotoxins. Annual Review of Food Science and Technology. 5, 351-372.
Zain, M. E. (2011). Impact of mycotoxins on humans and animals. Journal of Saudi Chemical Society. 15(29), 129-144.
COMENTARIOS
REVISTA DIGITAL UNIVERSITARIA, Vol. 18, Núm. 6 julio-agosto 2017, es una publicación mensual editada por la Universidad Nacional Autónoma de México, Ciudad Universitaria, Delegación Coyoacán, CP 04510, Ciudad de México, a través de la Coordinación de Desarrollo Educativo e Innovación Curricular, Circuito Centro Cultural, s/n, Edificio del Centro de Investigación, Política, Población y Salud (CIPPS), 1er. Piso, Ciudad Universitaria, Del. Coyoacán, Ciudad de México. C.P. 04510, Tel. 56226666, Ext. 82300, http://www.revista.unam.mx/, correo: rdu@unam.mx, Editor responsable Melchor Sánchez Mendiola. Reserva de Derechos al Uso Exclusivo Núm. 04-2014-102011260500-203, ISSN 1607-6079, ambos otorgados por el Instituto Nacional de Derechos de Autor. Responsable de la última actualización de este número, Coordinación de Desarrollo Educativo e Innovación Curricular, Circuito Centro Cultural, s/n, Edificio del Centro de Investigación, Política, Población y Salud (CIPPS), 1er. piso, Ciudad Universitaria, Coyoacán, Ciudad de México. C.P. 04510. Fecha de última actualización: 9 de junio de 2017.
Las opiniones expresadas por los autores no necesariamente reflejan la postura del editor de la publicación. Se autoriza la reproducción total o parcial de los textos aquí publicados siempre y cuando se cite la fuente completa y la dirección electrónica de la publicación.
Las opiniones expresadas por los autores no necesariamente reflejan la postura del editor de la publicación. Se autoriza la reproducción total o parcial de los textos aquí publicados siempre y cuando se cite la fuente completa y la dirección electrónica de la publicación.