Aminoácidos no esenciales en la síntesis de nanopartículas de oro y sus potenciales aplicaciones
Vol. 22, núm. 3 mayo-junio 2021
Aminoácidos no esenciales en la síntesis de nanopartículas de oro y sus potenciales aplicaciones
Ana Aguilera Juárez, Carlos Angulo, Elizabeth Monreal Escalante y Luis Hernández Adame CitaResumen
Los aminoácidos son moléculas de gran importancia en la nutrición de los seres humanos. No obstante, hoy día en la ciencia de materiales, su uso se ha extendido hacia desarrollar métodos de síntesis, en los que se emplean aminoácidos como precursores reductores y estabilizadores, para obtener productos de interés. En este sentido, este trabajo aborda de manera sencilla el porqué estas biomoléculas poseen la capacidad de reducir sales de metales nobles, dando como resultado nanopartículas metálicas, como, por ejemplo, la formación de nanopartículas de oro (AuNPs).
Palabras clave: aminoácido, nanopartículas, agentes reductores.
Non-essential amino acids in gold nanoparticles synthesis
Abstract
Amino acids are molecules with great importance in human nutrition. However, nowadays in Materials Science, their use has been extended to develop novel synthesis methods where amino acids function as reducing and stabilizing precursors to obtain products of interest. In this sense, this work addresses in a simple way why these biomolecules can reduce noble metal salts, resulting in metallic nanoparticles, such as the formation of gold nanoparticles (AuNPs).
Keywords: amino acid, nanoparticles, reducing agents.
Introducción
Normalmente, al escuchar la palabra aminoácidos vienen a nuestra mente conceptos relacionados con la nutrición y alimentación. Y si es bien sabido que algunos de los aminoácidos que nuestro cuerpo necesita son obtenidos a partir de la ingesta de alimentos, tal vez no sea tan conocido que son la base para la formación de las proteínas, por lo que resultan fundamentales para que nuestro cuerpo realice infinidad de procesos. Asimismo, en la actualidad se ha demostrado que estas moléculas tienen aplicaciones innovadoras en ciencias distintas a las biológicas. Las propiedades fisicoquímicas de los aminoácidos propician que sean estructuras útiles en áreas como la ciencia de materiales y la nanotecnología.1
¿Qué son los aminoácidos químicamente?
Los aminoácidos (aa) son moléculas orgánicas compuestas principalmente de los elementos nitrógeno (N), hidrógeno (H), oxígeno (O) y carbono (C). Estos elementos a su vez dan lugar a dos grupos funcionales característicos de los aminoácidos: el grupo amino (-NH2) y carboxilo (-COOH) (Lehninger et al., 2000), los cuales pueden formar enlaces peptídicos que dan lugar a estructuras proteicas. Un esquema representativo de un aminoácido se muestra en la figura 1.
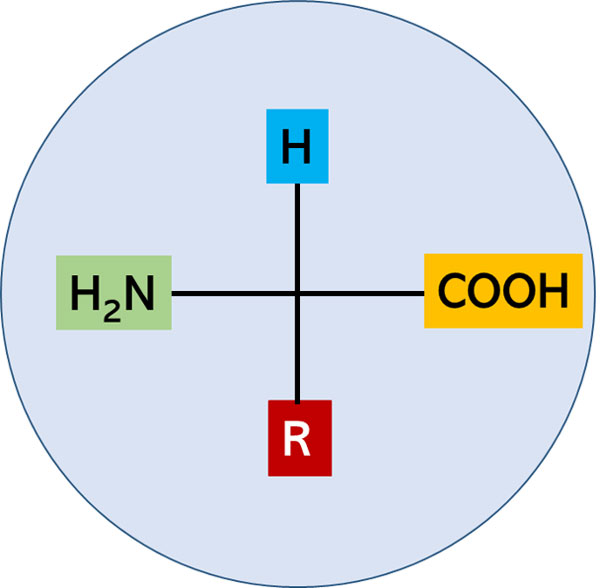
Figura 1. Representación de la estructura general de un aminoácido (aa). Los grupos amina (-H2N) y carboxilo (-COOH) están unidos por un carbono alfa (- Cα -). Este último además se une con un átomo de hidrógeno (-H) y el grupo R, que otorga identidad a cada aa.
La unión de dos aminoácidos mediante un enlace amida (peptídico) da lugar a un dipéptido (ver esquema en figura 2). Si se uniera un tercer aminoácido se daría lugar a un tripéptido, y así sucesivamente hasta formar un polipéptido (10-50 aminoácidos) o una proteína (más de 50 aminoácidos). En la estructura del aminoácido, el primer carbono que se encuentra a continuación del carbono del grupo carboxilo se denomina carbono alfa (α) (ver figura 2). Además, los aminoácidos cuentan con un grupo funcional “R” que diferencia a un aminoácido de otro (Mathews et al., 1998).
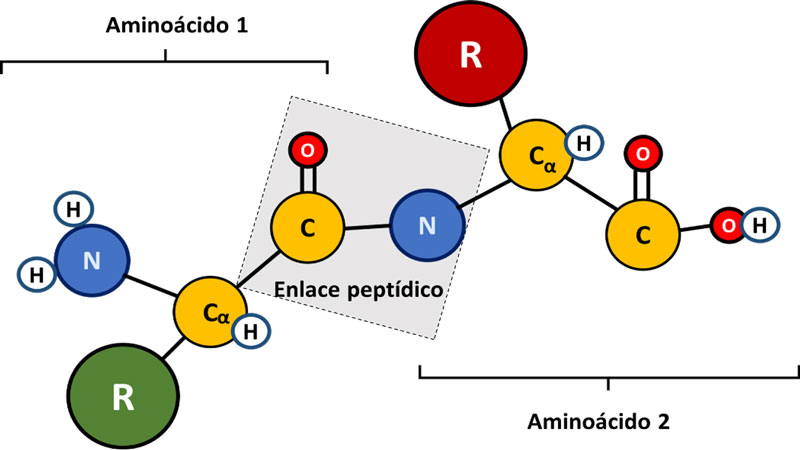
Figura 2. Esquema del enlace peptídico entre dos aminoácidos (aa) para formar péptidos y proteínas.
Para el ser humano, los aminoácidos existentes capaces de formar proteínas son 20: alanina, arginina, asparagina, aspartato, cisteína, fenilalanina, glicina, glutamato, glutamina, histidina, isoleucina, lisina, metionina, prolina, serina, tirosina, treonina, triptófano y valina. No obstante, existen dos aminoácidos más que pueden ser encontrados en organismos procariotas y arqueas: la selenocisteína y la pirrolisina.
¿Cómo se clasifican los aminoácidos?
Según su obtención, propiedades fisicoquímicas o estructura, los aminoácidos se pueden clasificar atendiendo:
- La capacidad de ser generados o no por el cuerpo del ser humano.
- Las propiedades de su cadena lateral.
- La ubicación del grupo amino (NH3).
En la tabla 1 se muestra un resumen de la clasificación de los aminoácidos dependiendo de diferentes criterios.
| Atendiendo a: | Clasificación | Aminoácidos |
|---|---|---|
| Su obtención. La capacidad de ser generados por el cuerpo del ser humano | Esenciales. El cuerpo no los produce, son obtenidos de la dieta | Leucina (Leu, L) Fenilalanina (Phe, F) Isoleucina (Ile, I) Triptófano (Trp, W) Valina (Val, V) Treonina (Thr, T) Metionina (Met, M) Histidina (His, H) Lisina (Lys, K) Arginina (Arg, R) |
| No esenciales. Producidos por el cuerpo | Alanina (Ala, A) Ácido glutámico (Glu, E) Arginina (Arg, R) Glutamina (Gln, Q) Asparagina (Asn, N) Glicina (Gly, G) Ácido aspártico (Asp, D) Prolina (Pro, P) Cisteína (Cys, C) Serina (Ser, S) Tirosina (Tyr, Y) | |
| Propiedades fisicoquímicas de su cadena lateral | Neutros polares, polares o hidrófilos | Serina (Ser, S) Asparagina (Asn, N) Treonina (Thr, T) Tirosina (Tyr, Y) Glutamina (Gln, Q) Cisteína (Cys, C) Glicina (Gly, G) |
| Neutros no polares, apolares o hidrófobos | Alanina (Ala, A) Metionina (Met, M) Valina (Val, V) Prolina (Pro, P) Leucina (Leu, L) Isoleucina (Ile, I) Fenilalanina (Phe, F) | |
| Con carga negativa o ácidos | Ácido aspártico (Asp, D) Ácido glutámico (Glu, E) | |
| Con carga positiva o básicos | Lisina (Lys, K) Histidina (His, H) Arginina (Arg, R) Fenilalanina (Phe, F) | |
| Aromáticos | Tirosina (Tyr, Y); Triptófano (Trp, W) | |
| Estructura. La ubicación del grupo amino (NH3) | Alfa-aminoácidos | El grupo amino está ubicado en el carbón 2 de la cadena |
| Beta-aminoácidos | El grupo amino está ubicado en el carbón 3 de la cadena | |
| Gamma-aminoácidos | El grupo amino está ubicado en el carbón 4 de la cadena |
Tabla 1. Clasificación de los aminoácidos atendiendo criterios de obtención, propiedades fisicoquímicas de su cadena lateral o estructura.
En paréntesis se puede observar la abreviación de 3 letras y el símbolo de cada aminoácido.
Aminoácidos afines a metales
Como se observó en la tabla 1, algunos aminoácidos pueden ser clasificados en más de una categoría debido a su funcionalidad, estructura y características propias de los grupos funcionales que los conforman. Recientemente, se ha demostrado que aminoácidos no esenciales, como la cisteína y la lisina, presentan afinidad para formar complejos con metales como el oro y la plata. Dicha afinidad se debe al grupo R de cada aminoácido, que presenta alta electronegatividad con potencial reductor2 (Petean et al., 2008). En este sentido, la cisteína ha demostrado tener afinidad por el oro (Rodríguez-Zamora et al., 2021), por lo que ha sido empleada como agente estabilizante en la síntesis de nanopartículas de oro (partículas cuyo tamaño no rebasa los 100 nanómetros,3 AuNPs). Del mismo modo, la tirosina es otro aminoácido que además de poseer potencial reductor puede actuar como estabilizador cuando se encuentra formando parte de la estructura de un péptido. La propiedad reductora de la tirosina se debe a la presencia de un anillo bencénico altamente electronegativo que es el responsable de atraer y reducir oro catiónico (Au3+), para la formación de AuNPs. En el caso de la cisteína, su propiedad estabilizadora se debe principalmente a la presencia del elemento azufre (S), que integra a un grupo sulfhidrilo (-SH), que forma un enlace covalente4 con la superficie de la AuNP (Wang et al., 2021; ver figuras 3 y 4).
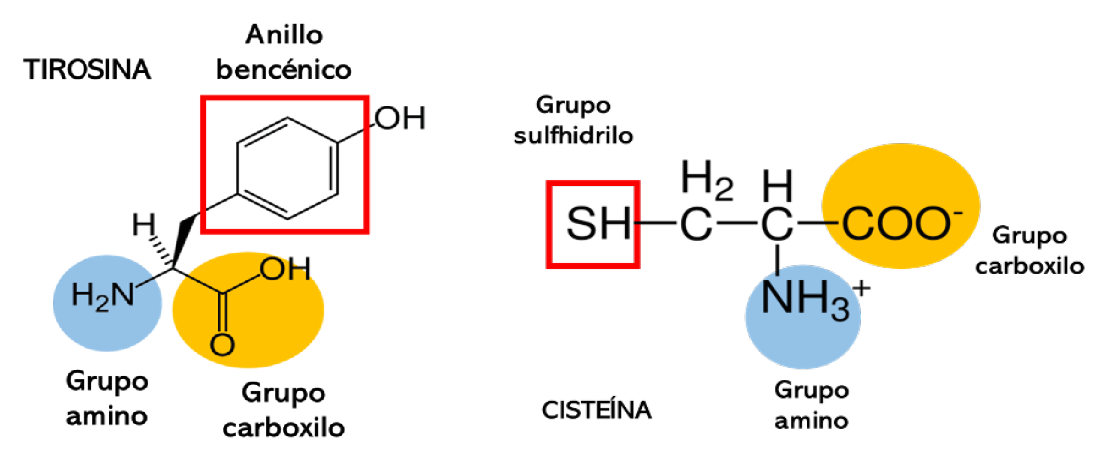
Figura 3 (izquierda). Estructura de la tirosina.
Figura 4 (derecha). Estructura de la cisteína.
Formación de nanopartículas de oro empleando cisteína
En este trabajo, hablaremos de la obtención de AuNPs y su estabilización con cisteína, al emplear la sal de tricloruro de oro (AuCl3) como solución precursora del metal5 y el borohidruro de sodio (NaBH4) como agente reductor.6 Para generar la AuNP, es necesario, en primera instancia, la síntesis de una “semilla” (núcleo de la AuNP). La semilla puede incrementar su tamaño al adicionar más sales de oro y agente reductor a la reacción, y así, alcanzar la dimensión en nanómetros que se desee. El NaBH4 es un compuesto capaz de reducir el oro catiónico (ion de oro con carga positiva, Au3+) obtenido del AuCl3, a oro metálico (ion de oro con valencia cero, Au0). Dicha reducción da como resultado la formación de la nanopartícula. Una vez que la reducción se lleva a cabo, la cisteína se adsorbe en la superficie de la AuNP mediante reacciones de intercambio de ligandos, o bien, puede unirse a moléculas que fueron adsorbidas a la superficie metálica durante el crecimiento de la AuNP (Hernandez-Adame et al., 2019).
Cabe destacar que el recubrimiento de las AuNPs con aminoácidos como cisteína se considera el método predilecto para su posterior biofuncionalización. Esto debido a que el grupo amino libre de la cisteína, que no reaccionó con otra molécula o grupo funcional durante la síntesis, tiene la capacidad de formar enlaces covalentes y/o amida con moléculas como péptidos e incluso proteínas completas. Además, la AuNP estabilizada con cisteína posee carga superficial positiva derivada del grupo funcional (NH3) de este mismo aa. Por lo anterior, la AuNP resulta ser aún más interesante, ya que su carga es afín a biomoléculas de carga negativa como el adn para que puedan interactuar. Adicionalmente, las AuNPs con carga positiva tienen mayor aplicación biológica que aquellas cargadas negativamente (Petean et al., 2008; Monacu et al., 2009; Majzik et al., 2009). De hecho, las AuNPs que poseen carga negativa son estabilizadas con moléculas distintas a los aminoácidos, como el caso del citrato de sodio (Na3C6H5O7), donde se emplea el método de Turkevich7 para su estabilización.
Aplicaciones de nanopartículas de oro sintetizadas con cisteína
Las AuNPs que poseen carga superficial positiva tienen más afinidad por los sistemas biológicos. Esta misma carga las hace candidatas para ser funcionalizadas con moléculas de carga negativa, ya que las cargas opuestas se atraen y la unión entre la molécula negativa y la AuNP con carga positiva sería posible. Sumado a lo anterior, estas AuNPs pueden ser conjugadas (unidas) a compuestos de origen peptídico, ya que el grupo amino y carboxilo es susceptible a formar enlaces amida (peptídicos) covalentes (ver figura 5).
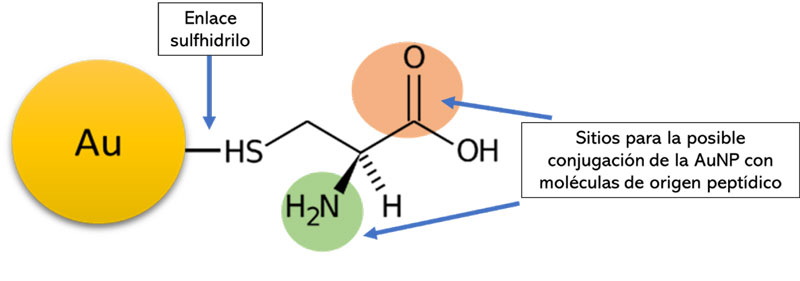
Figura 5. Estructura de la AuNP estabilizada con cisteína. Se muestran los sitios posibles de conjugación. El grupo -NH2 dota a la nanopartícula de una carga superficial positiva.
Actualmente se encuentran en desarrollo AuNPs que se encargan del transporte y liberación (vehículos de entrega) de material genético (Guo et al., 2015). El empleo de nanopartículas en el área de vacunología ha dado lugar a la nanovacunología. En el caso específico de las AuNPs cargadas positivamente, no se encuentran al momento prototipos de nanovacunas donde se emplee este sistema. Sin embargo, resulta atractivo el estudio del posible uso de estas nanopartículas en el desarrollo de nanovacunas contra enfermedades infecciosas.
En el grupo de Inmunología y Vacunología (giv), del Centro de Investigaciones Biológicas del Noroeste (cibnor), se ha realizado la síntesis de AuNPs con cisteína como agente estabilizador para su posible uso como vehículos de entrega de vacunas. Al momento se han sintetizado AuNPs de diámetros desde los 2 a 56 nm, las cuáles han demostrado ser bioseguras dadas la baja toxicidad que presentaron en ensayos in vitro8 con células de bazo de ratón. Además, se demostró que poseen estabilidad química al ser sometidas a diferentes concentraciones de pH en solución. En la figura 6 se muestran imágenes obtenidas por micrografía electrónica de transmisión de las AuNPs sintetizadas con AuCl3 y estabilizadas con cisteína, las cuales presentaron un tamaño de 28 nm.

Figura 6. Micrografías obtenidas de la solución de AuNPs estabilizadas con cisteína, cuyo diámetro corresponde a 28 nm. Del lado izquierdo se observa una imagen de pocos aumentos (baja magnificación), en la que se observan algunas partículas del mismo tamaño. Del lado derecho se muestra una imagen de alta magnificación y alta resolución de una AuNP, donde se puede observar la capa orgánica que la recubre, que tiene un grosor de 1.89 nm, aproximadamente.
Conclusiones y perspectivas
Los aminoácidos han sido y seguirán siendo moléculas de gran interés biotecnológico, útiles para la innovación de sistemas que pueden ser empleados en varias áreas de desarrollo. El uso de la cisteína para la estabilización de metales es una alternativa para la obtención de AuNPs con carga positiva. Además, estas estructuras tienen potencial uso en sistemas biológicos debido a su estabilidad y biocompatibilidad. Esta última cualidad es obtenida gracias al empleo de compuestos de origen peptídico en la síntesis de las AuNPs. El uso de estos sistemas resulta una opción novedosa para el transporte de moléculas de carga negativa.
En el caso del empleo de AuNPs estabilizadas con cisteína para la formulación de nanovacunas, aún es necesario el desarrollo y estudio del comportamiento de estos sistemas al ser administrados, a través de estudios de biodistribución y biodisponibilidad para que los prototipos que se generen sean eficaces y seguros. Como perspectiva de este trabajo, se plantea realizar la conjugación de estas nanopartículas con compuestos capaces de estimular la respuesta inmune, es decir, antígenos específicos contra enfermedades infecciosas; además de realizar ensayos en modelos animales que demuestren la bioseguridad y eficacia protectora de estos prototipos de nanovacunas.
Referencias
- Guo, J., Armstrong, M., O’Driscoll, C., Holmes, D. y Rahme, K. (2015). Positively charged, surfactant-free gold nanoparticles for nucleic acid delivery. rsc Advances, 5, 17862-17871. https://doi.org/10.1039/C4RA16294C.
- Hernandez-Adame, L., Angulo, C., Delgado, K., Schiavone, M., Castex, M., Palestino, G., Betancourt-Mendiola, L., y Reyes-Becerril, M., (2019, agosto). Biosynthesis of β-d-glucan-gold nanoparticles, cytotoxicity and oxidative stress in mouse splenocytes. International journal of biological macromolecules, 134(1), 379–389. https://doi.org/10.1016/j.ijbiomac.2019.05.065.
- Lehninger, A. L., Nelson, D. L., y Cox, M. M. (2000). Lehninger principles of biochemistry. Worth Publishers.
- Majzik, A., Patakfalvi, R., Hornok, V. y Dékány, I. (2009). Growing and stability of gold nanoparticles and their functionalization by cysteine. Gold Bulletin, 42(2). https://doi.org/10.1007/BF03214921.
- Mathews, C. y Van Holde, K. (1998). Bioquímica (2a. edición). McGraw-Hill Interamericana.
- Mocanu, A., Cernica, I., Tomoaia, G., Bobos, L. D., Horovitz, O., y Tomoaia-Cotisel, M. (2009). Self-assembly characteristics of gold nanoparticles in the presence of cysteine. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 338(1–3), 93-101. https://doi.org/10.1016/j.colsurfa.2008.12.041.
- Petean, I., Tomoaia, G., Horovitz, O., Mocanu, A. y Tomoaia-Cotisel, M. (2008). Cysteine mediated assembly of gold nanoparticles. Journal of Optoelectronics and Advanced Materials, 10(9), 2289–2292
- Rodríguez‐Zamora, P., Cordero‐Silis, C., Garza‐Ramos, G., Salazar‐Angeles, B., Luque‐Ceballos, J., Fabila, J., Buendía, F., Paz‐Borbón, L., Díaz, G., Garzón, I. (2021). Effect of the Metal–Ligand Interface on the Chiroptical Activity of Cysteine‐Protected Nanoparticles. Small, 2004288. https://doi.org/10.1002/smll.202004288.
- Wang, Y., He, W., Li, C. H., Xia, C., Yan, Y., Li, C. M. y Huang, C. Z. (2021). Chirality transfer of cysteine to the plasmonic resonance region through silver coating of gold nanobipyramids. Chemical Communications, 57(26), 3211-3214. https://doi.org/10.1039/D0CC07576K.
Recepción: 04/11/2020. Aprobación: 05/03/2021.


