El pez cebra: mi compañero de investigación contra el cáncer
Vol. 24, núm. 3 mayo-junio 2023
El pez cebra: mi compañero de investigación contra el cáncer
Gisela Ceballos Cancino y Silvia Arantza Sánchez Guerrero CitaResumen
Los casos de cáncer y la frecuencia con la que se presentan entre la población aumentan cada año, causando múltiples y devastadores efectos para los pacientes. Actualmente se sabe que diversos factores y mecanismos moleculares se ven involucrados en la progresión del cáncer. Sin embargo, a pesar de los grandes avances que se han realizado en el estudio del cáncer, a la fecha no existe un método único para diagnosticar y tratar a todos los pacientes con esta enfermedad. Es por ello que la investigación de este padecimiento complejo debe ser abordada con un modelo de estudio que involucre múltiples factores y variables, que se asemejen lo más posible a lo que sucede en el cuerpo humano. Contar con un modelo de estudio muy parecido al humano y que además permita estudiar en poco tiempo el proceso de formación y progresión del cáncer redundará en beneficios importantes para los pacientes. Por lo tanto, en el presente artículo se abordan algunas características del cáncer y las ventajas que tiene el uso del pez cebra como modelo de estudio para investigar esta enfermedad.
Palabras clave: cáncer, rasgos del cáncer, microambiente tumoral, modelos, pez cebra.
The zebrafish: my research partner against cancer
Abstract
Cancer cases and the frequency with which they occur among the population increase every year, with multiple and devastating effects for patients. Various factors and molecular mechanisms are involved in cancer progression. However, despite the great advances in cancer research, there is no single method to diagnose and treat all patients with this disease. Therefore, investigation of this complex condition requires a study model that involves multiple factors and variables, as similar as possible to what actually happens in the human body. Such a model, which also allows the study of cancer progression in a short time, will result in significant benefits for patients. This article addresses some characteristics of cancer and the advantages of using zebrafish as a study model to investigate this disease.
Keywords: cancer, hallmarks of cancer, tumor microenvironment, models, zebrafish.
Introducción
Alguna vez te has preguntado, ¿cuál es el impacto que tiene el cáncer en el mundo? Bueno, durante 2012 se registraron 14 millones de casos nuevos y 8.2 millones de personas fallecidas; mientras que, en 2018, se estima que estos números ascendieron a 18 millones de casos nuevos y 9.6 millones de muertes (InfoCancer, 2019). El panorama del cáncer en México se asemeja al del mundo, pues es la tercera causa de muerte, sólo después de las enfermedades cardiovasculares y la diabetes (smeo, 2016). La Sociedad Mexicana de Oncología (smeo) considera que las cifras elevadas de muertes por cáncer se deben a los diagnósticos tardíos; ya que el 60% de los casos de cáncer en México son detectados en etapas avanzadas (smeo, 2016).
Después del diagnóstico, la mayoría de los pacientes recibe como tratamiento la quimioterapia. Ésta no es el problema, funciona en algunos casos, pero no es efectiva para muchos otros, y aunque existen diversas opciones terapéuticas, estas opciones no pueden ser probadas antes en los pacientes para corroborar si serán efectivas o no (Costa et. al., 2020).
Como te podrás dar cuenta, un gran porcentaje de la población se ve afectada por el cáncer. Por ello, cualquier investigación en esta área nos acerca a determinar los tratamientos idóneos que cada persona requiere para tratar su tipo de cáncer, porque cada cáncer es tan único como la persona que lo padece.
Todos hemos oído hablar sobre el cáncer, y la mayor parte conocemos a alguien que tiene o ha padecido esta enfermedad. Aún así, muchas personas saben poco o nada sobre el cáncer, y aún menos cómo se estudia, la manera en la que se diseñan nuevos tratamientos, y cómo se sabe que un tratamiento está siendo efectivo para un paciente.
En lo personal, he visto el efecto devastador que el cáncer puede tener en las personas en general, y en particular en mis familiares más cercanos. Cuando era pequeña, mi mamá me habló de las enfermedades que tenían sus familiares; recuerdo que me habló de su abuelito, que murió por cáncer de mama avanzado. Para mí era difícil comprender como alguien que era hombre podría haber tenido un tipo de cáncer que generalmente se escuchaba que únicamente tenían las mujeres. Conforme fui creciendo, me fui percatando de que no sólo existía el cáncer de mama, sino que había otros tipos, por ejemplo: cáncer de tiroides, de hígado, leucemia, etcétera. De este último tipo, la leucemia (un cáncer que se forma en la sangre), entendía poco o nada, porque no podía comprender cómo la gente podía tener lo que yo pensaba como “sangre infectada”.
Desde entonces, he escuchado y leído algunos de los increíbles avances que se han logrado gracias al arduo trabajo y la dedicación de cientos de investigadores y proveedores de atención médica en su búsqueda de nuevas y mejores terapias farmacológicas y técnicas de tratamiento. Hace apenas unas décadas, se sabía poco sobre el cáncer, y cuando a alguien era diagnosticado, sus posibilidades de supervivencia eran escasas. Hoy sabemos mucho más: cómo diagnosticarlo, maneras de prevenirlo y, lo más importante para mí, y que abordaremos como tema principal en este texto, las formas de estudiarlo mediante modelos in vivo (los experimentos realizados en organismos vivos).
No fue hasta las primeras clases de biología molecular que empecé a tener una intriga sobre qué era el cáncer. Cuando comencé mi servicio social, comprendí que el cáncer es en realidad un grupo de más de 100 enfermedades diferentes, y que todas ellas se caracterizan por un crecimiento anormal y descontrolado de las células (Hanahan y Weinberg, 2011).
El cáncer se origina en nuestras propias células. En nuestro cuerpo tenemos alrededor de 200 tipos de células diferentes, cada una tiene sus propias características: forma, tamaño, distribución de estructuras internas y función. Cada conjunto de células especializadas da como resultado un órgano o tejido. Entonces, dependiendo de en qué célula se origine el cáncer, hablamos de un tipo diferente de esta enfermedad; ejemplo de ello es que en algún momento has llegado a escuchar del cáncer de mama, del cáncer de próstata, etcétera.
Normalmente, las células que envejecen o que ya han cumplido con su función se mueren y son reemplazadas por células nuevas, las cuales se originan por la división celular. Sin embargo, cuando los genes que participan en los procesos de división y muerte celular sufren algún daño, ocasionado por exposición a factores ambientales (humo del tabaco, rayos ultravioleta, entre otros), el estilo de vida de la persona o incluso porque nos han sido heredados genes con alguna alteración, el proceso normal de las células se ve alterado, lo que conduce a que las células crezcan cuando no deben y de una manera descontrolada.
Hallmarks del cáncer
Pero para entender cómo es que las células cancerígenas se diferencian de las células sanas hablaremos de los rasgos del cáncer, o como los llaman los investigadores, los hallmarks del cáncer. En el año 2000, dos investigadores, Robert Weinberg y Douglas Hanahan, publicaron un artículo llamado “Hallmarks of cancer”. Estos hallmarks constituyeron las bases para tratar de comprender la complejidad del cáncer (Hanahan y Weinberg, 2000). En ese año, se propusieron seis hallmarks o rasgos que distinguen a las células cancerosas de las células normales:
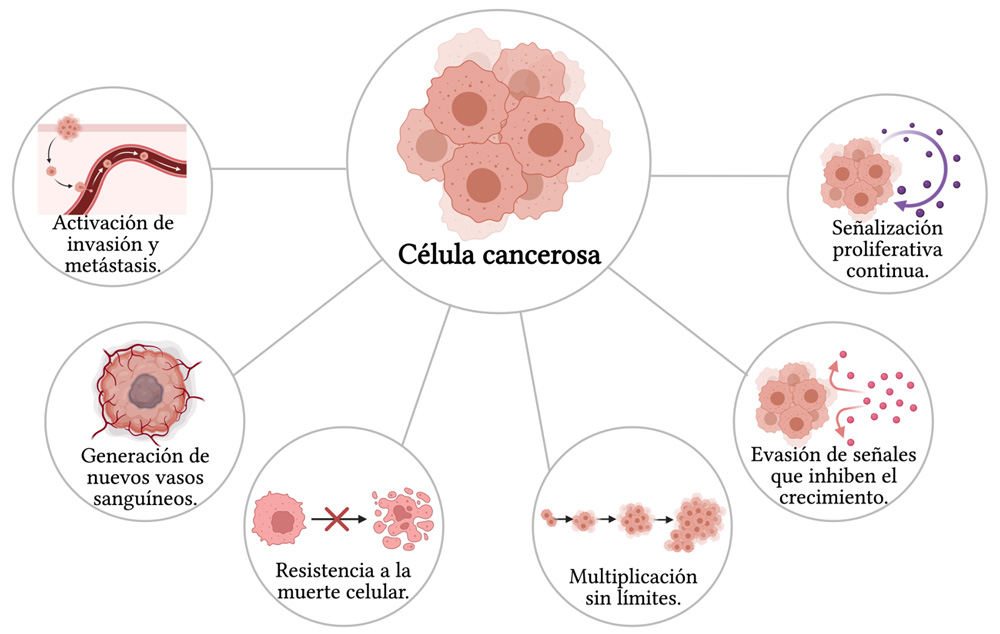
Figura 1. Rasgos del cáncer. En esta figura se representan seis rasgos distintivos del cáncer, que son características que comparten todas las células cancerosas.
Crédito: imagen creada en BioRender, con información de Weinberg y Hanahan, 2000.
- Autosuficiencia en señales de crecimiento. Las células normales se multiplican sólo cuando reciben ciertas señales para crecer y dividirse, y detienen este crecimiento cuando estas señales también cesan. Las células cancerosas, en cambio, se vuelven independientes de estas señales por diversos mecanismos, por lo que se multiplican de manera continua (Hanahan y Weinberg, 2000).
- Insensibilidad a señales anticrecimiento. Las células normales dejan de multiplicarse cuando reciben señales anticrecimiento, con el fin de evitar amontonamientos de células, pero las células cancerosas ignoran estas señales, lo que produce un aglomeramiento de células (Hanahan y Weinberg, 2000).
- Capacidad de división ilimitada. Las células normales tienen un límite de veces para dividirse. Las células cancerosas omiten esos límites, así que se dividen indefinidamente, por lo que se dice que estas células se vuelven “inmortales” (Hanahan y Weinberg, 2000).
- Evasión de apoptosis. Las células normales reciben y hacen caso a señales para realizar una muerte celular programada (llamada apoptosis). Sin embargo, las células cancerosas ignoran las señales que indican que deben morir, por lo que se siguen multiplicando sin control (Hanahan y Weinberg, 2000).
- Angiogénesis constante. En condiciones normales, se proveé de nutrientes y oxígeno a las células a través de los vasos sanguíneos. En el cáncer, las células cancerosas secuestran a los vasos sanguíneos para que crezcan en dirección a los tumores. De tal forma, que el tumor puede seguir creciendo porque tiene el suministro de oxígeno y nutrientes a través de los nuevos vasos sanguíneos que se forman, un proceso llamado angiogénesis (Hanahan y Weinberg, 2000).
- Invasión de tejidos y metástasis. Las células normales se encuentran solo en el órgano o tejido al que pertenecen, pero las células cancerosas pueden viajar a otras partes en el cuerpo —principalmente a través de los vasos sanguíneos secuestrados—, donde se forma un tumor nuevo en un órgano diferente, lo que se conoce como metástasis. Las células cancerosas también pueden diseminarse en el cuerpo a través del sistema linfático o al invadir tejidos u órganos que se encuentran adyacentes al tumor (Hanahan y Weinberg, 2000).
En la figura 1 podrás encontrar descritos de manera gráfica estos hallmarks, que, en conjunto, exponen lo complejo que es esta enfermedad y lo difícil que es combatir a las células cancerígenas, pues todos los hallmarks contribuyen a la característica básica que se ha encontrado en todos los tumores, y lo que es parte de la definición del cáncer: el crecimiento anormal y descontrolado.
Con el paso de los años se han identificado más hallmarks del cáncer. A la fecha se han propuesto ocho rasgos más, para un total de 14 (Hanahan, 2022). Estos hallazgos reflejan lo complejo no sólo de esta enfermedad, sino de los rasgos de las células tumorales, y de otros factores que también afectan la formación y progresión del cáncer, uno de ellos es el microambiente tumoral.
El microambiente tumoral es un conjunto de células, moléculas y vasos sanguíneos que rodean y alimentan a las células tumorales (National Cancer Institute, s.f.). Para ejemplificar cómo el microambiente tumoral afecta el crecimiento del tumor, se puede mencionar a las células endoteliales, que son las células que forman parte de los vasos sanguíneos, arterias y capilares. Las células endoteliales pueden ser estimuladas por las células tumorales para inducirlas a que formen vasos sanguíneos nuevos hacia el tumor para suministrarle oxígeno y nutrientes (angiogénesis). Estas células endoteliales que se relacionan con el tumor presentan diferencias respecto a las células endoteliales normales y el conocer cómo se da la interacción entre las células endoteliales y las tumorales permitirá comprender el proceso de la angiogénesis y cómo bloquearlo sin afectar los procesos normales.
Además de las células endoteliales, hay otros tipos celulares que forman el microambiente tumoral, tales como los pericitos, las células del sistema inmune, los fibroblastos y las células madre del tejido adyacente al tumor. Las interacciones entre las células tumorales y los componentes del microambiente tumoral pueden afectar la manera en que un tumor crece y se disemina por el cuerpo (Hanahan y Weinberg, 2011).
Entonces, debido a la variedad de factores que contribuyen al desarrollo, al crecimiento y al avance del cáncer, es necesario utilizar modelos de estudio, en los que además de estudiar el comportamiento de las células tumorales también se pueda analizar su microambiente, las células y los componentes que lo rodean. Así, los modelos de estudio más completos deben abarcar la mayor parte de estas variables para hacer un estudio más confiable sobre el cáncer. Y si estos modelos se asemejan mucho a los humanos, entonces, los resultados que se obtengan pueden tener una aplicación más directa en los pacientes con cáncer. Por eso me sorprendió mucho saber que los peces se utilizan para estudiar el cáncer.
Similitudes entre Humanos y peces cebra
En mi casa siempre hemos tenido peces. Las peceras han cambiado de manera constante, pero lo que nunca ha cambiado ha sido nuestro asombro por estos mágicos animales. Esta curiosidad y admiración se mantuvieron vivas a través del tiempo, y crecieron cuando, en algún momento de mi formación, mi tutora me habló sobre el uso del pez cebra como modelo de estudio in vivo para el cáncer. Entonces me surgieron varias dudas: ¿por qué utilizaban un pez para estudiar un problema de salud en humanos? y ¿por qué no estudiaban el cáncer en otros humanos o en los clásicos ratones de laboratorio? Así que comencé a realizar una investigación para resolver estas preguntas y lo que encontré me sorprendió.
Comencemos por entender en qué se parece el pez cebra al humano. Podría parecer difícil de creer, pero compartimos un ancestro en común. Aunque el pez cebra no es un mamífero, tiene varios tejidos, órganos y glándulas cuyas funciones son similares a las de los mamíferos; estos incluyen los sistemas musculoesquelético y cardiovascular, ojos, cerebro, hígado, corazón, tracto gastrointestinal y páncreas, por lo que el pez cebra es un buen modelo para estudiar varios tipos de tumor que se originan en estos órganos. Además, los peces cebra tienen un sistema inmunológico desarrollado, que es similar al de los humanos, por lo que se puede estudiar la mayor parte de las moléculas y vías de señalización involucradas en la respuesta inmunológica tanto de mamíferos como de peces cebra (Bailone et. al., 2020).
Por otro lado, los avances para determinar la secuencia completa de adn de un organismo (genoma), mediante secuenciación, han permitido encontrar semejanzas genéticas entre humanos y peces cebra, las cuales se muestran en la figura 2.
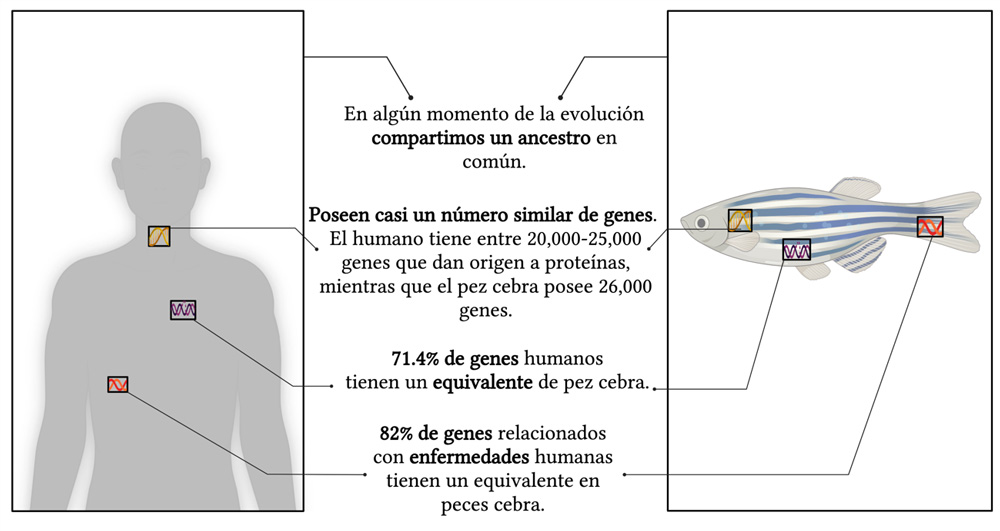
Figura 2. Similitudes entre humanos y peces cebra. Los humanos y los peces cebra compartimos similitudes genéticas que permiten utilizar a los peces cebra para el estudio del cáncer en humanos.
Crédito: creada en BioRender, con información de Howe et. al., 2013.
Ventajas del uso de peces cebra como modelo para estudiar cáncer
El uso del pez cebra como modelo de estudio es más reciente que el uso de los ratones en el laboratorio. Por ello, es necesario hablar de cuáles son las ventajas que tienen en comparación con los roedores (ver figura 3).
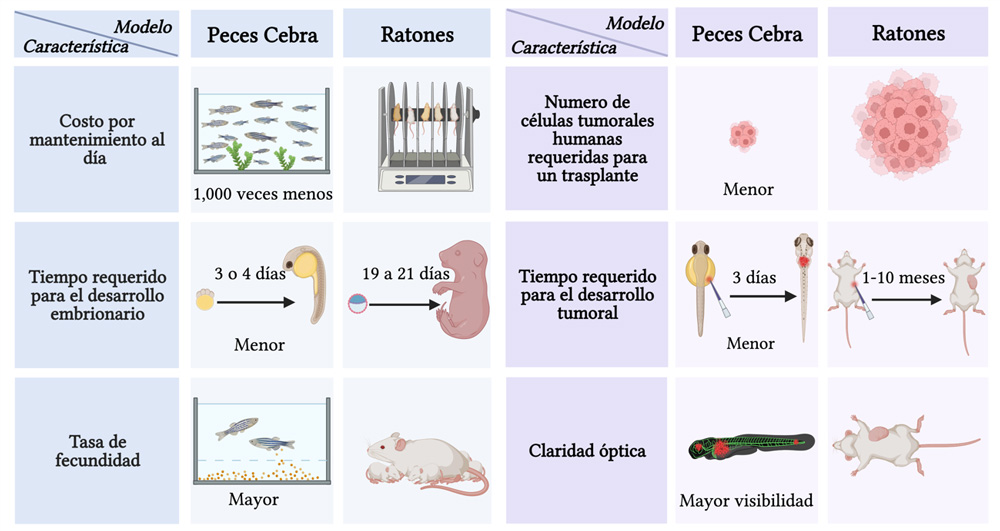
Figura 3. Diferencias entre peces cebra y ratones como modelo biológico. Las características presentes en los peces cebra los han convertido en uno de los modelos preferidos para estudiar características del cáncer.
Crédito: creada en BioRender, con información de.
Los costos de mantenimientos del pez cebra representan 1/1000 de los costos que se tienen en comparación con el mantenimiento de los ratones (Zebrafishfilm.org, s.f.). Hughes (2013) menciona que el mantenimiento de un tanque de pez cebra cuesta 6.5 centavos de dólar al día, en comparación con los 90 centavos de dólar al día de cinco ratones en una jaula (1.21 y 16.7 MXN, respectivamente). Además, el pez cebra es pequeño y social, lo que permite tener hasta 70 peces cebra en un tanque, mientras que en una jaula sólo se podrían tener hasta cinco ratones (Johnson, 2013).
Otra ventaja importante es que los peces cebra tienen un desarrollo embrionario rápido, por ejemplo: los huevos de pez cebra en el laboratorio eclosionan alrededor de tres a cuatro días después de la fertilización, mientras que los ratones tienen un período de gestación de entre 19 a 21 días (Ciemerych y Sicinski, 2005). Esto es relevante porque el uso de los peces cebra implica:
- 1. Obtener conocimiento básico de cómo se comportan los tumores en menos tiempo. Para ello, se inyectan cultivos celulares en embriones del pez y se realiza manipulación genética (se inhiben o sobreexpresan genes), lo que permite observar la relación entre los genes modificados y el desarrollo y la progresión del tumor.
- 2. Facilita la investigación farmacológica con el fin de obtener fármacos personalizados o bien mejorar las terapias existentes para cada paciente con cáncer. Por ejemplo, con el uso delos peces cebra como avatares. Se les llama avatares porque son una representación de lo que sucedería en un humano, pues se obtiene una muestra del tumor de un paciente, se implantan células tumorales en las larvas de peces cebra y se prueban diversos fármacos o terapias. Y gracias a la similitud que tienen con los humanos se puede “predecir” la respuesta que esos tratamientos tendrán en el humano.
Por otro lado, los peces cebra tienen una alta tasa de fecundidad: el desove regular de los peces cebra es de hasta doscientos huevos viables por semana durante todo el año (Langova et. al, 2020). En cambio, un ratón sólo puede dar a luz entre cinco y seis crías por camada y sólo se dan entre cinco y 10 camadas por año (Van Sluyters et. al., 2003). De esta manera, con el uso de peces cebra es posible obtener muchas crías de un único apareamiento. Además, como no requieren de espacios amplios para crecer, es posible tener muchas crías a la vez. Un número mayor de crías representa más opciones para estudiar la progresión tumoral y su microambiente, la respuesta a toxicidad y la dinámica de fármacos contra las células humanas tumorales.
Para poder realizar estos estudios, que implican un gran avance en la medicina personalizada o de precisión, se requiere de un número determinado de células tumorales provenientes del paciente para ser inyectadas en el modelo de estudio. El pez cebra también presenta un punto a su favor en este aspecto, pues requiere de menos de 500 células tumorales para poder desarrollar un tumor, respecto a 1,000,000 ó 5,000,000 de células tumorales que requieren ser inyectadas para que un ratón pueda desarrollar uno (Costa et. al., 2020).
Algo que también es importante resaltar es el tiempo que tardan las células tumorales provenientes de los pacientes en desarrollar masas tumorales en el modelo in vivo. En el caso de las larvas de peces cebra, tres días después de la inyección de células tumorales humanas comienza el desarrollo tumoral, aproximadamente. Mientras que en los ratones, se requiere esperar entre uno y 10 meses, u ocasionalmente, hasta 18 meses para que comience el desarrollo tumoral después de la inyección de células tumorales humanas (Costa et. al., 2020).
El tiempo es un factor importante en la lucha contra el cáncer. Por lo que mientras más rápido se pueda determinar la efectividad de un fármaco contra un tipo de tumor, con el número adecuado de especímenes analizados para dar confiabilidad al estudio y todo esto a un costo menor, más rápido se podrá proponer un tratamiento para los pacientes cuyos tumores crecen, evolucionan y se propagan. En este sentido, como se mencionó anteriormente, el uso del pez cebra como modelo de estudio para el cáncer ofrece muchas ventajas en este respecto.
Por último, una de las características que se deben tomar en cuenta es la claridad óptica de los peces cebra. En este punto, el modelo de pez cebra es uno de los favoritos entre los investigadores debido a su transparencia. Pero tal vez en algún momento hayas visto un pez cebra y tal vez recuerdes que no es completamente transparente a simple vista. En los laboratorios, se utilizan las larvas del pez cebra, los cuales son transparentes y permiten la visualización de todo su desarrollo. Además, es posible inyectar células tumorales en estos embriones sin producir ningún tipo de dolor, y gracias a su rápido desarrollo y transparencia se puede observar cómo progresan las células tumorales (Langova et. al., 2020). Si comparamos este procedimiento con los ratones, su uso se vuelve complicado, puesto que, por un lado, se requiere eliminar su pelo para poder hacer estas observaciones, y, por el otro, sólo se pueden obtener imágenes en el sitio de tumor.
La medicina del futuro
No cabe duda de que el pez cebra es nuestro gran amigo para estudiar ciertas complejidades que abarca el cáncer. Posee ventajas para realizar un modelado de cánceres humanos y permite una manipulación genética accesible, lo que permite investigar y comprender los mecanismos y vías que conducen a la progresión del cáncer, así como evaluar diversos fármacos, evaluar su toxicidad y, en general, ha permitido que los médicos reduzcan los intentos de prueba y error de tratamiento en cada paciente.
Es importante destacar que los diferentes modelos in vivo tienen sus ventajas y desventajas. Cada modelo responde a diferentes preguntas biológicas específicas y es utilizado como herramienta complementaria, por lo que ninguno debe de ser menospreciado, al contrario, los científicos requieren de más investigadores realizando este tipo de experimentos. Anímate a estudiar y tratar de comprender la gran complejidad que abarca el cáncer, seguramente tú podrías ser el siguiente en aportar algo extraordinario.
Referencias
- Bailone Lacava, R., Fukushima, H. C. S., Ventura Fernandes, B. H., Kluwe De Aguilar, L., Corrêa, T., Janke, H., Grejo Setti, P., De Oliveira Roҫa, R., y Carneiro Borra, R. (2020). Zebrafish as an alternative animal model in human and animal vaccination research. Laboratory Animal Research, 36(13).https://doi.org/10.1186/s42826-020-00042-4.
- Ciemerych, M. A., y Sicinski, P. (2005). Cell cycle in mouse development. Oncogene, 24, 2877-2898. https://doi.org/10.1038/sj.onc.1208608.
- Committee on Guidelines for the Use of Animals in Neuroscience and Behavioral Research, National Research Council of the National Academies. (2003). Estimating Animal Numbers. En Guidelines for the Care and Use of Mammals in Neuroscience and Behavioral Research (pp. 181-190). The National Academies Press. https://doi.org/10.17226/10732.
- Costa, B., Estrada, M. F., Mendes, R. V., y Fior, R. (2020). Zebrafish Avatars towards Personalized Medicine-A Comparative Review between Avatar Models. Cells, 9(2). https://doi.org/10.3390/cells9020293.
- Emory Winship Cancer Institute. (s.f.). Guía gráfica a la biología del cáncer. CancerQuest. https://goo.su/JkeA.
- Hanahan, D., y Weinberg, R. A. (2000). The Hallmarks of Cancer. Cell, 100(1), 57-70. https://doi.org/10.1016/s0092-8674(00)81683-9.
- Hanahan, D., y Weinberg, R. A. (2011). Hallmarks of Cancer: The Next Generation. Cell, 144(5), 646-674. https://doi.org/10.1016/j.cell.2011.02.013.
- Hanahan, D. (2022). Hallmarks of Cancer: New Dimensions. Cancer discovery, 12(1), 31-46. https://doi.org/10.1158/2159-8290.CD-21-1059.
- Howe, K., Clark, M., Torroja, C., Torrance, J., Berthelot C., et. al. (2013).The zebrafish reference genome sequence and its relationship to the human genome. Nature, 496, 498-503.
- Hughes, V. (2013, 21 de enero). Will This Fish Transform Medicine? Popular Science. https://goo.su/SEM4KZ1.
- InfoCancer. (2019). Estadísticas mundiales y locales. InfoCancer. https://bit.ly/42s50B5.
- Johnson, B. (2013, 22 de enero). In many studies, zebrafish are the new lab rats. CBS News. https://goo.su/qgmq.
- Langova, V., Vales, K., Horka, P., y Horacek, J. (2020). The Role of Zebrafish and Laboratory Rodents in Schizophrenia Research. Frontiers in Psychiatry, 11(703), 1-22. https://doi.org/10.3389/fpsyt.2020.00703.
- National Cancer Institute. (s.f.). Tumor microenvironment. En nci Dictionary of Cancer Terms. https://goo.su/IhiZ8pX.
- smeo. (2016). Prevención y diagnóstico oportuno en cáncer. SMeO. https://bit.ly/2Bu74B7.
- Zebrafishfilm.org. (s.f.). Zebrafish Film Frequently Asked Questions (faqs). https://goo.su/8BbwQZM.
Recepción: 27/04/2022. Aprobación: 10/04/2023.


