De la espiga al hisopo: cómo se detecta la COVID-19
Vol. 26, núm. 3 mayo-julio 2025
De la espiga al hisopo: ¿cómo se detecta la COVID-19?
Blanca Ortiz-Quintero CitaResumen
Cansancio, fiebre, tos, diarrea, pérdida del olfato, entre otros síntomas combinados o aislados… ¿Cómo saber si tenemos covid-19? La única forma de responder esta pregunta es realizando una prueba diagnóstica que detecte la presencia del virus que produce el covid-19, el sars-CoV-2. En el mercado existen diferentes tipos de pruebas, ¿cuál debemos escoger? Este artículo de divulgación describe cuáles son los tipos disponibles, sus características, qué es lo que detectan, de qué parte del cuerpo se toma la muestra, en qué casos están indicadas, y su significado. Para comprender con claridad lo anterior, se incluye una descripción simplificada de la identidad del sars-CoV-2, cómo infecta y el tiempo en el que aparecen los síntomas.
Palabras clave: pruebas, covid-19, diagnóstico, virus, sars-CoV-2, pandemia.
From spike to swab: how is COVID-19 detected?
Abstract
Fatigue, fever, cough, diarrhea, loss of smell, among other combined or isolated symptoms… How can we know if we have covid-19? The only way to answer this question is by performing a diagnostic test that detects the presence of the virus that causes covid-19, sars-CoV-2. There are different types of tests available on the market; so, which one should we choose? This article describes the available types of tests, their characteristics, what they detect, from which part of the body the sample is taken, in which cases they are indicated, and what their results mean. To clearly understand this, the article includes a simplified description of the identity of sars-CoV-2, how it infects, and the timeline of symptom appearance.
Keywords: tests, covid-19, diagnosis, virus, sars-CoV-2, pandemic.
Sobre los virus y covid-19
Los virus son entes microscópicos incapaces de reproducirse por sí mismos, por lo que infectan a las células de algún organismo animal, vegetal o a una bacteria y obligan a las células a producir más virus. Este proceso, conocido como replicación viral mata a las células infectadas, induciendo diversas enfermedades en los organismos afectados. Los virus están compuestos básicamente de ácidos nucleicos que contienen su información genética y moléculas proteicas (proteínas) que forman la estructura del virus.
El sars-CoV-2 (ver figura 1) contiene su material genético en el ácido ribonucleico ( arn), presenta cuatro proteínas estructurales importantes, y está cubierto por una membrana lipídica, por lo que se conoce como un virus envuelto tipo arn. Estas cuatro proteínas estructurales son: la proteína espiga (S), la proteína de envoltura (E), la proteína de membrana (M), y la proteína de nucleocápside (N). Las proteínas espiga sobresalen en la superficie del virus semejando una corona, de ahí el nombre de coronavirus. La proteína S se une a la molécula conocida como la enzima convertidora de angiotensina 2 (ACE2) que está presente en varias células humanas y de esta forma puede infectarlas. La proteína E es esencial para el ensamblaje de los virus nuevos, la proteína M participa en la formación de la envoltura e interacciona con la proteína E en el ensamblaje de los virus nuevos. La proteína N se asocia al arn viral para ensamblarlo en un complejo de ribonucleoproteínas llamado la cápside (Hu, Guo, Zhou, y Shi, 2021; Satarker y Nampoothiri, 2020; Tebha, Tameezuddin, Bajpai, y Zaidi, 2024).
¿Por qué es relevante conocer los componentes del virus? Porque los componentes que distinguen al sars-CoV-2 de otros virus o microorganismos son los usados para desarrollar una prueba diagnóstica, aquella que indica la presencia de una condición, ya sea una enfermedad o una infección.
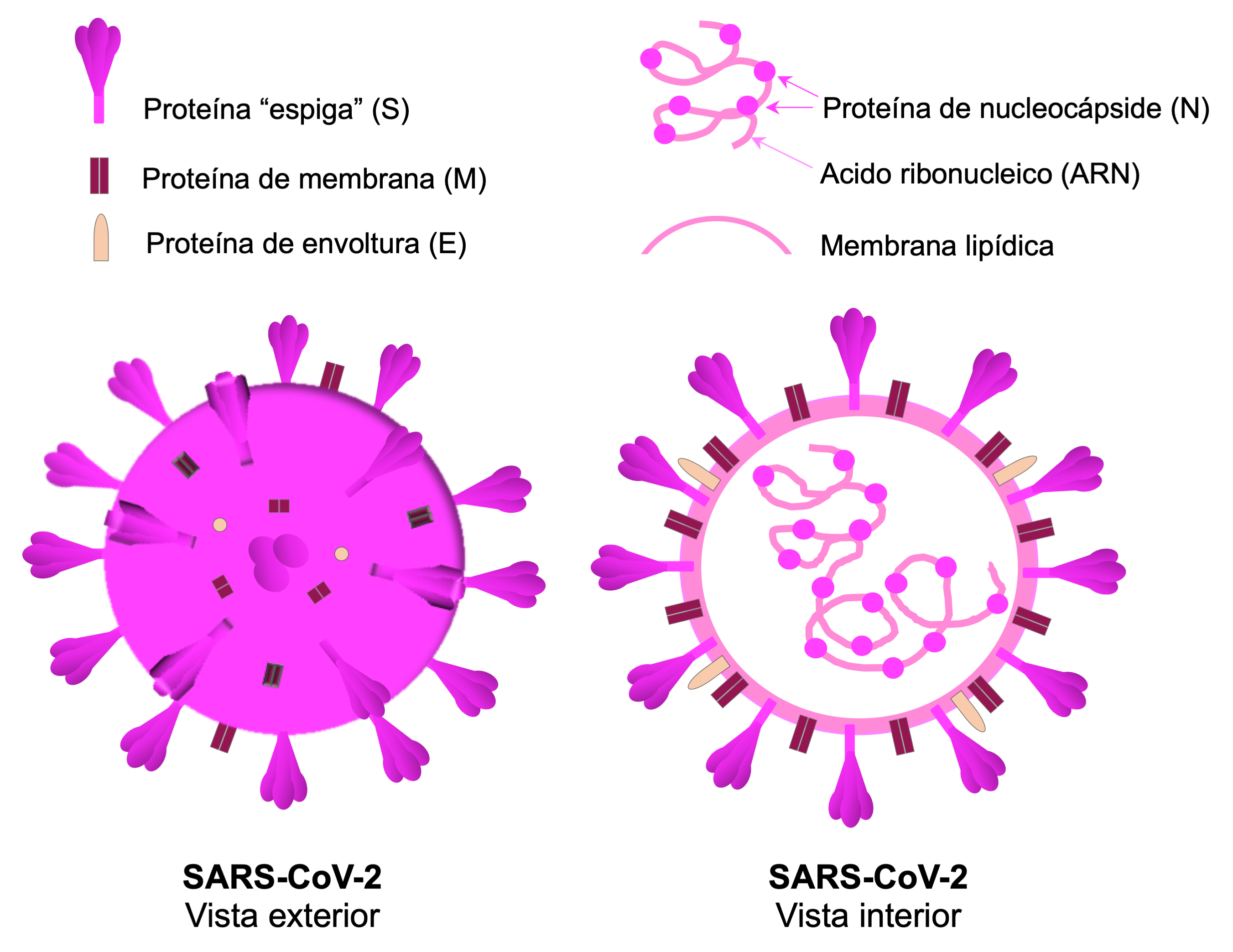
Figura 1. Representación esquemática del SARS-CoV-2 y sus principales componentes.
Crédito: elaboración propia.
La infección por el sars-CoV-2
El virus sars-CoV-2 se transmite directamente de persona a persona a través de las gotitas que un individuo infectado expele al estornudar y toser. La infección ocurre cuando las gotitas que contienen el virus entran en contacto con la mucosa de la nariz y de la boca, o bien a través de los ojos de otra persona. La mucosa es el tejido que recubre las partes del interior del cuerpo que están en contacto con elementos del exterior, como la nariz, la boca, las vías respiratorias, las vías digestivas y urinarias (ver figura 2A) (da Silva Torres et al., 2022). El virus también se transmite de forma indirecta cuando tocamos con las manos las superficies u objetos contaminados con dichas gotitas y después nos tocamos la mucosa de la nariz, de la boca o los ojos.
La proteína S del virus se une a la molécula ACE2 presente en las células de la mucosa de las vías respiratorias y las infecta, iniciando el ciclo de replicación viral. En el humano, las células alveolares tipo i y ii (localizadas en el pulmón), las células epiteliales, los fibroblastos, las células endoteliales y los macrófagos presentan la molécula ACE2. Las células alveolares tipo ii son las que expresan la mayor cantidad de ACE2, por lo que el pulmón es el sitio de mayor replicación del virus sars-CoV-2 (ver figura 2A) (da Silva Torres et al., 2022; Hu et al., 2021).
Los síntomas del covid-19 tales como cansancio, fiebre, tos, diarrea, pérdida del olfato, entre otros, aparecen alrededor de 3 a 5 días después de la infección. A este tiempo, entre la entrada del virus y la aparición de los síntomas, se le conoces como período de incubación. Los estudios indican que cuando la persona infectada presenta el máximo de síntomas es cuando el número de virus es más alto en el cuerpo, especialmente en la zona de la faringe, por lo que éste es el sitio donde se colecta la muestra para hacer las pruebas que detectan a los componentes del virus (ver figura 2B) (He X et al, 2020). Las muestras se toman de la zona de la nasofaringe u orofaringe, mediante el raspado de la mucosa de esas zonas con un hisopo largo, que es una varilla con la punta recubierta con algodón (ver figura 2B).
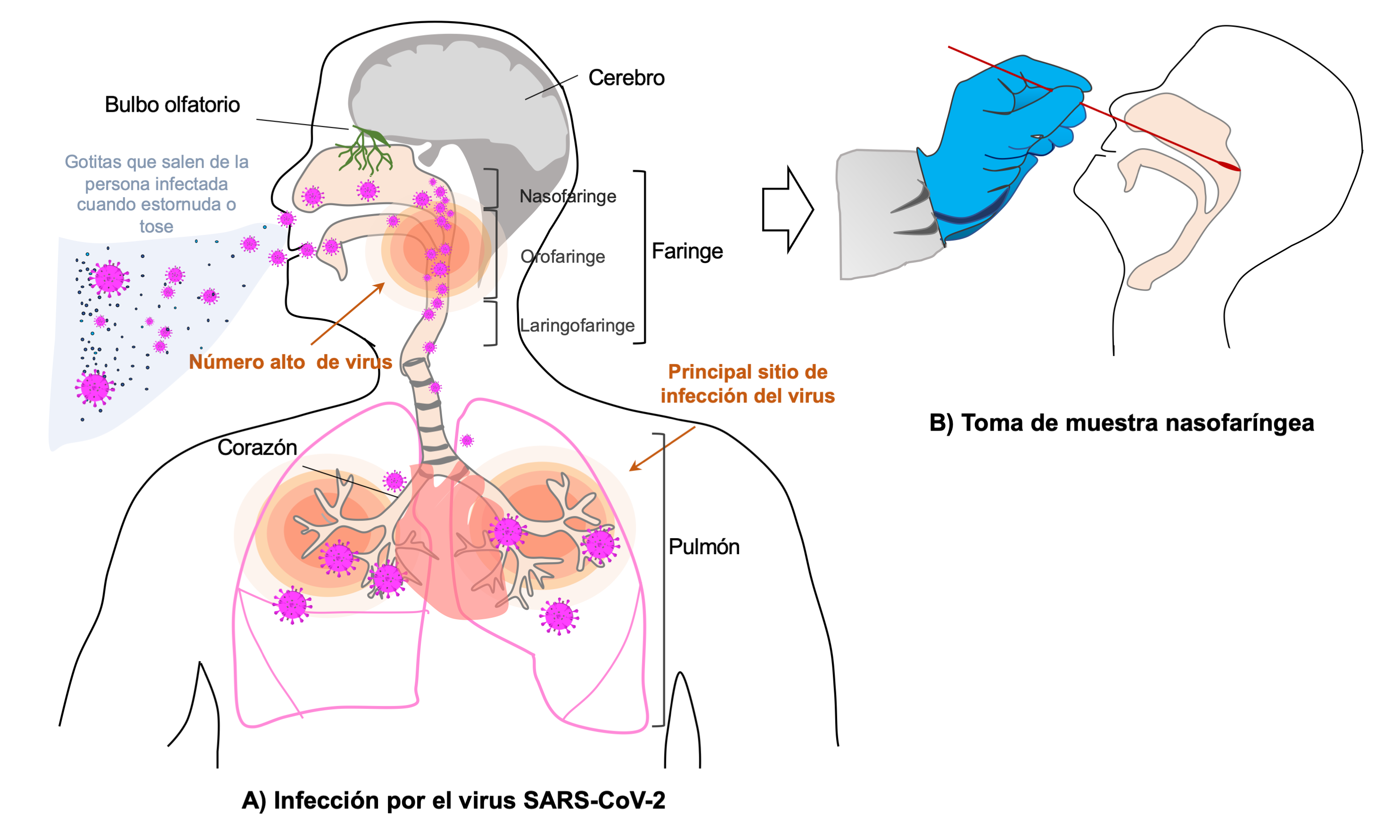
Figura 2. La infección por el SARS-CoV-2. A) Sitios de infección por del SARS-CoV-2 en el cuerpo humano. Los pulmones son el sitio principal donde el virus se replica, pero el virus puede afectar el bulbo olfatorio, el cerebro y el corazón. B) La muestra para la prueba de COVID-19 se toma de la zona de la nasofaringe.
Crédito: elaboración propia.
El ciclo de infección del virus nos indica el tiempo cuando se producen eventos tales como la entrada del virus a nuestro cuerpo, la cantidad de virus que se replican dentro del mismo, cuándo aparecen los síntomas de la enfermedad, el período cuando podemos infectar a otras personas sanas (período infeccioso) y la eliminación de virus en el caso de las personas que logran sanar. Describir este ciclo es relevante en este artículo porque nos proporciona parámetros para saber en qué tiempo se deben realizar las pruebas covid-19 para tener un resultado confiable. La figura 3 muestra el ciclo de infección del sars-CoV-2: el virus entra al cuerpo en un tiempo cero (eje de las X), infecta a las células y comienza a replicarse, incrementado la cantidad de virus en el cuerpo (eje de las Y). Debido a que es imposible conocer el día exacto cuando el virus entra al cuerpo, el tiempo de aparición máxima de síntomas es un punto de referencia en medicina y se usa para identificar el período infeccioso (ver figura 3) (He et al., 2020; Puhach, Meyer, y Eckerle, 2023; Zou et al., 2020). Si la persona monta una respuesta de defensa efectiva contra el virus (respuesta inmune), éste es eliminado en aproximadamente 15 días en la mayoría de los casos.
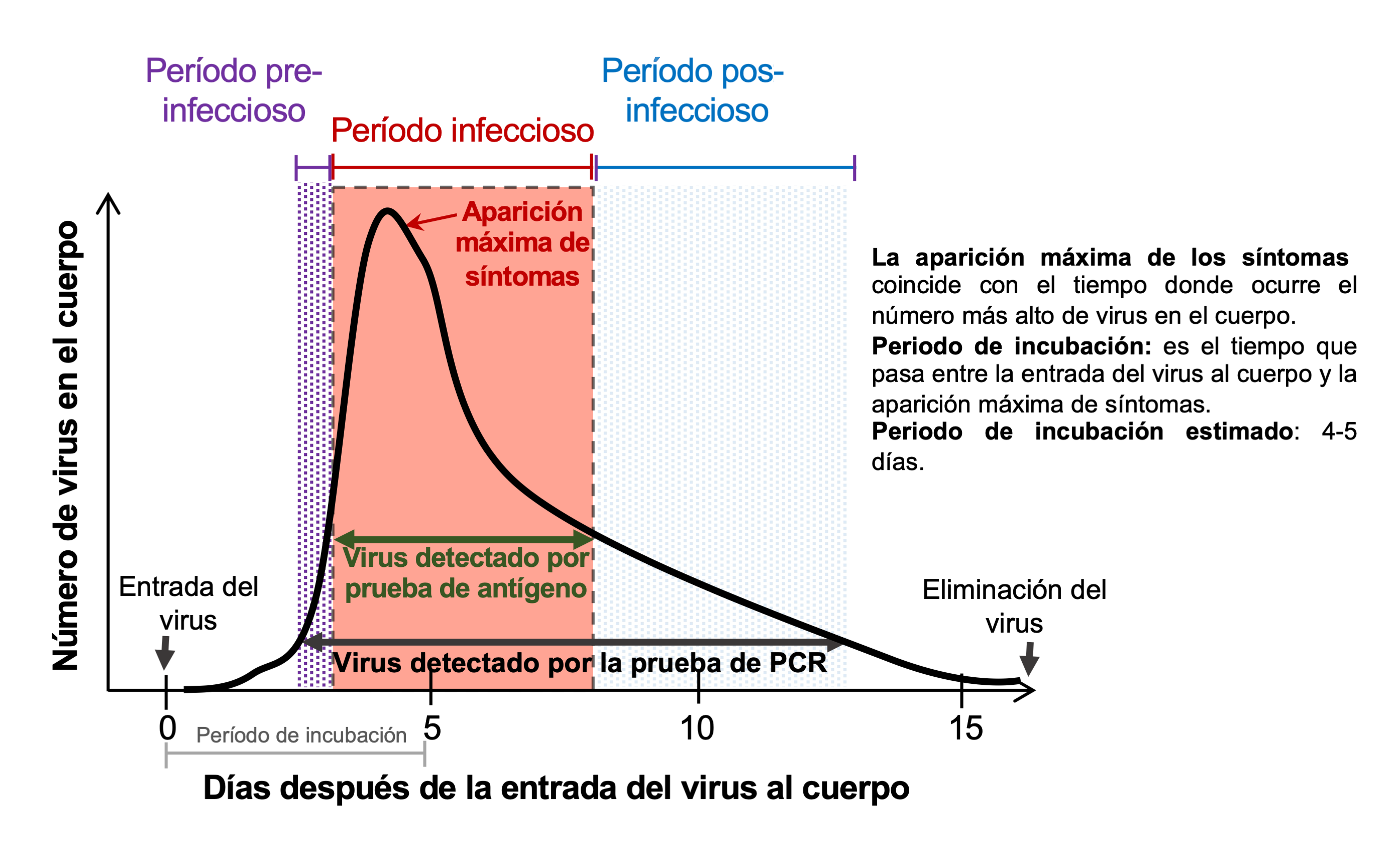
Figura 3. Ciclo de infección del SARS-CoV-2 y los períodos de detección de las pruebas COVID-19. El eje de las X indica el tiempo cuando entra el SARS-CoV-2 al cuerpo (tiempo cero) hasta que es eliminado (alrededor de 15 días) por las defensas naturales. El eje de las Y indica la cantidad de virus que entra al cuerpo, el incremento del número debido a la replicación viral (formación de nuevos virus) y el momento en el que ya no hay virus en el cuerpo. La prueba de PCR detecta al virus antes de que la persona presente síntomas (antes del período infeccioso), durante la aparición de síntomas (período infeccioso), y después de que éstos hayan disminuido o desaparecido. La prueba de antígeno es capaz de detectar al virus sólo cuando hay síntomas, siendo más confiable en el pico de la aparición de estos.
Crédito: La figura es una adaptación de las figuras publicadas en He X et al. 2020; Mina et al., 2020; y Sethuraman, Jeremiah, y Ryo, 2020.
¿Cuáles son los tipos de pruebas covid-19 disponibles?
Hay tres tipos principales de pruebas covid-19: 1) la prueba de pcr, 2) la prueba rápida de antígeno y 3) la prueba de anticuerpos o serológica.
La prueba de pcr (por sus siglas de polymerase chain reaction, término en inglés que se traduce como reacción en cadena de polimerasa) detecta directamente al sars-CoV-2 mediante la identificación de su material genético. El arn identficado es único y distinguible de otro arn proveniente de diferentes virus o microorganismos que pudieran estar presentes. Debido a que el virus infecta las células de la mucosa que recubre la faringe, la muestra se obtiene de la nasofaringe u orofaringe mediante un raspado con un hisopo largo para llegar a la zona.
La prueba rápida de antígeno identifica a una proteína estructural específica del sars-CoV-2, que puede ser la proteína N o bien la S, en muestras de mucosa de la nasofaringe de personas infectadas.
La prueba de anticuerpos o serológica no detecta al sars-CoV-2 sino que identifica un tipo de componente de la respuesta inmune del organismo humano: los anticuerpos. Los anticuerpos se encuentran en mayor concentración en la sangre, por lo que la muestra para esta prueba se toma mediante una picadura de aguja en una vena del brazo.
¿Cuál prueba covid-19 es más confiable para saber si estoy infectado o no?
Las pruebas de pcr y de antígeno son las únicas capaces de detectar si estamos infectados por el sars-CoV-2, ya que identifican al virus directamente. Ambas son confiables, pero esto depende del momento en el que se realice la prueba. Debido a que no podemos saber el momento exacto de la entrada del virus al cuerpo, el período de aparición máxima de los síntomas es el parámetro usado como referencia.
Revisando nuevamente la figura 3 observamos que la prueba de pcr detecta al virus durante un período mayor comparado con la prueba de antígeno. Esto se debe a que la prueba de pcr usa herramientas que detectan pequeñísimas cantidades del virus, de manera que cuando el virus entra al cuerpo y se replica a una cantidad suficiente, esta prueba es capaz de detectarlo, aún si no tenemos síntomas evidentes todavía. La detección es mucho mejor cuando la cantidad de virus se incrementa en el cuerpo y será óptima cuando el virus está en su cantidad máxima. Los estudios indican que la prueba de pcr puede detectar al virus en un período de tiempo que incluye unos días antes del periodo infeccioso, durante, y unos días después; lo cual coincide con el período que incluye antes de la aparición de los síntomas, durante la máxima sintomatología, y poco después de que los síntomas hayan disminuido considerablemente (He et al., 2020; Mina, Parker, y Larremore, 2020; Sethuraman, Jeremiah, y Ryo, 2020).
La prueba de pcr es la prueba más sensible que existe, por lo cual debe usarse para confirmar un diagnóstico de infección por el virus sars-CoV-2. Una prueba positiva de pcr confirma la presencia del virus sars-CoV-2. Una prueba negativa de pcr indica que la persona no está infectada o que ya eliminó al virus del cuerpo. Desafortunadamente este tipo de prueba tiene un costo elevado para el público, ya que se requiere de equipo y reactivos caros y de personal altamente calificado para realizarla. Por las mismas razones, la prueba de pcr requiere más tiempo para realizarse y los resultados tardan más tiempo en otorgarse (24 a 48 horas, dependiendo del laboratorio), comparando con la prueba de antígeno (ver tabla 1).
La prueba rápida de antígeno es menos sensible que la prueba de pcr, ya que requiere que el virus esté en cantidades grandes en el cuerpo para poder detectarlo. La cantidad necesaria del virus para que sea detectable por esta prueba coincide con el período de mayor número e intensidad de los síntomas de la enfermedad, y con el período infeccioso. La gran ventaja de esta prueba es que requiere mucho menos tiempo que la prueba de pcr. Los resultados de la prueba rápida de antígeno suelen entregarse en 1 a 2 horas, dependiendo del laboratorio. Incluso hay algunas pruebas rápidas de antígeno que requieren solo de 15 a 30 minutos para obtener un resultado (Sabat et al., 2023). El costo de la prueba de antígeno es aproximadamente el 30 y 35% del costo de la prueba de pcr. Por estas razones, la prueba de antígeno suele ser la opción elegida cuando la persona tiene síntomas y se requiere un diagnóstico rápido y a costo accesible. Es importante recordar que esta prueba es confiable cuando se realiza durante el período de mayor intensidad de los síntomas. Por tanto, un resultado negativo puede ser falso si la prueba se realiza antes o después de éste (ver tabla 1) (Sabat et al., 2023).
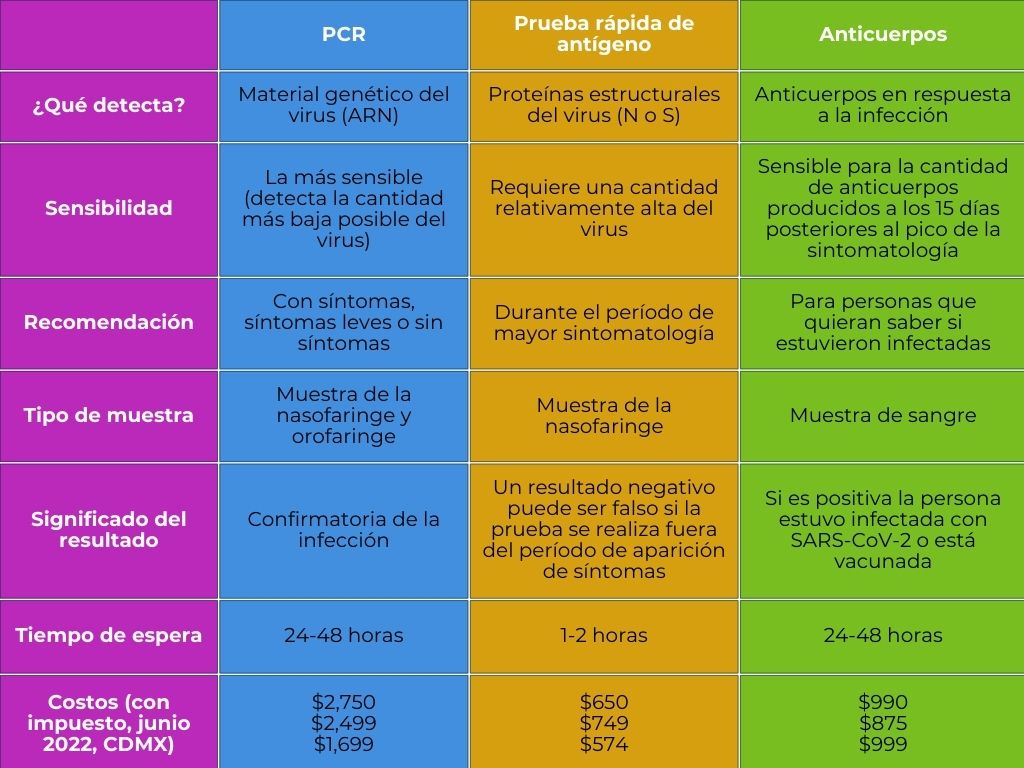
Tabla 1. Resumen de las características de las pruebas COVID-19.
Crédito: elaboración propia.
La prueba de anticuerpos o serológica nos indica si hemos estado infectados por el virus al detectar la presencia de anticuerpos que el cuerpo produce contra dicho virus. También se llama serológica porque la muestra que se analiza es el suero, que es la parte líquida de la sangre. Por su fundamento, pertenece a la categoría de pruebas conocidas como elisa por sus siglas en inglés enzyme-linked immunoassay, que se traduce al español como ensayo inmunoenzimático de absorción.
En este tipo de prueba, la muestra se coloca en una placa que contiene antígenos del virus. Si los anticuerpos contra el virus están presentes en la muestra, se unirá a los antígenos en la placa. Esta prueba se considera altamente sensible, y actualmente se usa principalmente para realizar estudios epidemiológicos dirigidos a saber el número de personas que han estado en contacto con el sars-CoV-2 (Kundu et al., 2022). Es importante saber que esta prueba puede ser positiva si estamos vacunados, por lo que su utilidad en estudios epidemiológicos es ahora limitada (Hayden et al., 2024). La mayoría de las personas producen anticuerpos como respuesta de defensa contra el sars-CoV-2; la cantidad de anticuerpos y su duración varía grandemente entre la población (Lapuente, Winkler, Y Tenbusch, 2024; Roltgen y Boyd, 2024), pero existen estudios que indican el comportamiento general de la producción de anticuerpos a través del tiempo (cinética).
Hay 5 tipos de anticuerpos, también llamados inmunoglobulinas, pero aquí sólo hablaremos de la inmunoglobulina M e inmunoglobulina G (IgM e IgG). El cuerpo humano requiere de días e incluso semanas para poder producir anticuerpos en cantidades suficientes para combatir a la infección. La figura 4 muestra la cinética de producción de anticuerpos IgM e IgG contra el sars-CoV-2 (Chvatal-Medina, Mendez-Cortina, Patino, Velilla, y Rugeles, 2021; Post et al., 2020). Las IgM son los primeros anticuerpos que el cuerpo produce en respuesta a una infección, y esta respuesta de producción de IgM tiene una duración relativamente corta en el cuerpo. Por otro lado, la producción de la IgG se inicia después, pero alcanza niveles mucho más altos y dura mucho más tiempo. La respuesta protectora de anticuerpos a largo plazo la proporcionan los anticuerpos IgG, y es lo que conocemos como inmunidad.
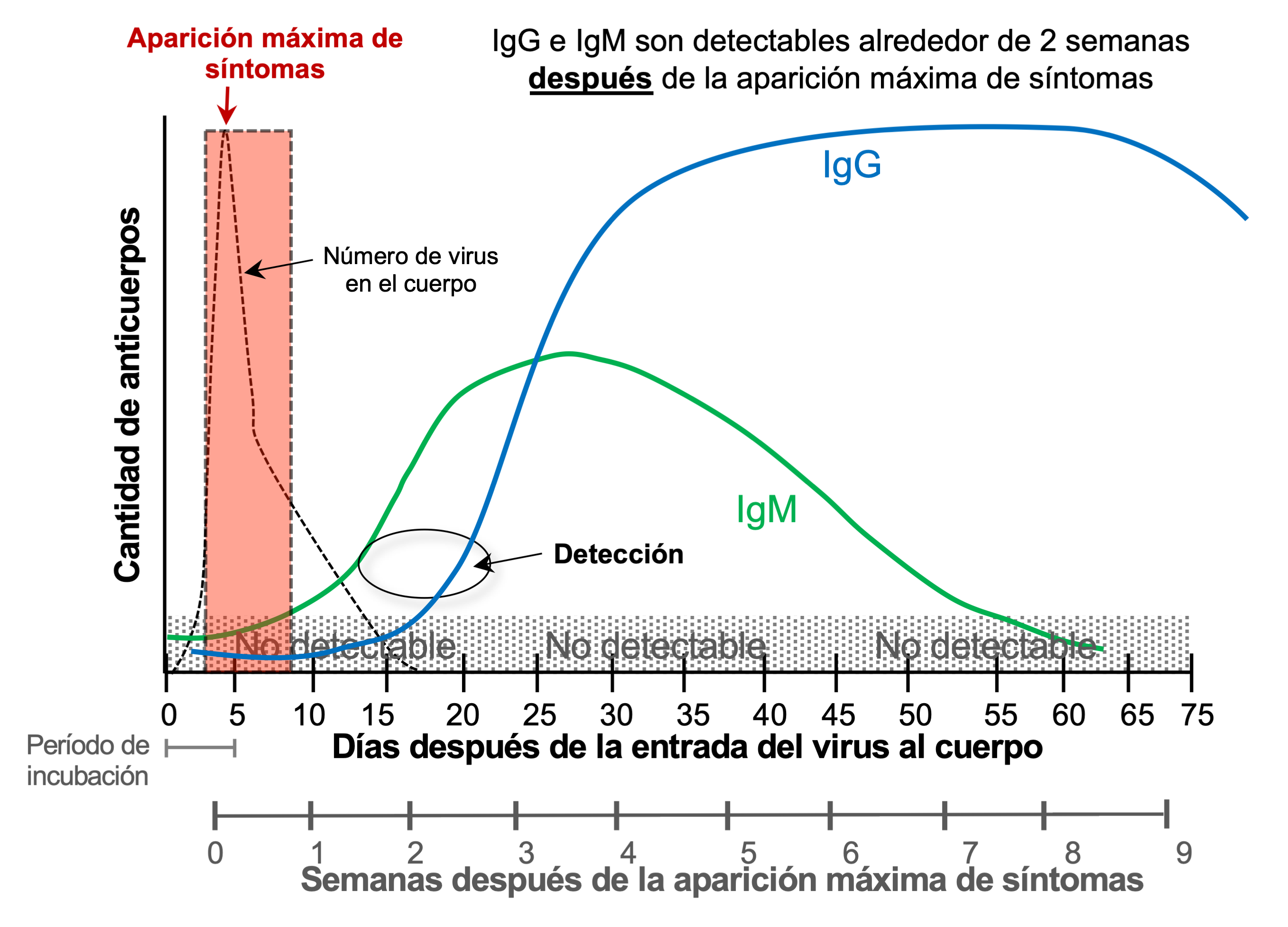
Figura 4. Cinética de producción de anticuerpos IgM e IgG en respuesta a la infección por el SARS-CoV-2.
Crédito: elaboración propia a partir de la información de Chvatal-Medina et al., 2021 y Post et al., 2020.
Una persona que ha desarrollado inmunidad será capaz de reconocer rápidamente al virus y disparar las defensas del organismo lo suficientemente fuerte para evitar que vuelva a enfermarse (Lapuente et al., 2024). La cinética nos ayuda a entender que los anticuerpos son detectables hasta alrededor de 2 semanas posteriores a la aparición máxima de los síntomas de la enfermedad (ver figura 4). También podemos observar que después de un tiempo los anticuerpos disminuyen y puede llegar a ser indetectables. Las pruebas comerciales ofrecen la determinación de IgG, de IgM o de ambos tipos de anticuerpos (anticuerpos totales) (ver tabla 1). Las pruebas de anticuerpos comerciales no son capaces de determinar el tiempo cuando estuvimos infectados o cuando fuimos vacunados, tampoco si estamos protegidos ante infecciones posteriores.
Conclusiones
Es relevante comprender la variedad de pruebas diagnósticas disponibles para covid-19 y cómo elegir la más adecuada según las circunstancias individuales. Las pruebas de diagnóstico, como la de pcr, las pruebas rápidas de antígenos y la de anticuerpos, ofrecen diferentes ventajas en cuanto a sensibilidad, rapidez y propósito de uso. Por ejemplo, las pruebas de pcr son altamente sensibles y específicas, ideales para detectar la infección activa, mientras que las pruebas de antígenos son más rápidas y convenientes para la detección temprana en entornos de alta transmisión. Las pruebas de anticuerpos pueden indicar exposición previa al virus. Seleccionar la prueba adecuada depende de factores como los síntomas presentados, la exposición potencial al virus y la necesidad de resultados rápidos.
No hay que olvidar que el precio de las pruebas es un factor importante. Por ejemplo, la prueba rápida de antígeno es mucho más barata que las otras pruebas disponibles. En este contexto, las pruebas rápidas pueden ser las pruebas de elección por su bajo costo y rapidez de resultados, y pueden ser útiles en áreas de alta transmisión del virus y para detecciones masivas. Sin embargo, las autoridades sanitarias internacionales y mexicanas respaldan oficialmente el uso de la prueba de pcr como estándar de oro para el diagnóstico de covid-19, debido a su precisión y fiabilidad en la detección del virus.
En conclusión, es esencial consultar con profesionales de la salud para determinar cuál es la prueba más apropiada en cada situación, asegurando así una detección precisa y una gestión efectiva de la enfermedad. Además, comprender las limitaciones y características de cada prueba contribuye a una toma de decisiones informada y una respuesta eficaz frente al covid-19.
Referencias
- Chvatal-Medina, M., Mendez-Cortina, Y., Patino, P. J., Velilla, P. A., y Rugeles, M. T. (2021). Antibody Responses in covid-19: A Review. Front Immunol, 12, 633184. https://doi.org/10.3389/fimmu.2021.633184
- da Silva Torres, M. K., Bichara, C. D. A., de Almeida, M., Vallinoto, M. C., Queiroz, M. A. F., Vallinoto, I., Freitas Queiroz, M. A., Cayres Vallinoto, I. M. V., Melo dos Santos, E. J., Marques de Carvalho, C. A., Vallinoto, A. C. R. (2022). The Complexity of sars-CoV-2 Infection and the covid-19 Pandemic. Front Microbiol, 13, 789882. https://doi.org/10.3389/fmicb.2022.789882
- Hayden, M. K., El Mikati, I. K., Hanson, K. E., Englund, J. A., Humphries, R. M., Lee, F., Loeb, M., Morgan, D. J., Patel, R., Al Ta’ani, O., Nazzal, J., Iqneibi, S., Amarin, J. Z. Sultan, S., Falck-Ytter, Y., Morgan, R. L., Hassan Murad, M., Bhimraj, A., Mustafa, R. A. (2024). Infectious Diseases Society of America Guidelines on the Diagnosis of covid-19: Serologic Testing. Clinical Infectious Diseases, ciae121. https://doi.org/10.1093/cid/ciae121
- He, X., Lau, E. H. Y., Wu, P., Deng, X., Wang, J., Hao, X., Chung Lau, Y., Wong, J. Y., Guan, Y., Tan, X., Mo, X., Chen, Y., Liao, B., Chen, W., Hu, F., Zhang, Q., Zhong, M., Wu, Y., Zhao, L., … Leung, G. M. (2020). Temporal dynamics in viral shedding and transmissibility of covid-19. Nature Medicine, 26(5), 672-675. https://doi.org/10.1038/s41591-020-0869-5
- Hu, B., Guo, H., Zhou, P., y Shi, Z. L. (2021). Characteristics of sars-CoV-2 and covid-19. Nat Rev Microbiol, 19(3), 141-154. https://doi.org/10.1038/s41579-020-00459-7
- Kundu, D., Gautam, P., Dayanand, D., Gunasekaran, K., Manesh, A., Sebastian, M., Abhilash, K. P. P., Zachariah, A., George, T., Sathyendra, S., Hansdak, S. G., Abraham, o. C., Iyadurai, R., Thangakunam, B., Gupta, R., Karthik, R., Moorthy, M., Varghese, G. M. (2022). The role and diagnostic accuracy of serology for covid-19. bmc Infect Dis, 22, 390. https://doi.org/10.1186/s12879-022-07361-y
- Lapuente, D., Winkler, T. H., y Tenbusch, M. (2024). B-cell and antibody responses to sars-CoV-2: infection, vaccination, and hybrid immunity. Cell Mol Immunol, 21(2), 144-158. https://doi.org/10.1038/s41423-023-01095-w
- Mina, M. J., Parker, R., y Larremore, D. B. (2020). Rethinking Covid-19 Test Sensitivity – A Strategy for Containment. New England Journal of Medicine, 383(22), e120. https://doi.org/10.1056/NEJMp2025631
- Post, N., Eddy, D., Huntley, C., van Schalkwyk, M. C. I., Shrotri, M., Leeman, D., Rigby, S., Williams, S. V., Bermingham, W. H., Kellam, P., Maher, J., Shields, A. M., Amirthalingam, G., Peacock, S. J., Ismail, S. A. (2020). Antibody response to sars-CoV-2 infection in humans: A systematic review. PLoS One, 15(12), e0244126. https://doi.org/10.1371/journal.pone.0244126
- Puhach, O., Meyer, B., y Eckerle, I. (2023). sars-CoV-2 viral load and shedding kinetics. Nat Rev Microbiol, 21(3), 147-161. https://doi.org/10.1038/s41579-022-00822-w
- Röltgen, K., y Boyd, S. D. (2024). Antibody and B Cell Responses to sars-CoV-2 Infection and Vaccination: The End of the Beginning. Annu Rev Pathol, 19, 69-97. https://doi.org/10.1146/annurev-pathmechdis-031521-042754
- Sabat, J., Subhadra, S., Rath, S., Ho, L. M., Satpathy, T., Pattnaik, D., Pati, S., y Turuk, J. (2023). A comparison of sars-CoV-2 rapid antigen testing with realtime rt-pcr among symptomatic and asymptomatic individuals. bmc Infect Dis, 23, 87. https://doi.org/10.1186/s12879-022-07969-0
- Satarker, S., y Nampoothiri, M. (2020). Structural Proteins in Severe Acute Respiratory Syndrome Coronavirus-2. Archives of Medical Research, 51(6), 482-491. https://doi.org/10.1016/j.arcmed.2020.05.012
- Sethuraman, N., Jeremiah, S. S., y Ryo, A. (2020). Interpreting Diagnostic Tests for sars-CoV-2. jama, 323(22), 2249-2251. https://dpoi.org/10.1001/jama.2020.8259
- Tebha, S. S., Tameezuddin, A., Bajpai, S., y Zaidi, A. K. (2024). sars-CoV-2-Virus structure and life cycle. Prog Mol Biol Transl Sci, 202, 1-23. https://doi.org/10.1016/bs.pmbts.2023.09.001
- Zou, L., Ruan, F., Huang, M., Liang, L., Huang, H., Hong, Z., Yu, J., Kang, M., Song, Y., Xia, J., Guo, Q., Song, T., He, J., Yen, H. Peiris, M., Wu, J. (2020). sars-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. New England Journal of Medicine, 382(12), 1177-1179. https://doi.org/10.1056/NEJMc2001737
Recepción: 2024/04/05. Aceptación: 2024/04/18. Publicación: 2025/05/09.


