Vol. 24, núm. 2 marzo-abril 2023
Alcaloides en la cultura: plantas y hongos alucinógenos mexicanos
Francisco Javier Luna Vázquez CitaResumen
Se presenta una reflexión acerca del papel que han realizado las plantas y hongos alucinógenos en la construcción de mitos y rituales, así como en la afirmación de una realidad más allá de lo tangible en la que ocupan un lugar particular las prácticas que buscan la recuperación de la salud. El común denominador en estas plantas y hongos suele ser la presencia de alcaloides con acción sobre el sistema nervioso central, por lo que se pretende entender cómo dichos efectos han tenido resonancia en la construcción de estos mitos y rituales. Dada la diversidad de plantas y culturas que las han utilizado, solamente nos centramos en aquellos ejemplos más representativos en México: toloache, peyote, ololiuqui y los hongos alucinógenos.
Palabras clave: alcaloides, plantas alucinógenas, hongos alucinógenos, peyote, toloache.
Alkaloids in Culture: Mexican hallucinogenic plants and mushrooms
Abstract
In this work, we present a reflection on the role that hallucinogenic plants and mushrooms have played in the construction of myths and rituals, as well as in the affirmation of a reality beyond the tangible in which the practices that seek the recovery of health occupy a particular place. The common denominator in these plants and mushrooms is usually the presence of alkaloids with action on the central nervous system, thus this text is intended to understand the way those effects have taken part in the construction of myths and rituals. Because of the variety of plants and cultures that have used them, here we focus on the most representative examples in Mexico: toloache, peyote, ololiuqui, and hallucinogenic mushrooms.
Keywords: alkaloids, hallucinogenic plants, hallucinogenic mushrooms, peyote, toloache.
Introducción
Probablemente en todas las culturas y pueblos, a lo largo del tiempo, los alcaloides han participado en la construcción de mitos, rituales y en la afirmación de una realidad más allá de lo tangible. Asimismo, ocupan un lugar particular las prácticas de chamanismo y en la búsqueda de la recuperación de la salud y de respuestas ante los sucesos desconcertantes o desafortunados. Para comprender el alcance de los alcaloides tendríamos que empezar por entender qué son y el porqué de su importancia.
Los alcaloides son metabolitos secundarios, o sea, compuestos sintetizados por los seres vivos como respuesta adaptativa al medio ambiente. Éstos presentan efectos fácilmente observables sobre el ser humano. Entre los alcaloides encontramos a la morfina, procedente de la amapola; la cocaína, de la planta de coca; la nicotina, del tabaco; o la cafeína, del café.
Otros alcaloides que presentan efectos psicotomiméticos sobre el sistema nervioso central, o sea, que producen delirios, alucinaciones o alteraciones en la percepción, fueron un aporte fundamental no sólo para la medicina tradicional, sino también en el desarrollo de prácticas rituales y la creación de mitos y cosmogonías 1 en los diversos pueblos que los conocieron y utilizaron. En México se han empleado, en la medicina tradicional y en prácticas rituales, plantas y hongos cuyos efectos han llamado la atención desde la época prehispánica hasta nuestros días, al inducir cambios en la percepción de la realidad y en la conciencia (ver tabla 1).
Tabla 1. Regiones donde se usan las diferentes plantas y hongos con efecto alucinógeno
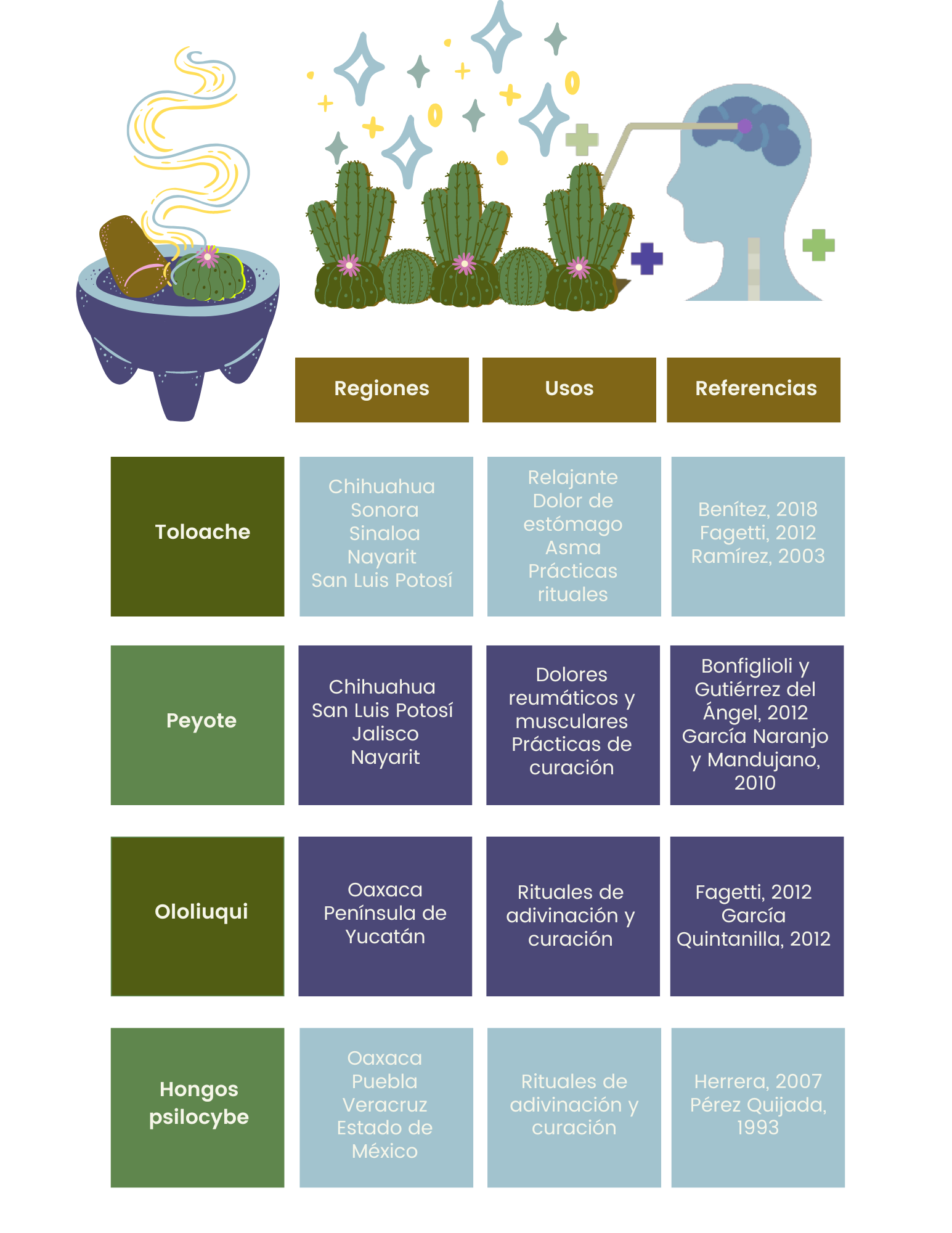
Crédito: elaboración propia.
En el presente texto hablaremos de algunas de las especies más conocidas, buscando una comprensión desde la perspectiva científica de los usos y significados que estas plantas y hongos han tenido y siguen teniendo para las culturas originarias de nuestro país.
Toloache
Toloache o toloatzin en náhuatl (ver figura 1). Su nombre científico es Datura inoxia (Benítez et al., 2018; Martínez, 1991). El toloache se menciona en el Códice De la Cruz Badiano como remedio para los dolores de tipo nervioso (Biblioteca Digital de la Medicina Tradicional Mexicana, 2009a); también se le ha utilizado como relajante muscular y nervioso (Martínez, 1991). En la medicina tradicional mexicana se emplea para aliviar el reumatismo, dolor de estómago, asma y dolores musculares (Biblioteca Digital de la Medicina Tradicional Mexicana, 2009a). Sin embargo, el toloache, al igual que otras muchas plantas, ha tenido un significado más allá de estos usos medicinales.

Figura 1. Planta de toloache. Crédito: Valke, 2016.
Diversos pueblos originarios la mencionan en su cosmogonía y es parte de diversos rituales: para los huicholes, el toloache es Kieri Tewiyari, brujo mítico responsable de la enfermedad y el engaño (Hernández, 1997) y lo consideran contrario o enemigo del peyote. Esta relación entre ambas plantas alucinógenas se presenta también en los pueblos de la Huasteca, en los que relacionan la bondad al peyote y la maldad al toloache; plantas que finalmente terminan asociando a Lahax, dios del fuego (Muñoz-Mendoza, 2017). Por su parte, los tarahumaras utilizan el toloache como intermediario con los espíritus de los muertos, para pedirles su intervención para propiciar la lluvia, siendo los chamanes los únicos que pueden hacer uso de la planta (Gaudreau y Gagnon, 2005).
Los componentes responsables de los efectos psicoactivos de esta planta son los alcaloides atropina, hiosciamina y escopolamina (Gaire y Subedi, 2013). Estos compuestos, como muchos otros alcaloides, tienen su acción sobre el sistema nervioso, al modificar la acción de ciertos neurotransmisores.
Los neurotransmisores son moléculas que establecen la comunicación entre las neuronas: una neurona libera el neurotransmisor y otra lo recibe a través de una estructura llamada receptor. Esto pudiera entenderse si se piensa en un partido de beisbol: la pelota es el neurotransmisor y sólo es posible atraparla si se tiene el guante en la mano (el cual sería el receptor).
Los alcaloides que provienen del toloache tienen acción sobre cierto tipo de receptores llamados receptores muscarínicos, bloqueando la acción del neurotransmisor acetilcolina (Fatima et al., 2015). Nuevamente pensemos en el partido de beisbol, si se tiene una pelota sostenida con el guante, difícilmente podrá atrapar otra. El bloqueo de estos receptores lleva a una alteración en la liberación de otro neurotransmisor, la dopamina. Esto provoca un estado de confusión mental, agitación, inquietud, pensamientos incoherentes, desorientación espacio-temporal y alucinaciones (Volgin et al., 2019).
Estos efectos pudieron ser comprendidos como una ventana hacia una realidad alterna que permitiría la comunicación con la divinidad y, por tanto, el conocimiento de las respuestas a diversas inquietudes entre las que se encuentran aquellas relacionadas con el origen de los pueblos, la muerte y la enfermedad. A este efecto se le ha denominado acción enteógena.
Peyote
Denominado peyotl en náhuatl; jíkuri en tarahumara y hikuri en huichol (Martínez, 1991). El peyote (Lophophora williamsii) es una planta de la familia de las cactáceas, que es endémica del desierto de Chihuahua y zonas aledañas (ver figura 2; García Naranjo Ortiz de la Huerta y Mandujano, 2010).

Figura 2. Peyote. Crédito: Dornenwolf, 2013.
Existen registros de su uso en el Códice florentino (Biblioteca Digital de la Medicina Tradicional Mexicana, 2009b). A inicios del siglo xx, el Instituto Médico Nacional lo señala que posee efectos sobre el corazón. Algunos autores refieren su consumo como alucinógeno y estimulante para resistir el hambre, la fatiga y el sueño (Hofmann y Schultes, 1982; Martínez, 1991).
El peyote se emplea en diferentes regiones de México para aliviar dolores reumáticos, dolores musculares, golpes, quemaduras y fracturas. En el norte se emplea contra las picaduras de escorpiones y mordeduras de víboras (Biblioteca Digital de la Medicina Tradicional Mexicana, 2009b). De manera similar al toloache, la importancia mítica del peyote va mucho más allá de estas consideraciones terapéuticas.
El conocimiento del peyote y su uso en diversas ceremonias rituales, adivinatorias y curativas continúan actualmente entre los Tarahumaras y Huicholes. Una de las tradiciones más conocidas es la del pueblo huichol, que lleva a cabo una peregrinación anual hacia la región de Real de Catorce (región a la que ellos llaman Wirikuta), en San Luis Potosí, para la recolección del peyote.
Al peyote se le relaciona directamente con la luz diurna, el sol y la figura mítica Tamatsi Kauyumari, que conduce a los humanos de vuelta hacia la luz cuando sus almas se han perdido en la oscuridad. El peyote, más que curar como medicina, es el vehículo para llevar la ofrenda a la deidad ofendida y así el alma vuelve a recuperar su estado inicial. Por tanto, el peyote es un elemento que ayuda a mantener el equilibrio cósmico (ver video 1; Bonfiglioli y Gutiérrez del Ángel, 2012).
Video 1. Narración del encuentro con el espíritu de Híkuri. Crédito: Alejandro Trejo, 2013.
Para los tarahumaras, fue el Padre Sol, la divinidad creadora, quien deja en la tierra a su hermano gemelo, Jíkuri (el peyote), como gran remedio, como aliado protector, al que, sin embargo, deben de suministrársele ciertos cuidados para mantener su protección. Incurrir en faltas rompe este equilibrio, que deberá ser recuperado con ayuda del chamán, para alcanzar nuevamente la sanación (Bonfiglioli y Gutiérrez del Ángel, 2012).
Aunque posee más de 60 alcaloides, el mayoritario es la mescalina, responsable de su acción alucinógena (Carod-Artal, 2015). La mescalina actúa sobre los receptores de serotonina, la cual es otro neurotransmisor que interviene en la regulación del estado de ánimo y la percepción, entre otras funciones (Berger et al., 2009). La mescalina produce alucinaciones visuales, auditivas, gustativas, olfatorias y táctiles, además de alteraciones en la percepción del tiempo y el espacio (Dinis-Oliveira et al., 2018; Graziano et al., 2016).
Dados estos efectos sobre el sistema nervioso central, es posible comprender el uso de esta planta en la concepción de un espacio y tiempo en otro plano de realidad, así como en los rituales establecidos para alcanzar en este mundo el equilibrio ya sea personal, comunitario o cósmico.
Ololiuqui y Tlitlitzin
Se le llama badoh (Ololiuqui) y badoh negro (Tlitlitzin) en zapoteco. Los aztecas denominaban a la planta Coatlxoxouqui y a las semillas ololiuqui (ver figura 3; Martínez, 1991). Las semillas de ololiuqui (Turbina corymbosa) y tlitlitzin (Ipomoea violacea) han sido consumidas desde la época prehispánica por mayas y aztecas por sus efectos sobre la percepción y la conciencia (Martínez, 1991).

Figura 3. Flor de oloiuqui. Crédito: Ximena Cruz Hidalgo, 2019.
Los zapotecas y mixtecas siguen empleando estas semillas en rituales con fines de adivinación y curación (Fagetti, 2012). El enfermo, a solas con el chamán, consume un preparado de semillas molidas mezcladas con agua o aguardiente para entrar en trance y conocer, en el momento en el que la semilla “le hable”, el origen de aquello que lo aqueja. El conocimiento de estas semillas suele ser reservado a las mujeres parteras y curanderas (Fagetti, 2012). Para los mayas, el ololiuqui o x-táabentum, es un símbolo de la esperanza, el nacimiento y la trascendencia; está asociado a la dualidad muerte-nacimiento, creación-destrucción (García-Quintanilla, 2012).
Estas semillas inducen alucinaciones visuales y auditivas, un estado alterado de la mente y una pérdida de la noción espacio-tiempo. Esta experiencia supone una conexión con la divinidad que permitiría, en última instancia, acceder al conocimiento del futuro o de la causa de una enfermedad (Carod-Artal, 2015).
Los alcaloides presentes en estas semillas son la ergina y la isoergina, los cuales tienen un gran parecido estructural con la serotonina (Carod-Artal, 2015; De Gregorio et al., 2018; Taber et al., 1963). Su acción en el cerebro es muy compleja, dando como resultado la generación de alucinaciones y una percepción alterada de la realidad, que a su vez lleva a suponer la existencia de una realidad extendida donde se busca un encuentro con la divinidad.
Hongos alucinógenos (Psilocybe spp)
Se conocen aproximadamente 230 especies de hongos alucinógenos a nivel mundial, de las cuales 50 se pueden encontrar en México (Carod-Artal, 2015). Muchos han sido empleados desde tiempos prehispánicos por diversas culturas mesoamericanas. Entre las especies más referidas en los ritos mazatecos y zapotecos se encuentran P. mexicana (Pajarito; ver figura 4), P. cubensis (San Isidro); P. caerulescens (Derrumbe) y P. zapotecorum (Corona de cristo) (Guzmán, 2011; Carod-Artal, 2015).

Figura 4. Hongos Psilocibe mexicana o Pajarito. Crédito: Cactu, 2007.
Al inicio de la presencia española en América, se evidenció el uso de estos hongos con fines curativos y rituales, subrayando el efecto alucinógeno. Por ello, fue prohibido (Carod-Artal, 2015; Guzmán, 2011; Herrera, 2007). Sin embargo, su empleo continuó de manera velada y poco a poco fue incorporando elementos de la religión cristiana, prevaleciendo su uso hasta la actualidad en pueblos de la zona mazateca, chinanteca y zapoteca de Oaxaca y entre nahuas del Estado de México, Morelos y Puebla (Guzmán, 2011).
Un momento importante en la difusión de la existencia y uso de estas especies fue a mitad del siglo xx, al ser documentados. El primero en registrarlos fue antropólogo estadounidense Richard Evans Schultes y posteriormente el micólogo Gordon Wasson, quien publica la descripción de una ceremonia ritual mazateca de curación a cargo de la chamana María Sabina (Guzmán, 2011; Herrera, 2007).
Los rituales se pueden llevar a cabo con dos objetivos: curativos o adivinatorios. El consumo de los hongos induce alucinaciones, alteraciones tanto en la conciencia como en la percepción del tiempo y el espacio; también puede experimentarse una variación en las emociones, que van desde el éxtasis y los sentimientos placenteros hasta la ansiedad y la paranoia (Tylš et al., 2014). Así pues, estos efectos pudieran interpretarse como la visita al mundo inmaterial donde, de acuerdo a la cosmovisión mazateca, se encuentran los espíritus y divinidades de la naturaleza.
Para los Mazatecas, la enfermedad es producto de un desequilibrio en la energía, de una ruptura en el orden establecido o una violación de los acuerdos entre el mundo de los humanos y el sobrenatural. Este desequilibrio es originado por sentimientos o pensamientos negativos, o por seres que habitan en la naturaleza. Así, el chamán o chjota chjine (gente que sabe) ofrece los medios al enfermo para encontrar el origen de su enfermedad y poder alcanzar su curación (Maqueda, 2018). El chamán es experto en el manejo de las alucinaciones, y, a partir de ellas, encuentra los instrumentos de curación (Minero Ortega, 2015; Pérez Quijada, 1993). El compuesto que ha sido señalado como el responsable de la acción alucinógena de estos hongos es el alcaloide psilocibina, el cual también tiene un gran parecido al neurotransmisor serotonina.
Conclusión
El consumo de estas plantas y hongos, a través de rituales y ceremonias, ha sido utilizado para conseguir respuestas a diversas inquietudes, entre las que se encuentran aquellas relacionadas con el origen de los pueblos, la muerte y la enfermedad.
Las plantas ocupan un lugar particular en cada cultura, dependiendo de lo que se obtiene o espera de ellas, así como lo que simbolizan. En este sentido, una planta con efectos contundentes en la percepción y la conciencia necesariamente la sitúan en un lugar relevante del universo simbólico y en la interpretación del mundo de la cultura que la conoce y la hace propia.
Cabría entonces preguntarnos: ¿qué plantas actualmente tienen un lugar relevante en nuestra cultura, tanto en nuestro país como a nivel global?
Sitios de interés
- Toloache, planta poco conocida en México (unam)
- El toloache o yerba del diablo (Arqueología mexicana)
- La ruta sagrada del peyote (New York Times)
- Teonanácatl, carne de dios, el nombre azteca para los hongos alucinógenos