Vol. 24, núm. 4 julio-agosto 2023
Historias de un viejo lobo de mar
Lili Pelayo González, Luis M. Burciaga Cifuentes y Claudia J. Hernández Camacho CitaResumen
La historia de vida de los machos de lobo marino de California es resultado de desafíos y adaptaciones que han pasado a través de miles de generaciones. Aunque aún hay muchas incógnitas, ha sido posible rastrear y detallar determinados comportamientos y plantear nuevas hipótesis sobre sus estrategias de vida. Por ejemplo, ahora sabemos que los machos permanecen con su madre durante el primer año. Posteriormente, ya como jóvenes independientes, suelen migrar y habitar otras islas para mejorar sus estrategias para cazar. Al alcanzar la etapa subadulta, siguen siendo inmaduros sexualmente, pero ya realizan sus primeros intentos para reproducirse. Es en la etapa adulta cuando se enfrentan con otros machos para conseguir su territorio reproductivo. Aunque la reproducción se ha establecido como el fin último de esta estrategia de vida, es posible que los machos estén combatiendo para permanecer en la colonia donde se encuentran sus familias de varias generaciones. Estos resultados e hipótesis han sido reconocidos en planes de conservación y manejo de la especie en México.
Palabras clave: lobo marino de California, comportamiento reproductivo, ecoturismo sustentable, Zalophus californianus.
Tales of an old sea lion
Abstract
The life history of male California sea lions is the result of challenges and adaptations that have been passed down through thousands of generations. Although there remain many questions, we have been able to track and detail certain behaviors at their different life stages and to propose new hypotheses about their life strategies. For example, we now know that males remain with their mothers during their first year. Later, when they are young and later as independent juveniles, often migrate and inhabit other islands to improve their hunting strategies. Upon reaching the subadult stage, they are still sexually immature but already making their first attempts to reproduce. It is in the adult stage when they confront other males to claim their reproductive territory. Although studies have established reproduction as their ultimate life strategy goal, it is possible that males also fight to remain in the colony where several generations of their families lived. These results and hypotheses have been taken into account in conservation and management plans for the species in Mexico.
Keywords: California sea lion, reproductive behavior, sustainable ecotourism, Zalophus californianus.
Introducción
El lobo marino de California (Zalophus californianus) es una especie emblemática del Pacífico nororiental debido a que ha habitado sus costas por más de diez millones de años y mantenido en equilibrio la dinámica de su ecosistema. Además, esta especie, por su carisma, se ha convertido en un atractivo turístico en vida libre, por lo que representa un sustento económico para ciertas localidades humanas.
A pesar de ser una especie muy estudiada y conocida, los detalles sobre su comportamiento son escasos y, por ende, poco considerados para su conservación y planeación turística. En particular, ha sido un desafío documentar la historia de vida de los machos de lobo marino de California, porque, a diferencia de las hembras, ellos tienen un mayor rango de dispersión en el océano. Asimismo, su tasa de mortalidad es alta, al estar más expuestos a amenazas (depredadores, enmalle en redes de pesca, contaminantes, entre otros) y sólo es durante la temporada de reproducción (junio-agosto) cuando regresan a las colonias y permanecen en tierra durante algunas semanas (García-Aguilar y Aurioles-Gamboa, 2003).
Las colonias de reproducción de esta especie en México se localizan en la costa occidental de la península de Baja California y dentro del golfo de California (ver figura 1). Estas colonias han experimentado un declive poblacional importante (alrededor de 53%) debido a los eventos de calentamiento marino que modifican la disponibilidad de presas para estos animales (Pelayo-González et al., 2020; Hernández-Camacho et al., 2021). Sin embargo, ciertas colonias han sido resilientes (capacidad de adaptación ante un agente o situación adverso) y se han mantenido en buen estado, por lo que se han convertido en el escenario ideal para estudiar el comportamiento de los machos, y ser una referencia importante de poblaciones saludables ante las condiciones actuales de calentamiento global.
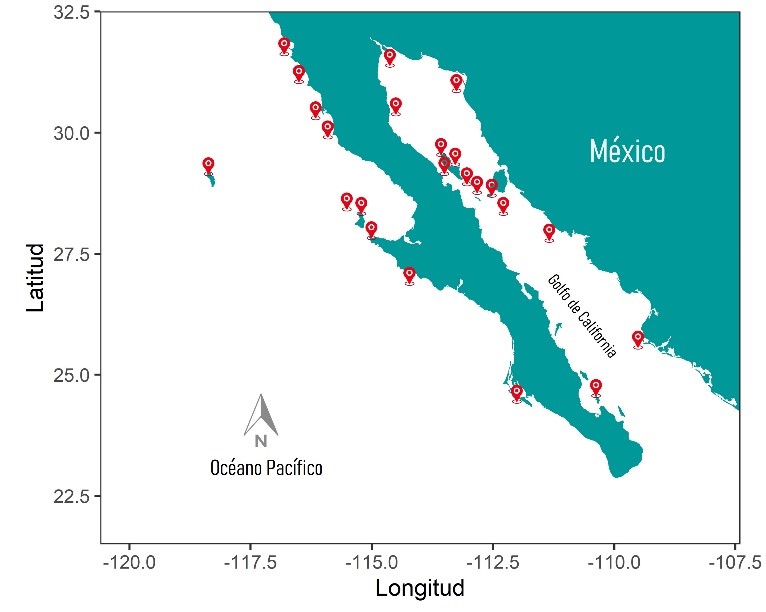
Figura 1. Colonias de reproducción de lobo marino de California en México.
Crédito: elaboración propia.
El lobo marino de California: más que un simple amor de verano
Todos los veranos en las islas, islotes y playas donde se asientan las colonias de lobos marinos, nacen centenas de crías con un tamaño aproximado de 70 cm y 5 kg de peso. Estos recién nacidos permanecen en tierra con sus madres para alimentarse de su leche y relacionarse con las demás crías durante varios días (ver figura 2). Después de que han ocurrido los partos, las hembras adultas se sincronizan y están sexualmente disponibles para el apareamiento. Es por eso que en las colonias se suelen ver machos adultos cuidando su territorio y delimitando a cierto número de hembras para tener acceso a ellas. Una vez llevado a cabo el apareamiento, los machos dejan las colonias y el cuidado de las crías se torna en una tarea exclusiva de las hembras (García-Aguilar y Aurioles-Gamboa, 2003).

Figura 2. Ciclo de vida de los machos de lobo marino de California.
Crédito: elaboración propia.
Después de algunos días, las hembras deben despegarse de sus crías para adentrarse en el mar en busca de alimento. Durante este período de ausencia de las madres, las crías de la colonia suelen formar grupos para interactuar y jugar en las pozas de marea. En cuanto regresan las madres, éstas comienzan a producir ciertas vocalizaciones para llamar a sus crías y continuar con la lactancia. Al término del verano, las crías ya han crecido lo suficiente para empezar a realizar sus primeras inmersiones en el mar y desarrollar sus habilidades en el buceo, lo cual les permitirá volverse buenos cazadores y no depender de la leche materna durante su etapa juvenil (Hernández-Camacho et al., 2021).
La juventud para explorar
La etapa juvenil en los lobos marinos suele comenzar con el destete (las crías ya no se alimentan de la leche materna y comienzan a cazar), aproximadamente al cumplir el primer año de edad. En particular, los machos juveniles que son sexualmente inmaduros suelen ser muy inquietos y empiezan a realizar sus primeros viajes a otras islas lejanas de la colonia donde nacieron, ausentándose cada vez por más tiempo. Este mayor rango de dispersión observado en los machos juveniles ocasiona que se expongan a mayores riesgos como son el encontrarse con depredadores o quedar atrapados en redes de pesca. Durante esta etapa, que suele durar alrededor de cuatro años, van perfeccionando sus técnicas para cazar, van aumentando su tamaño corporal (alrededor de 40 kg y talla de 1 a 1.3 m) y la coloración de su pelaje se torna grisácea (ver figura 2).
Subadultos: juntos, pero no revueltos
Entre los cinco y ocho años los lobos marinos de California comienzan la etapa de subadulto, la cual se diferencia de la etapa juvenil porque los machos ya han adquirido un mayor tamaño (talla entre 1.5 y 2 m), su coloración se ha tornado más oscura y se ha empezado a desarrollar su cresta sagital (protuberancia ósea en la cima de la cabeza que está ligada a los músculos masticadores para proveerle mayor fuerza a la mordida), la cual es una característica única de los machos (ver figura 3).

Figura 3. Diferencia en la forma de la cabeza entre hembras y machos adultos.
Crédito: elaboración propia.
Los machos subadultos suelen encontrarse con más machos de distintas edades en islas denominadas colonias de descanso, en las que permanecen durante el verano para viajar a las islas de reproducción (en su lugar de nacimiento o colonias aledañas) donde se concentran las hembras, y tener sus primeras oportunidades para aparearse (Aurioles-Gamboa et al., 1983). Se piensa que los machos pelean por un territorio en el que hay hembras adultas disponibles para aparearse.
Los subadultos tienen pocas probabilidades de aparearse en comparación con los machos adultos, ya que suelen tener menor fuerza y experiencia; sin embargo, en esta etapa adquieren habilidad y se preparan para la adultez. Estudios genéticos han revelado que las crías no siempre son descendencia del macho territorial, por lo que es posible que las hembras se apareen con otros machos adultos o subadultos durante sus viajes de alimentación (Flatz et al., 2012).
Machos territoriales: el tamaño importa
Los machos adultos son lobos marinos sexualmente maduros con más de nueve años de edad. Su coloración puede ser café oscura o negra, tienen un cuello muy grueso y la cresta sagital completamente desarrollada y prominente, con coloración más clara que el resto del cuerpo (ver figuras 2 y 3). Estos animales suelen pesar entre 200 y 300 kg, y llegan a medir alrededor de 2.5 m (Aurioles-Gamboa y Hernández-Camacho, 2015).
Los machos pelean por un territorio reproductivo que, en la mayoría de las ocasiones, ya está ocupado por otro macho adulto. Los machos deben lucir atractivos para que las hembras los elijan, y al mismo tiempo, dominantes para intimidar a los otros competidores, por lo que pasan el día vocalizando, patrullando y sacando de los territorios a machos subadultos o adultos que se atreven a invadir sus territorios. En éstos se encuentran hembras adultas, juveniles y crías recién nacidas, con espacio disponible para la lactancia y el descanso, así como con pozas de marea donde juegan las crías (ver figura 4).

Figura 4. Machos adultos compitiendo por el territorio reproductivo.
Crédito: elaboración propia.
De acuerdo con la teoría de los sistemas de apareamiento, el territorio es importante porque el macho que lo defiende se apareará con las hembras que lo están ocupando y sus genes pasarán a las siguientes generaciones. Aparentemente, los machos de mayor talla poseerán los territorios más grandes y con más hembras. Estos lugares serán los mejores y los que buscarán los demás machos para competir. Sin embargo, se han planteado nuevas hipótesis basadas en análisis genéticos, en las que los machos territoriales están defendiendo a las hembras con las que están emparentados, ya que nacieron en esa colonia y es posible que estén cuidando a sus familias de varias generaciones (Flatz et al., 2012).
Al terminar cada temporada reproductiva, los machos adultos realizan migraciones de alrededor de 2000 km en busca de alimento para recuperar la energía invertida en la defensa de territorios y el apareamiento (Gearin et al., 2017). Las peleas por la defensa de los territorios los estresa y debilita. Esto junto con la dispersión durante la etapa juvenil y las migraciones anuales en la etapa adulta y subadulta provocan la muerte de muchos machos de lobo marino. De todos los machos que nacen en cada temporada reproductiva, solo entre 10 y 15% alcanza la etapa de la vejez (15-16 años), mientras que 90% de las hembras llegan a esta etapa (Hernández-Camacho et al., 2008).
La alianza entre la ciencia del comportamiento y la planeación turística
En México, las actividades turísticas con lobos marinos en vida libre consisten en observarlos y nadar con ellos. El sitio más importante para realizar estas actividades es la colonia Los Islotes, en La Paz, Baja California Sur, al sur del golfo de California. Normalmente, los lobos marinos ya están habituados a la presencia humana; sin embargo, durante el verano ha sido necesario suspender las actividades acuáticas para no generar estrés en los lobos marinos y para no interrumpir comportamientos críticos de la reproducción y el cuidado materno (ver figura 5; Labrada-Martagón et al., 2005; Hernández-Camacho et al., 2020).

Figura 5. Actividades turísticas en la colonia reproductiva de lobo marino de California, Los Islotes, Baja California Sur.
Crédito: elaboración propia.
Durante la época reproductiva, cuando los machos se establecen, pelean por sus territorios y copulan, las colonias reproductivas de lobos marinos alcanzan su máxima densidad poblacional. Es por ello que los machos en esta época son más agresivos y activos, y suelen observarse peleas entre ellos en los territorios terrestres y acuáticos, produciendo remolinos. Debido a este comportamiento, el nado con lobos marinos durante su reproducción se ha suspendido en Los Islotes para evitar accidentes, sin embargo, es la oportunidad ideal para presenciar comportamientos íntimos como la lactancia, la defensa de territorios y las interacciones entre las crías recién nacidas (Hernández-Camacho et al. 2020).
Conclusiones
El comportamiento de los machos de lobo marino de California ha sido estudiado por muchas décadas tanto en Estados Unidos como en México, y se piensa que sus estrategias de vida son uniformes en todo su rango de distribución. Sin embargo, investigaciones recientes y más detalladas, así como la aplicación de nuevas herramientas (p. ej. genéticas), han permitido establecer nuevas hipótesis sobre su comportamiento reproductivo.
La historia de vida de los machos es sólo una pieza más del rompecabezas dinámico que enfrentan las poblaciones en un océano cambiante y acelerado por el calentamiento global. En el comportamiento animal podemos encontrar respuestas y generar alternativas para recuperar poblaciones de lobo marino de California, ya que éstos son un reflejo de la suma de las interacciones entre seres vivos y su ambiente.
Gracias a los estudios poblacionales, ecológicos y de comportamiento, ha sido posible mejorar las estrategias de manejo de la especie, al favorecer un turismo basado en la observación y no en el contacto directo con los animales.
Agradecimientos
Agradecemos el apoyo y financiamiento del Instituto Politécnico Nacional (ipn) y de la Comisión Nacional de Áreas Naturales Protegidas (conanp). Agradecemos a los estudiantes y voluntarios del Laboratorio de Ecología de Pinnípedos “Burney J. Le Boeuf” del cicimar-ipn y a los capitanes de embarcación que han apoyado las investigaciones por más de treinta años.
Referencias
- Aurioles-Gamboa, D., y Hernández-Camacho, J. (2015). Californian Sea Lion. The iucn red list of threatened species. https://tinyurl.com/5etxrb49
- Aurioles, D., Sinsel, F., Fox, C., Alvarado, E., y Maravilla, O. (1983). Winter migration of subadult male California sea lions (Zalophus californianus) in the southern part of Baja California. Journal of Mammalogy, 64(3), 513-518. https://doi.org/10.2307/1380369
- Flatz, R., González-Suárez, M., Young, J. K., Hernánde-Camacho, C. J., Immel, A. J., y Gerber, L. R. (2012). Weak polygyny in California sea lions and the potential for alternative mating tactics. PLoS One, 7(3), e33654. https://doi.org/10.1371/journal.%20pone.0033654
- García-Aguilar, M. C., y Aurioles-Gamboa, D. (2003). Breeding season of the California sea lion (Zalophus californianus) in the Gulf of California, Mexico. Aquatic Mammals, 29(1), 67-76. https://tinyurl.com/4h4p4fu4
- Gearin, P. J., Melin, S. R., DeLong, R. L., Gosho, M. E., y Jeffries, S. (2017). Migration patterns of adult male California sea lions (Zalophus californianus) [NOAA Technical Memorandum NMFS-AFSC-346]. U.S. Dep. Commer., NOAA Tech. https://doi.org/10.7289/v5/tm-afsc-346
- Hernández-Camacho, C. J., Aurioles-Gamboa, D., Laake, J., y Gerber, L. R. (2008). Survival rates of the California sea lion, Zalophus californianus, in Mexico. Journal of Mammalogy, 89(4), 1059-1066. https://doi.org/10.1644/07-MAMM-A-404.1
- Hernández-Camacho, C. J., González-López, I., Pelayo-González, L., Aurioles-Gamboa, D., López-Greene, E., y Rosas-Hernández, M. P. (2020). Effective management of the National Park Espíritu Santo, through the governance, planning, and design of an integral strategy for Los Islotes. InSocio-ecological Studies in Natural Protected Areas (pp. 679-704). Springer, Cham. https://doi.org/10.1007/978-3-030-47264-1_33
- Hernández-Camacho, C. J., Pelayo-González, L., y Rosas-Hernández, M. P. (2021). California Sea Lion (Zalophus californianus, Lesson 1828). En A. Ortega-Rubio (Ed.), Ecology and Conservation of Pinnipeds in Latin America (pp. 119-143). Springer, Cham. https://doi.org/10.1007/978-3-030-63177-2_7
- Labrada-Martagón, V., Aurioles-Gamboa, D., y Martínez-Díaz, S. F. (2005). Natural and human disturbance in a rookery of the California sea lion (Zalophus californianus californianus) in the Gulf of California, Mexico. Latin American Journal of Aquatic Mammals, 175-185. https://doi.org/10.5597/lajam00080
- Pelayo-González, L., Hernández-Camacho, C. J., Aurioles-Gamboa, D., Gallo-Reynoso, J. P., Barba-Acuña, I. D., Godínez-Reyes, C., Ramírez-Delgado, D., Ávalos-Téllez, R., Rubio-Rodríguez, U., y Villalobos, H. (2021). Effect of environmental variables on the number of births at California sea lion (Zalophus californianus) rookeries throughout the Gulf of California, Mexico. Aquatic Conservation: Marine and Freshwater Ecosystems, 31(7), 1730-1748. https://doi.org/10.1002/aqc.3545