¿Hacia una nueva “tabla periódica”?
Vol. 22, núm. 2 marzo-abril 2021
¿Hacia una nueva “tabla periódica”?
Iván de Jesús Arellano Palma CitaResumen
En 2019 se celebraron los 150 años de la creación de la tabla periódica por el químico ruso Mendeléiev. En ese siglo y medio, pocos son los cambios que ha sufrido la tabla periódica —el más importante es pasar del acomodo de los elementos de acuerdo con la masa atómica, al del número atómico, que propuso el físico Henry Moseley—, lo que demuestra la validez y el valor del trabajo del químico ruso. Pero ¿algún día existirá un reemplazo a esta tabla periódica? Y si lo tuviera, ¿cuáles serían las razones para ello?
Palabras clave: nuevas tablas periódicas, universalidad química, nuevos elementos, Mendeléiev.
A new “periodic table”?
Abstract
In 2019, the 150th anniversary of the creation of the periodic table by the Russian chemist Mendeleyev was celebrated. In that century and a half, few have been the changes in the periodic table —the most important is the switch from the arrangement of elements according to atomic mass, to the arrangement by atomic number, proposed by physicist Henry Moseley—, which demonstrates the validity and worth of the Russian chemist’s work. But then, will there ever be a replacement for this periodic table? And if it did, what would be the reasons for it?
Keywords: new periodic tables, chemical universality, new elements, Mendeleyev.
El corazón de la química
Una de las imágenes científicas más conocidas es la de la tabla periódica. Su poder de síntesis del conocimiento químico es enorme. Basta saber unos pocos conceptos relacionados con esta ciencia para poder predecir el comportamiento de los elementos químicos; por ejemplo, qué elementos —un elemento es materia constituida por átomos de su misma clase— pueden reaccionar entre sí más fácilmente. Tras 150 años de permanecer casi invariante1 a como la propuso Mendeléiev, un cambio radical parece imposible. ¿Será así?
¿Es universal la tabla periódica?
Enorme fue mi sorpresa al enterarme que en Costa Rica no sólo se utiliza la tabla periódica “clásica”. En ese país centroamericano también se usa la tabla de Gil Chaverri, que fue un químico y físico tico (Mora, 2019). Esa tabla periódica ordena a partir de la estructura electrónica2 a los elementos químicos. Pero ¿por qué utilizar una tabla periódica diferente? Nos enseñaron, al menos así ocurrió conmigo, que la tabla periódica era la mejor forma de acomodar los elementos. ¿Será cierto? ¿O habrá dudas sobre si esa es la mejor configuración posible?
La química es un juego de electrones
Algunos químicos consideran que la tabla periódica, en su configuración actual, no es la mejor forma de acomodar la mayoría de los elementos. Es decir, piensan que algunos deberían ser reubicados. Para ponernos en contexto sobre la tabla periódica y comprenderla necesitamos saber dos cosas. Primera, los elementos de la tabla “desean” parecerse a los que están en el lado derecho de ésta —anteriormente llamados gases nobles, ahora, gases inertes—. En esta familia encontramos al helio, neón, argón, radón, kriptón, xenón y el sintético organesón. Segunda, para llegar a “parecerse” a los gases inertes, los elementos de la tabla periódica ceden, ganan y/o comparte electrones.
Francisco Rebolledo es un químico y literato mexicano, interesado en la divulgación de la ciencia. En sus textos “De palabras y elementos” y “Carbono”, que se encuentran en los libros La ciencia nuestra de cada día, volumen i y ii, respectivamente, Rebolledo compara los comportamientos de los elementos con los seres humanos —más preciso sería llamarlos personalidades—, para entender mejor las propiedades de los elementos químicos.
Por ejemplo, Rebolledo compara al sodio (Na, un alcalino) “con un chico pelirrojo, hiperactivo y siempre ávido por ceder al vecino la canica que no cabe en sus bolsillos” (Rebolledo, 2010, 114). Al estar en la familia i —así se comportan la mayoría de los elementos de esta familia—, al sodio le “sobra un electrón” —la canica—, por lo que siempre desea desprenderse de él. En palabras de Rebolledo “sólo logra quedarse tranquilo cuando se le extrae el trauma que pesa en su conciencia” (Rebolledo, 2010, 114). Por otra parte, al radón —un gas inerte— lo compara “con un venerable anciano, un verdadero budista, que reposa en el nirvana indiferente a los deseos que acosan a casi todos los demás elementos”. Esto se puede entender al saber que el radón es un gas noble que se encuentra casi al final de la tabla periódica; por ende, rarísima vez reacciona con otros elementos, pues no necesita más electrones. Por último, al carbono lo imagina “como una mujer joven y serena, precozmente sabia y equilibrada, con una capacidad infinita de compartir sus bienes” (Rebolledo, 2012, p. 107).
Pero, como ya mencionamos, no todos los químicos están conformes con la ubicación actual de todos los elementos de la tabla periódica.
Reacomodando elementos químicos
Hablemos del hidrógeno (H), que es el elemento más abundante en el universo. Parece ser un paria. Está colocado en la familia i —llamados alcalinos—, pero todos los elementos de ahí son metales —a excepción del H que es un gas—. Requiere de un solo electrón para alcanzar la estabilidad de los gases inertes, por lo que, quizá, sea mejor acomodarlo en la familia xvii, donde se encuentran el flúor o el cloro, que son igual de reactivos que el H.
Otro elemento “rebelde” es el mercurio (Hg). Éste es un metal líquido a temperatura ambiente, caso contrario a los demás miembros de su familia que son metales sólidos. Otros parias son el escandio (Sc) y el itrio (Y), que parecen no encontrar su sitio adecuado en la tabla. Dependiendo de que característica fisicoquímica —como la configuración electrónica, radio atómico o punto de fusión— se tenga como primordial para su acomodo, los elementos de la familia iii —donde se encuentra el Sc y el Y— pueden estar en uno u otro lado de la tabla.
Por estos y otros motivos, en el año 2015, la Unión Internacional de Química Pura y Aplicada (iupac) publicó un proyecto, liderado por Eric Scerri —químico maltés y filósofo de esta disciplina—, para un posible reacomodo de la familia 3 de la tabla periódica. Todas estas críticas han hecho pensar que la tabla periódica necesita más que un simple reacomodo de los elementos químicos. Pero no parece haber un acuerdo. Veamos algunas propuestas.
De árboles, flores, torres y grafos
Las críticas anteriores han convencido a algunos químicos de que se necesita encontrar una nueva configuración para el acomodo de los elementos en una “tabla periódica”. Afortunadamente no hay escasez de ideas. Por ejemplo, las configuraciones en tres dimensiones representan mejor el acomodo de los elementos. La propuesta del químico canadiense Fernando Dufour, que tiene forma de árbol de navidad, es un nuevo intento para rediseñar el acomodo de los elementos químicos. Esta configuración tiene un tronco alrededor del cual los elementos químicos dan giros, haciéndose más ancha llegando al tronco del árbol. Esta nueva configuración deja ver mejor la continuidad donde termina una fila en la tabla periódica actual.
Otra tabla es la de Paul Giguère, llamada Flor en 3D (ver figura 1). Cada “pétalo” representa algo distinto. Por ejemplo, el primero de éstos —verde azulado— contiene a todos los metales alcalinos y en la parte posterior de este mismo pétalo los metales alcalinotérreos —familias i y ii—. El resto de los pétalos contiene los otros elementos químicos.

Figura 1. Flor en 3D del químico Paul Giguere, desarrollada en 1965.
Fuente: Тимохова Ольга, 2009.
Por otra parte, Theodor Benfey desarrolló otra configuración llamada tabla en espiral (ver figura 2), que incluso deja espacios vacíos para colocar los elementos del octavo período y para unos elementos nuevos que llamó superactínidos.3 Éstas no son las únicas configuraciones nuevas, las hay en forma de óvalos, circulares, semicirculares, lazos arcoíris, con muchos colores, etcétera.
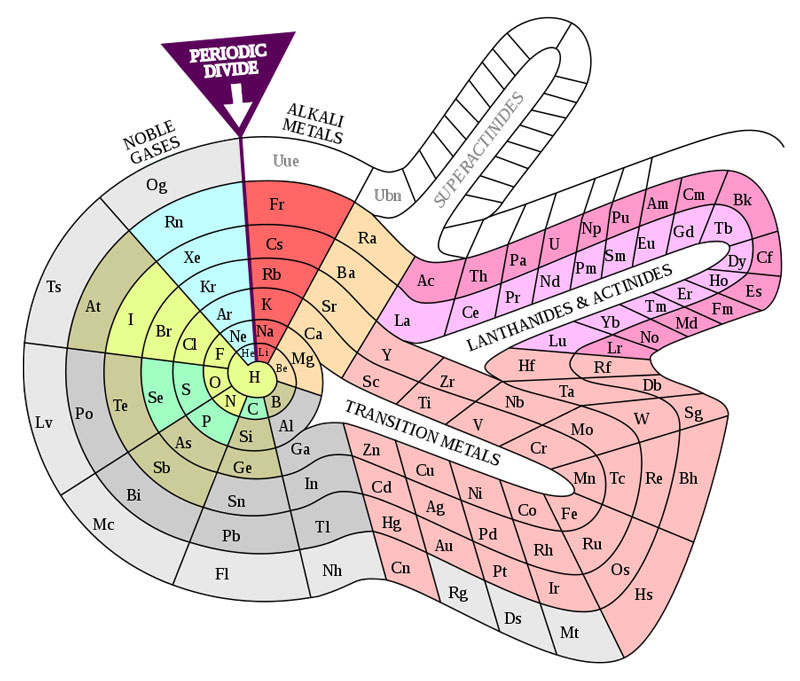
Figura 2. Tabla en espiral del químico Theodor Benfey. Se publicó por primera vez en “The pictorial Periodic Table”.
Fuente: DePiep, 2013a.
No todas las configuraciones desechan el arreglo de la tabla actual como el mejor acomodo de los elementos. Una tabla no tan “radical” la propone el ya citado químico Eric Scerri. Su tabla de forma alargada es más simétrica que la tradicional. En esta configuración el H y el He están uno junto al otro, y los actínidos y lantínidos —los elementos “raros” que están hasta abajo de la tabla periódica y que algunos llevan nombre de científicos, por ejemplo, einstenio, nobelio, etcétera— ya están junto a los otros elementos químicos (ver figura 3). Esta tabla es más simétrica, pues Scerri buscaba maximizar el número de tríadas, los conjuntos de tres elementos químicos que están muy relacionados por sus propiedades fisicoquímicas y sus masas atómicas.
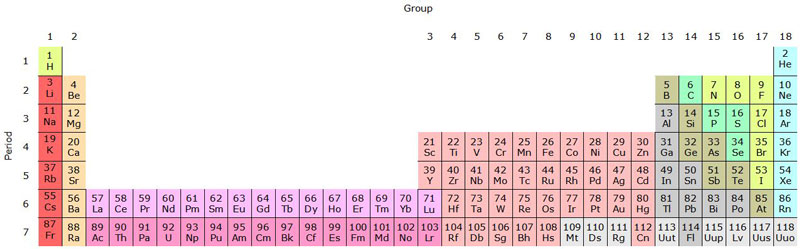
Figura 3. Tabla “alargada” similar a la propuesta por el químico Eric Scerri.
Fuente: Sandbh, 2015.
Por su parte, Valery Tsimmerman en 2006 desarrolló una torre, en la que acomoda los elementos, y no por sus números atómicos. A esta torre la llamó adomah y su configuración organiza a los elementos químicos de acuerdo con los cuatro números cuánticos4 que gobiernan la organización de la tabla periódica. No fue la única configuración propuesta de Tsimmerman, también tiene otra en forma de tetraedro.
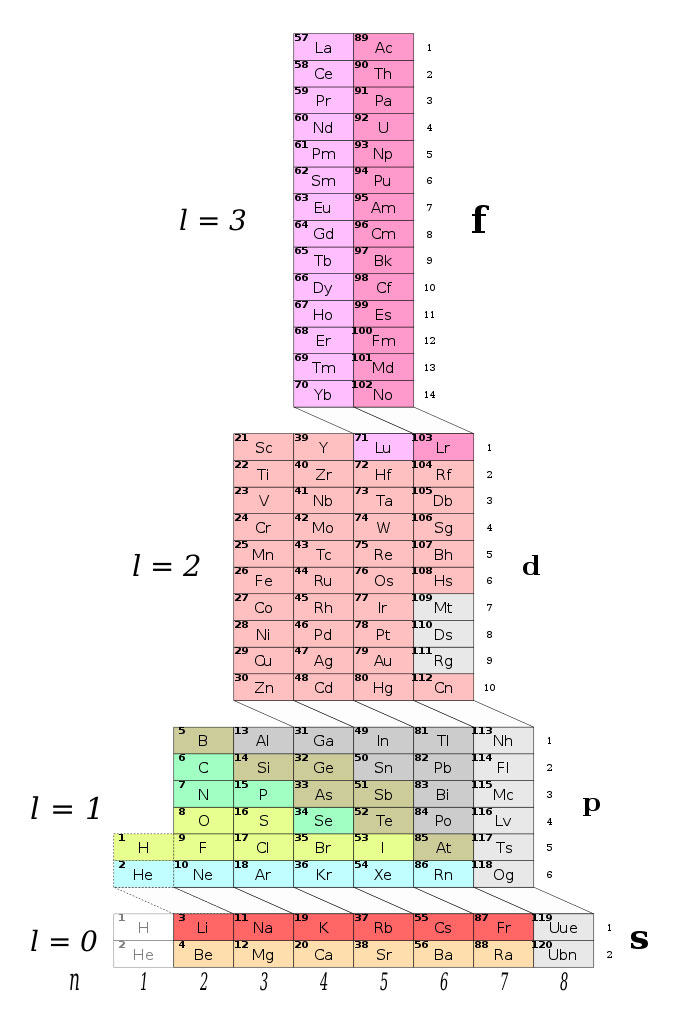
Figura 4. Organización de los elementos en forma de torre (adomah ) de Valery Tsimmerman.
Fuente: DePiep, 2013b.
Por si fuera poco, los matemáticos no han quedado fuera, y también han propuesto una nueva configuración de la tabla periódica. A mediados del año pasado, los investigadores Wilmer Leal y Guillermo Restepo (2019), de los institutos Max Planck, diseñaron una tabla, basada en el orden y la similitud, en forma de hipergrafo, que publicaron en la revista Proceedings of the Royal Society, en abril 2019. Esta nueva configuración adopta diferentes maneras de acomodar los elementos dejando de lado la utopía de que existe una configuración verdadera y única. Esta característica de flexibilidad la hace, para mí, la más atractiva. Y a ti, ¿cuál te parece más adecuada?
Hemos visto que los criterios para aspirar a una nueva configuración en la tabla periódica se deben a desacuerdos de su acomodo, debido a las propiedades fisicoquímicas de los elementos. Pero ¿tendríamos una nueva configuración en la tabla debido al descubrimiento de nuevos elementos? Es decir, ¿faltan muchos elementos por descubrir qué hagan que la tabla periódica mude de forma?
¿Cuál será el último elemento de la tabla periódica?
Era el año 2010 y el período 7 de la tabla periódica fue completado (aunque no fue hasta 2016 que la iupac aceptó ese cambio). Ese año se completó el descubrimiento del elemento 117 llamado teneso (Ts) —anteriormente ununseptio—, por medio de una colaboración entre científicos rusos y estadounidenses en Dubna, Rusia. Si se lograra sintetizar un nuevo elemento químico se debería agregar una nueva fila o período a nuestra actual tabla periódica. Esto suscita preguntas interesantes, por ejemplo: ¿cuándo se descubrirá el elemento 119 llamado provisionalmente unonenio?, ¿quedan muchos elementos químicos por descubrir? y ¿existe un límite o son “infinitos” los elementos químicos?
Al momento de escribir este artículo el elemento más grande es el 118. De estos 118, 91 son encontrados “fácilmente”, ya que son encontrados de forma natural —incluso el tecnecio que fue el primer elemento químico sintetizado y que se creía no se encontraba de manera natural—. A partir de del uranio, los demás elementos químicos han sido sintetizados artificialmente como el neptunio, americio, einstenio, fermio, etcétera. Aunque parece que algunos de éstos pueden ser encontrados naturalmente en minerales como la uraninita. En conclusión, tenemos 98 elementos que se han encontrado en la naturaleza —aunque sea en trazas— y 118 elementos totales.

Figura 5. Ecuación de química nuclear que explica la formación de nuevos elementos químicos.
Los restantes 20 han sido sintetizados en dispositivos que aceleran partículas a altas velocidades para hacerlas colisionar. En resumen, lo que se hace es “disparar” elementos pesados (como el oro) con proyectiles de elementos ligeros (el hidrógeno). Así fueron obtenidos, por ejemplo, los elementos 114 a 118, entre 1999 y 2010. Allí el “proyectil” lanzado era el calcio que bombardeaba a los actínidos pesados.
Lo que se intenta hacer en estos experimentos es que los neutrones de los elementos hagan surgir nuevos elementos químicos (ver imagen 5). Esto conlleva una dificultad técnica considerable y la mayoría de los elementos creados viven sólo milisegundos, por lo que es difícil saber sus propiedades fisicoquímicas. Parecería ser una cuestión de no contar con la tecnología adecuada, incluso si la tuviéramos, ¿encontraremos más elementos?
Las estimaciones sobre cuán grande puede llegar a ser la tabla periódica vienen de una rama de la química apoyada en la física moderna; se le llama química cuántica relativista.5 El brillante físico Richard Feynman, apoyado en la teoría de relatividad de Einstein, predijo que el elemento 137 era el límite para el último elemento de la tabla periódica. Feinmanium es el apodo de este hipotético elemento. Pero ¿qué tiene que ver la teoría de relatividad con la tabla periódica? Pues bien, cuando los núcleos atómicos son cada vez más grandes los electrones deben aumentar su velocidad; por ende, los cálculos de la química cuántica relativista afirman que llegando a un límite los electrones tendrían que ir más rápido que la velocidad de la luz. Imposible.
Posteriormente otros químicos y físicos teóricos han afinado los cálculos para proyectar que el 137 no es el elemento límite. Por ejemplo, Pekka Pyykoo, químico teórico finlandés, experto en química cuántica numérica, ha propuesto un modelo informático-químico para establecer los períodos ocho y nueve de la tabla periódica —hoy son siete—. Además, proyectó que deberían existir 54 elementos más. Es decir, si Pekka tiene razón, la tabla periódica podría albergar hasta un elemento 172, que va mucho más allá de los 118 actuales y el hipotético feinmanium. Esto, sin duda, cambiaría la actual configuración de la tabla periódica.
El fin del reinado de Mendeléiev
“La mitad de la química aún está aún por descubrir: no sabemos cómo y ese es precisamente el reto”
Pekka Pyykko, químico teórico finlandés
La tabla periódica de Mendeléiev ha sido (y seguirá siendo) una herramienta de trabajo invaluable para todo químico. Pero, debido a sus inconsistencias y ciertas limitaciones, es seguro que más temprano que tarde tengamos una nueva configuración, que acomode de mejor manera a los elementos químicos. Entonces, la respuesta a la pregunta con la que abrimos este artículo es sí, seguramente existirá un reemplazo para la tabla periódica. Así es la ciencia, se trata de un conocimiento humano que no es perfecto, pero sí es perfectible. ¿Cuánto tiempo durará la siguiente “tabla periódica”?
Referencias
- Asimov, I. (2013). Breve historia de la química. Alianza.
- DePiep. (2013a, 18 de agosto). adomah periodic table – electron orbitals (polyatomic) [imagen]. https://commons.wikimedia.org/wiki/File:ADOMAH_periodic_table_-_electron_orbitals_(polyatomic).svg.
- DePiep. (2013b, 18 de agosto). Elementspiral (polyatomic) [imagen]. https://commons.wikimedia.org/wiki/File:Elementspiral_(polyatomic).svg.
- Leal, W. y Restrepo, G. (2019, 3 de abril). Formal structure of periodic system of elements. Proceedings of the Royal Society A, 475(2224), 20180581. doi: https://doi.org/10.1098/rspa.2018.0581.
- Mora, K. (2019). Gil Chaverrí: El costarricense que arregló la Tabla Periódica. Ciencia 506. https://ciencia506.com/2019/01/27/gil-chaverri-el-costarricense-que-arreglo-la-tabla-periodica/.
- Rebolledo, F. (2010). La ciencia nuestra de cada día. fce.
- Rebolledo, F. (2012). La ciencia nuestra de cada día ii. fce.
- Sandbh. (2015, 26 de diciembre). 32 column pt [imagen]. https://commons.wikimedia.org/wiki/File:32_column_PT.jpg.
- Scerri, E. (2013). La tabla periódica. Una breve introducción. Alianza.
- Тимохова Ольга (2009, 12 de abril). Mendeleev flower [fotografía]. https://commons.wikimedia.org/wiki/File:Mendeleev_flower.jpg.
Recepción: 19/06/2020. Aprobación: 22/01/2021.


