Explotando el código dulce: aplicaciones biomédicas de las lectinas
Vol. 24, núm. 4 julio-agosto 2023
Explotando el código dulce: aplicaciones biomédicas de las lectinas
Jorge Luis Medrano Cerano, Eduardo Leyva Hernández y Enrique García Hernández CitaResumen
El descubrimiento de las lectinas data de hace más de cien años. Se trata de proteínas capaces de unir azúcares. Se destacan principalmente como mediadoras del reconocimiento entre células, un proceso en el que también interviene el glicocáliz, un entramado de azúcares que rodea a las células. El presente artículo pretende resaltar cómo el entendimiento de estas proteínas ha cobrado cada vez más importancia y cómo sus características tan particulares permiten implementarlas como herramientas clave para descifrar el complejo código azucarado que supone el glicocáliz, con el fin de revelar las conversaciones que sostienen las células entre sí. Lo anterior abre una gran oportunidad para el desarrollo de la biomedicina aplicada, con relevancia en el diagnóstico y terapéutica de diversas enfermedades como el cáncer, enfermedades autoinmunes, infecciones, entre otras.
Palabras clave: polisacáridos, glicocáliz, glucocáliz, hemaglutinación, lectinas, glicómica.
Exploiting the sweet code: Biomedical applications of lectins
Abstract
The discovery of lectins dates to more than a hundred years ago. They are proteins capable of binding sugars. They are involved mainly as mediators of recognition between cells, a process in which the glycocalyx, a network of sugars that surrounds cells, also intervenes. This article aims to highlight how the understanding of these proteins has become increasingly important and how their very particular characteristics allow them to be implemented as key tools to decipher the complex sugar code that the glycocalyx represents, as to reveal the conversations that cells have among themselves. This also opens a great opportunity for the development of applied biomedicine, relevant to the diagnosis and therapeutics of diseases such as cancer, autoimmune diseases, infections, among many others.
Keywords: polysaccharides, glycocalyx, hemagglutination, lectins, glycomics.
El complejo papel de los carbohidratos en el cuerpo
Los azúcares o carbohidratos son uno de los tipos de biomoléculas más abundantes en la naturaleza. Podemos encontrarlos como monosacáridos, que es su forma más simple y unitaria, o como polisacáridos o glicanos, que son compuestos formados por varias unidades de monosacáridos (Ghazarian et al., 2011).
Resulta sencillo recordar algunas de las funciones que comúnmente les atribuimos a los carbohidratos. Tenemos el caso de dos de los polisacáridos más abundantes en el planeta, la celulosa y la quitina, que se encargan de cumplir con una función estructural. A la celulosa la podemos encontrar en la pared celular de las plantas, que, junto a sustancias como la lignina y las ceras, se encarga de darle grosor y textura a troncos y hojas para su defensa. Mientras que la quitina es componente principal del exoesqueleto de los artrópodos, proporcionándoles protección contra la desecación y contra sus depredadores, que es responsable del gran éxito de este grupo o filo, que incluye a insectos, arácnidos, crustáceos, entre otros (Nelson, 2005).
Otra de las funciones de los carbohidratos, que seguramente recuerdan la mayoría de nuestros lectores, es la de servir como fuente y reserva de energía. Basta evocar esa clase de biología o bioquímica en la que el profesor les explicaba cómo es que los seres vivos pueden obtener energía a través del ingreso de la glucosa en la tan afamada glucólisis, una ruta metabólica encargada de degradar a este monosacárido, logrando obtener otras moléculas energéticas a cambio de su ruptura.
En el humano, así como en muchos animales, parte del exceso de glucosa obtenida durante la ingesta de alimentos se almacena en el hígado, en forma de glucógeno. Esta molécula es un polímero formado por varias glucosas y puede aprovecharse para mantener la glucemia1 constante durante los períodos entre comidas. Esto resulta de suma importancia para aquellos tejidos que dependen estrictamente de la glucosa durante estas fases de ayuno, como los eritrocitos y el cerebro. El glucógeno también puede sintetizarse en el músculo, aunque éste lo consume cuando requiere realizar la contracción muscular (Ghazarian et al., 2011; Nelson, 2005).
Aparte de servir como fuente de energía, los carbohidratos también desempeñan una importante función como moléculas de señalización, normalmente en forma de polisacáridos o glicanos, que se encuentran anclados de manera covalente2 a lípidos y proteínas, mejor conocidos como glicoconjugados3. Aunque podemos encontrar glicoconjugados en varias partes de la célula, es común que una buena parte de éstos estén en la superficie externa de la membrana celular, proporcionándole a las células una cubierta azucarada comúnmente conocida como glicocáliz (ver figura 1).
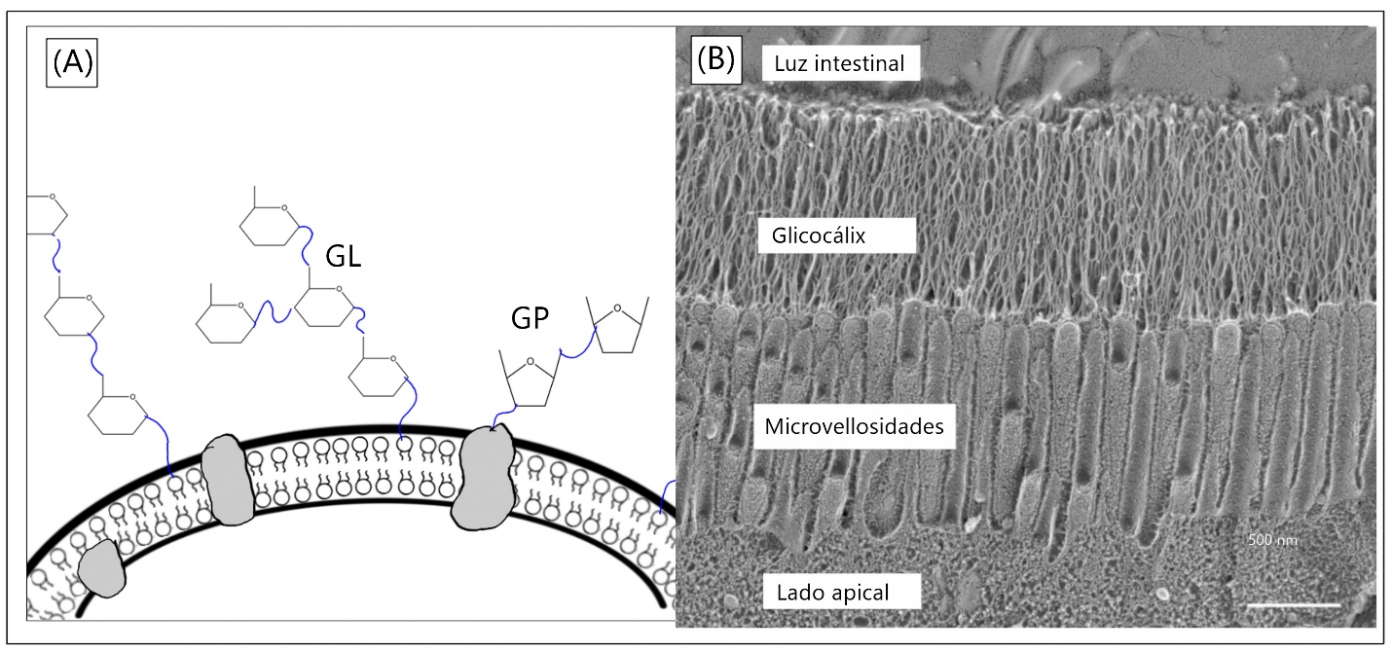
Figura 1. El glicocáliz, la cubierta azucarada de las células. A) Representación gráfica del glicocáliz, donde se observan los glicoconjugados, como las glicoproteínas (GP) y los glicolípidos (GL). B) Micrografía electrónica del extremo apical de un enterocito de ratón4, en donde se puede apreciar el glicocáliz. Crédito: adaptado de Sun et al., 2020.
El glicocáliz es un arreglo denso, asimétrico y complejo de azúcares, con una constitución característica y exclusiva para cada organismo y/o tejido. Esta topografía celular a menudo es comparada con el dosel arbóreo de los bosques, en el que cada capa alberga varios nichos ecológicos. Los carbohidratos que comprenden el glicocáliz presentan una gran diversidad en su composición y estructura, lo que establece diferentes niveles de complejidad (Cohen y Varki, 2014).
La gran variabilidad de la estructura del glicocáliz abre la posibilidad para que esta molécula sirva como portadora de información, rivalizando e incluso llegando a superar la información que nos pueden brindar otras moléculas como los ácidos nucleicos o las proteínas. Al cumplir con todas las cualidades necesarias para considerarse como un sistema de codificación de alta densidad, se le ha otorgado el nombre de código dulce o código azucarado (Gabius, 2018).
De manera general, se puede decir que la función más importante del glicocáliz es la de regular la comunicación entre células, que pueden ser del mismo tejido o de tejidos diferentes, incluso con células de diferentes organismos. Por mencionar algunos ejemplos, el glicocáliz participa en procesos como la adhesión y la diferenciación celular, la migración de las células durante el desarrollo, la infección por patógenos, la diferenciación de lo propio y de lo ajeno, entre muchos otros procesos (Cohen y Varki, 2014; Gabius y Jürgen, 2017).
Las lectinas y su relevancia a través de la historia
Las lectinas son un grupo de proteínas capaces de reconocer y unir de manera específica y reversible a los azúcares, sin alterar su estructura covalente en el proceso. Pueden unir tanto a monosacáridos como a los oligosacáridos derivados de éstos (Gabius y Jürgen, 2017).
La primera lectina en ser documentada fue la ricina, en el año de 1888, aunque para esta fecha el término lectina todavía no se había acuñado. Peter Hermann Stillmark purificó y caracterizó a esta proteína a partir de las semillas del ricino (Ricinus communis), arbusto que también se conoce con los nombres comunes de tártago o higuerilla. Este trabajo lo realizó durante su tesis doctoral, que llevó a cabo en la Universidad de Dorpat (ahora Tartut) en Estonia, cuando ésta aún formaba parte de Rusia.
Debido a su capacidad para aglutinar5 eritrocitos6 (hemaglutinación), se le describió como una hemaglutinina, al igual que muchas de las lectinas que se describieron posteriormente. Al poco tiempo, la ricina fue comercializada y utilizada para entender y desarrollar algunos de los primeros principios de la inmunología. Con ella, se ayudó a establecer a los antígenos7 responsables de la existencia de los grupos sanguíneos del sistema ABO (ver figura 2; Sharon y Lis, 2004).
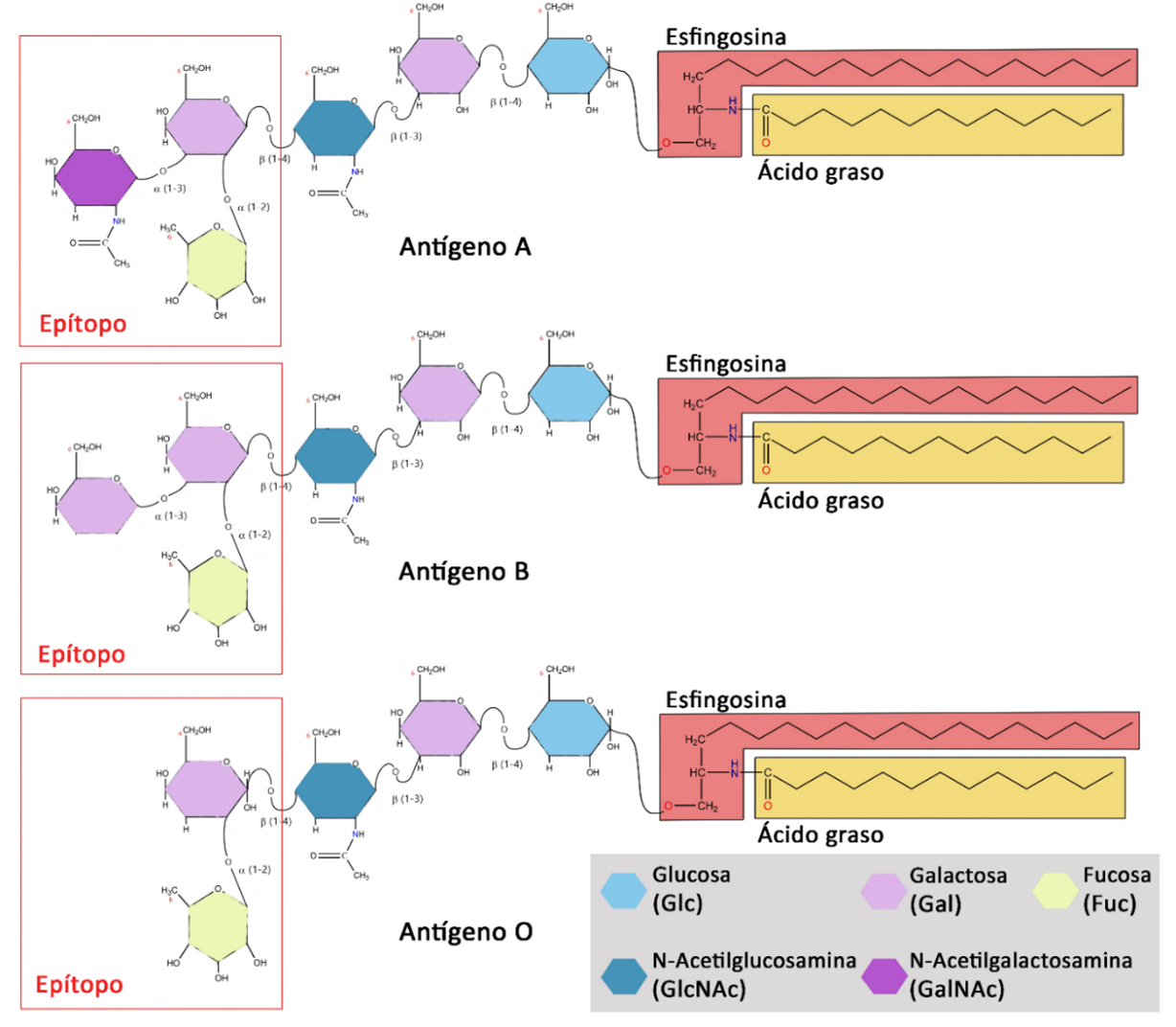
Figura 2. Los polisacáridos como determinantes de los tipos sanguíneos del sistema ABO. Estos antígenos consisten en variaciones de carbohidratos que se encuentran en el extremo terminal de lípidos de la membrana de los eritrocitos o glóbulos rojos. Crédito: elaboración propia con información de Nelson y Cox, 2018.
Como anécdota, a casi un siglo después del descubrimiento de la ricina, ocurrió un hecho que parecía haber salido directamente de una película de espías. En 1978, Georgie Markov, un periodista búlgaro exiliado de su país por oponerse a las políticas de su gobierno, tras continuar su labor antisistema, fue asesinado en el Reino Unido. El arma fue un paraguas con un mecanismo interno que permitió disparar un balín repleto de ricina, que causó en poco tiempo un paro respiratorio en el periodista. Este suceso hizo que la ricina llegara a oído de todos. Sin embargo, la gran mayoría de las lectinas no comparten esta elevada toxicidad, asunto que quedó más claro tan pronto se logró describir a detalle la estructura y la función de esta proteína (Sharon y Lis, 2004).
Por otra parte, se sabe desde la década de 1950 que las lectinas no aglutinan por igual a todos los grupos sanguíneos y que cada una tiene su propio perfil de hemaglutinación. Esta selectividad se basa en que poseen diferentes afinidades para cada tipo de azúcar. Fue gracias a esta capacidad de distinguir entre los distintos tipos sanguíneos lo que llevó a los investigadores William C. Boyd y a Elizabeth Shapleigh, de la Universidad de Boston, a bautizar a estas proteínas como lectinas. El nombre proviene de la palabra lectus, pasado participio del verbo latino legere, que significa seleccionar o escoger (Espino-Solis, 2015; Gabius y Hans, 2016).
El interés por las lectinas se consolidó durante la siguiente década, cuando C. Nowell encontró que la fitohemaglutinina de guisante podía inducir la mitosis en linfocitos. A este descubrimiento le siguió el de Joseph C. Aub, que en 1965 reportó que la aglutinina de germen de trigo (agt) es capaz de reconocer y aglutinar de manera preferencial a células malignas sobre sus contrapartes normales (ver figura 3; Sharon y Lis, 2004). Esto se debe a que en el cáncer normalmente empieza a observarse la producción inusual de nuevos y diversos tipos de glicoconjugados, que no están presentes en la célula en condiciones normales. A este fenómeno se le conoce como glicosilación aberrante, e involucra un cambio en la forma y composición del glicocáliz (Kuo et al., 2018).
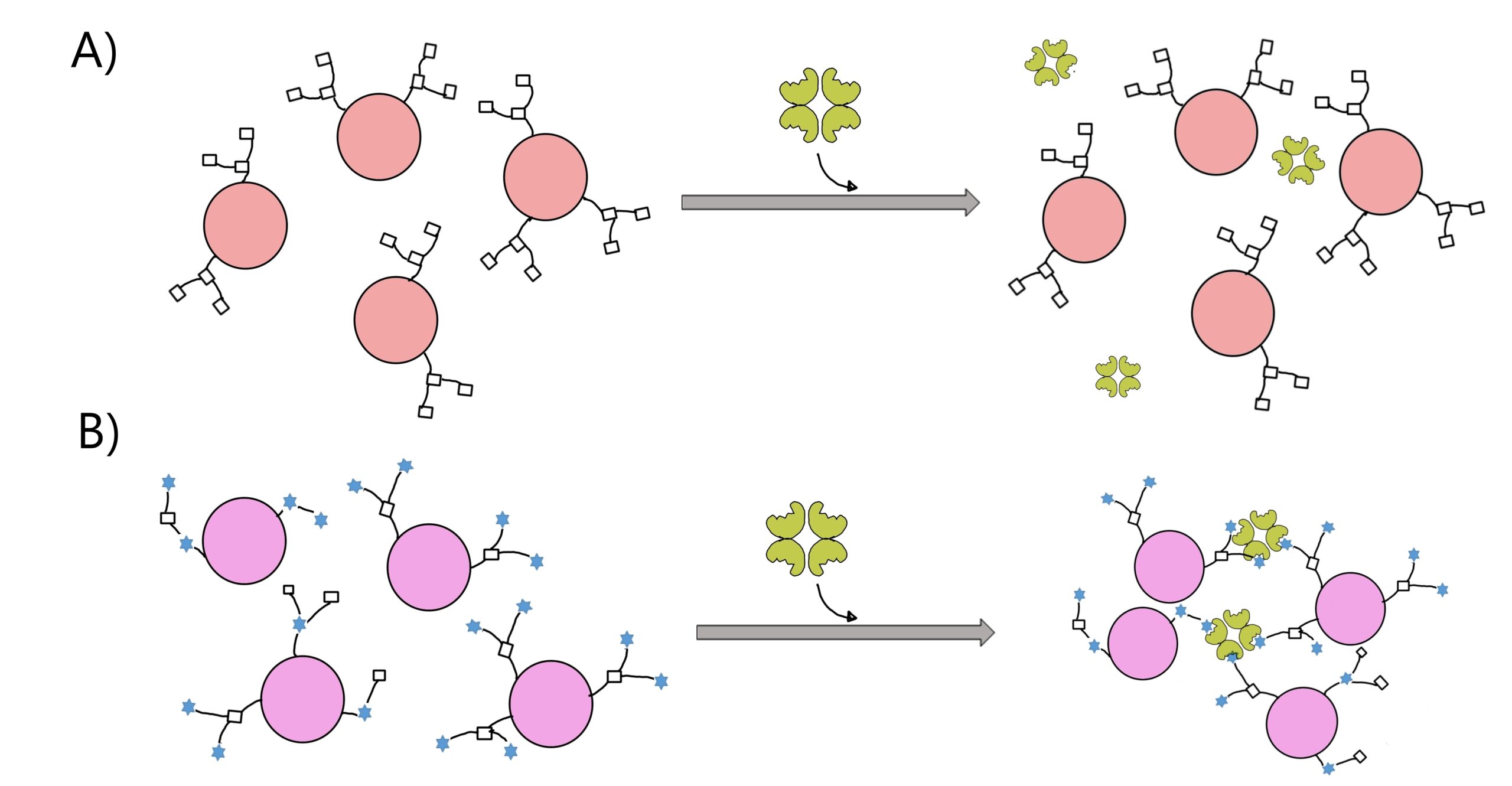
Figura 3. Aglutinación preferencial de células malignas por la aglutinina de germen de trigo (AGT). A) Las células normales con glicosilación normal no son reconocidas ni aglutinadas por la agt. B) En cambio, las células malignas, al presentar una glicosilación aberrante, pueden ser reconocidas y aglutinadas por la AGT. Crédito: elaboración propia.
Ubicuidad y papeles que desempeñan las lectinas en los seres vivos
Era muy común que en el pasado se refirieran a las lectinas como fitohemaglutininas, puesto que se pensaba que eran una exclusividad del reino vegetal. Sin embargo, con el paso de los años, el número de lectinas descritas en la literatura ha ido aumentando y su presencia no se ha limitado a plantas, pues se hayan en todos los reinos de la vida.
La mayor parte de las lectinas de plantas se han encontrado en los cotiledones y endospermos8 de las semillas, y la hipótesis más recurrente establece que se encargan de proteger a las semillas, durante su germinación, de ataques de insectos depredadores o de la infección causada por microorganismos. Las lectinas de animales suelen desempeñar funciones como la de aglutinar agentes extraños al cuerpo, regular la vida media de las glicoproteínas en el sistema circulatorio, participar en el reclutamiento de leucocitos a sitios de inflamación, etcétera (Kumar et al., 2012). Mientras que, en patógenos como virus y bacterias, se ha visto a las lectinas implicadas en los procesos de infección, normalmente ayudando en la adhesión eficiente al hospedero, o como toxinas, si son proteínas secretadas al medio (Thompson et al., 2020).
Las lectinas en la glicómica y en la ciencia aplicada
Las lectinas resultan ser una excelente opción para estudiar al complejo glicocáliz, ya que su elevada selectividad permite aislar e identificar los azúcares que lo componen y vincularlos con sus funciones dentro de la célula. Este es un campo que apenas se encuentra en desarrollo y que se ha establecido con el nombre de glicómica, de manera análoga a la proteómica y la genómica. La glicómica pretende alcanzar un entendimiento de la composición y distribución de los carbohidratos presentes en los organismos, conectándolos con su función y relevancia, tanto fisiológica como patológica (Solís et al., 2015).
Un ejemplo del tipo de estudios que se lleva a cabo en el campo de la glicómica es la implementación de lectinas en la identificación y el análisis de patrones de glicosilación de diversas muestras biológicas, como extractos celulares, tejidos y células completas. Esto ha permitido vincular determinados cambios en la composición de carbohidratos o glicosilaciones aberrantes a enfermedades muy particulares, fenómeno que también se ha observado en desórdenes hereditarios, y en casos de inmunodeficiencia, neurodegeneración y diabetes. Lo anterior ha resultado muy importante en el diagnóstico y/o la terapéutica de estas enfermedades (Durand y Seta, 2000; Gabius, 2018).
Otras lectinas se han utilizado para distinguir entre tumores benignos y malignos o para proporcionar un pronóstico de diferentes tipos de cáncer (Munkley y Elliott, 2016). Las lectinas también pueden presentar propiedades antimicrobianas, insecticidas y antivirales. El hecho de que puedan unirse a los azúcares de la cápside9 de los virus, ha permitido que se les considere como una estrategia viable para evitar la infección de varios tipos de virus, incluyendo la del coronavirus causante de la covid-19 (Ahmed et al., 2022).
Uno de los casos más relevantes de las lectinas en la glicómica es el de la emblemática agt, ya mencionada en este texto. Esta proteína se ha seguido utilizando como auxiliar en el diagnóstico de diversos tipos de cáncer y recientemente se encontró que era capaz de adherirse al glicocáliz del epitelio intestinal y de realizar la transcitosis10 a través de este tejido (ver figura 4). Esto ha permitido el desarrollo de liposomas y vesículas artificiales que contengan lectinas en su superficie (Leyva et al., 2019; Portillo-Téllez et al., 2011).
Este tipo de sistemas se acercan mucho al concepto de bala mágica, inicialmente propuesto por Paul Ehrlich, premio Nobel de Fisiología y Medicina en el año 1908 y considerado por muchos como el padre de la quimioterapia. Este concepto se refiere al uso de procedimientos que además de facilitar la absorción de fármacos administrados por vía peroral11 puedan dirigir su entrega hacia determinados tejidos para atacar específicamente a las células cancerosas de esa región sin afectar al resto del cuerpo (Balciunaite-Murziené, G. Dzikaras, 2021).
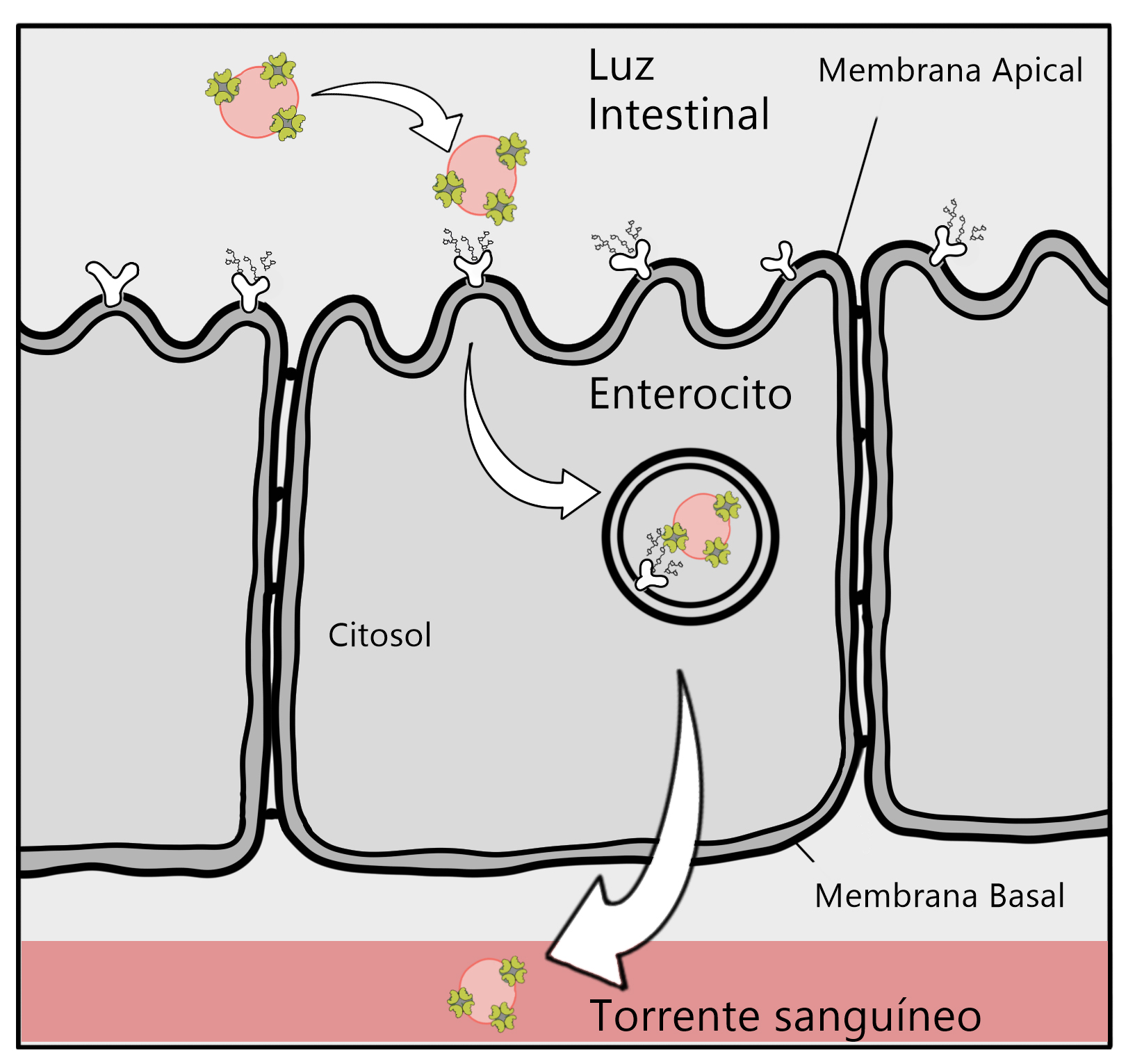
Figura 4. Transcitosis de macromoléculas mediada por la aglutinina de germen de trigo. Se observa de manera simplificada la transcitosis de unos liposomas (partículas esféricas compuestas de diversas grasas) a los que se les han añadido algunas AGT en su cubierta. Este tipo de macromoléculas son capaces de acarrear fármacos en su interior, facilitando su paso desde la luz intestinal hasta el torrente sanguíneo. Crédito: elaboración propia.
Conclusiones y perspectivas
Debido a sus múltiples utilidades, las lectinas se han convertido en valiosas herramientas para la investigación y el desarrollo de la glicómica. Existe un gran interés por descubrir nuevas lectinas con propiedades particulares. Además, los recientes avances en técnicas moleculares han abierto la puerta para el diseño y producción de nuevos tipos de lectinas. Todo esto seguirá contribuyendo a dilucidar los complejos mecanismos biológicos en los que están involucrados los carbohidratos y arrojará luz sobre la evolución molecular y la funcionalidad de las lectinas. Por lo anterior, se augura un futuro en el que las lectinas tendrán un papel aún más relevante en el desarrollo de aplicaciones biomédicas y biotecnológicas.
Referencias
- Ahmed, N., Jahan, R., Nissapatorn, V., Wilairatana, P., y Rahmatullah, M. (2022). Plant lectins as prospective antiviral biomolecules in the search for covid-19 eradication strategies. Biomedicine; Pharmacotherapy, 146, 112507. https://doi.org/10.1016/j.biopha.2021.112507
- Balciunaite-Murziené, G., y Dzikaras, M. (2021). Wheat Germ Agglutinin — From Toxicity to Biomedical Applications. Applied sciences, 11(2), 884. https://doi.org/10.3390/app11020884
- Cohen, M., y Varki, A. (2014). Modulation of Glycan Recognition by Clustered Saccharide Patches. En K. W. Jeon (Ed.), International review of cell and molecular biology (vol. 308, pp. 75-125). Elsevier. https://doi.org/10.1016/B978-0-12-800097-7.00003-8
- Durand, G., y Seta, N. (2000). Protein glycosylation and diseases: blood and urinary oligosaccharides as markers for diagnosis and therapeutic monitoring. Clin Chem., 46(6), 795-805. https://doi.org/10.1093/clinchem/46.6.795
- Espino-Solis, G. P. (2015). Brief review – Lectins. Revista Vitae, 22(1), 9-11. https://doi.org/10.17533/udea.vitae.v22n1a01
- Gabius, H. (2018). The sugar code: Why glycans are so important. Biosystems, 164, 102-111. https://doi.org/10.1016/j.biosystems.2017.07.003
- Gabius, H., y Jürgen, R. (2017). An introduction to the sugar code. Histochem Cell Biol., 147(2), 111-117. https://doi.org/10.1007/s00418-016-1521-9
- Ghazarian, H., Idoni, B., y Oppenheimer, S. B. (2011). A glycobiology review: Carbohydrates, lectins and implications in cancer therapeutics. Acta Histochemica, 113(3), 236-247. https://doi.org/10.1016/j.acthis.2010.02.004
- Kumar, K., Reddy, G., Reddy, B., Shekar, P., Sumanthi, J., y Chandra, K. (2012). Biological role of lectins: A review. Journal of Orofacial Sciences, 4(1), 20-25. https://doi.org/10.4103/0975-8844.99883
- Kuo, J. C.-H., Gandhi, J. G., Zia, R. N., y Paszek, M. J. (2018). Physical biology of the cancer cell glycocalyx. Nature Physics, 14(7), 658-669. https://doi.org/10.1038/s41567-018-0186-9
- Leyva, E., Medrano-Cerano, J. L., Cano-Sánchez, P., López-González, I., Gómez-Velasco, H., del Río-Portilla, F. y García-Hernández, E. (2019). Bacterial expression, purification and biophysical characterization of wheat germ agglutinin and its four hevein-like domains. Biopolymers, 110(1), e23242. https://doi.org/10.1002/bip.23242
- Munkley, J., y Elliott, D. J. (2016). Hallmarks of glycosylation in cancer. Oncotarget, 7(23), 35478-35489. https://doi.org/10.18632/oncotarget.8155
- Nelson, D. (2005). Lehninger principles of biochemistry (4.a ed.). W.H. Freeman. https://search.library.wisc.edu/catalog/999964334502121
- Nelson, D. L. y Cox, M. M. (2018). Lehninger principles of biochemistry (7.a ed.). W.H. Freeman, 2018. https://search.library.wisc.edu/catalog/999964334502121
- Portillo-Téllez, M. D. C., Bello, M., Salcedo, G., Gutiérrez, G., Gómez-Vidales, V. y García-Hernández, E. (2011). Folding and homodimerization of wheat germ agglutinin. Biophys J., 101(6), 1423–1431. https://doi.org/10.1016/j.bpj.2011.07.037
- Sharon, N., y Lis, H. (2004). History of lectins: from hemagglutinins to biological recognition molecules. Glycobiology, 14(11), 53R-62R. https://doi.org/10.1093/glycob/cwh122
- Solís, D., Bovin, N. V, Davis, A. P., Jiménez-barbero, J., Romero, A., Roy, R., Smetana, K., y Gabius, H. (2015). A guide into glycosciences: How chemistry, biochemistry and biology cooperate to crack the sugar code. Biochimica et Biophysica Acta (bba) – General Subjects, 1850(1), 186-235. https://doi.org/10.1016/j.bbagen.2014.03.016
- Sun, W. W., Krysto, E. S., Leo-macias, A., Cui, R., Sesso, A., Weigert, R., Ebrahim, S., y Kachar, B. (2020). Nanoarchitecture and dynamics of the mouse enteric glycocalyx examined by freeze-etching electron tomography and intravital microscopy. Commun Biol, 3, 5. https://doi.org/10.1038/s42003-019-0735-5
- Thompson, A. J., Cao, L., Ma, Y., Mcbride, R., Iii, J. R. Y., Paulson, J. C., Thompson, A. J., Cao, L., Ma, Y., Wang, X., Diedrich, J. K., Kikuchi, C., y Willis, S. (2020). Article Human Influenza Virus Hemagglutinins Contain Conserved Oligomannose N-Linked Glycans Allowing Potent Neutralization by Lectins. Cell Host and Microbe, 27(5), 725-735. https://doi.org/10.1016/j.chom.2020.03.009


