¿Qué hay de nuevo en la búsqueda para tratar la enfermedad de Parkinson?
Vol. 24, núm. 4 julio-agosto 2023
¿Qué hay de nuevo en la búsqueda para tratar la enfermedad de Parkinson?
Francisco Javier Padilla-Godínez, Hilda Angélica Martínez-Becerril y Magdalena Guerra Crespo CitaResumen
La enfermedad de Parkinson es el segundo trastorno neurodegenerativo más común a nivel mundial para el cual no hay un tratamiento curativo. Esta patología se caracteriza por síntomas motores, los cuales se deben en gran medida a la muerte de un tipo específico de células en nuestro cerebro: las neuronas dopaminérgicas, llamadas así por su capacidad para producir el neuromodulador dopamina. Existe evidencia de que en esta pérdida celular participa de manera muy importante la proteína alfa-sinucleína (α-sin). En este texto, nos enfocaremos en revisar dos acercamientos de estudios recientes que buscan nuevas opciones de tratamiento para la enfermedad de Parkinson. Primeramente, se discuten los estudios que buscan la posibilidad de restituir los niveles de dopamina, partiendo del diseño de nanopartículas que regulen su estabilidad y liberación. Por otro lado, revisaremos las investigaciones dirigidas a conocer si el proceso de coliberación de neurotransmisores, como el glutamato, podría conferir a las neuronas dopaminérgicas protección contra la agregación de α-sin. Aunque se requieren más investigaciones en el área, los avances hasta ahora son prometedores, y el desarrollo de tratamientos más eficaces para esta patología podrían estar más cerca de lo que pensamos.
Palabras clave: enfermedad de Parkinson, α-sinucleína, dopamina, nanopartículas, coliberación de glutamato.
What’s new in the search to treat Parkinson’s disease?
Abstract
Parkinson’s disease is the second most common neurodegenerative disorder in the world for which there is no curative treatment. This pathology is characterized by motor symptoms, which are largely due to the death of a specific type of cells in our brain: dopaminergic neurons, so called because of their capacity to produce neuromodulator dopamine. There is evidence that the alpha-synuclein (α-syn) protein plays an important role in this cell loss. In this text, we will focus on reviewing two recent studies that look for new treatment options for Parkinson’s disease. First, we discuss approaches that explore the possibility of restoring dopamine levels, based on the design of novel nanoparticles that regulate its stability and release. On the other hand, we will review research aimed at finding out whether the process of co-release of neurotransmitters, such as glutamate, could confer protection to dopaminergic neurons against α-syn aggregation. Although more research is needed in the area, the advances so far are promising, and the development of more effective treatments for this pathology may be closer than we think.
Keywords: Parkinson’s disease, α-synuclein, dopamine, nanoparticles, glutamate co-release.
La enfermedad de Parkinson: más que un simple temblor
Cuando en 1817, James Parkinson describió a la “parálisis agitante” como una enfermedad crónica y de avance lento, caracterizada por temblor en reposo, rigidez muscular e inestabilidad postural, seguramente estaba lejos de pensar que ésta llegaría a ser la enfermedad motora más padecida a nivel mundial. Hoy en día, la enfermedad de Parkinson (ep) se conoce como un trastorno multifactorial y con diversos síntomas, incluidos también los no motores, como pérdida de memoria, alteraciones del sueño y del estado del ánimo, los cuales ahora sabemos que anteceden al diagnóstico de la enfermedad (ver figura 1). A lo largo de la historia, se han descubierto algunos de los procesos que conducen a la degeneración en la ep. En este trabajo, nos enfocaremos en el “detrás de cámaras” de las alteraciones motoras en esta enfermedad.
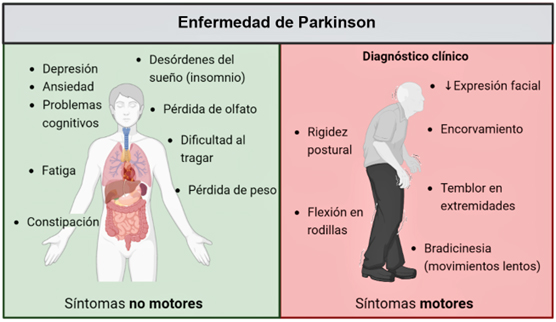
Figura 1. Sintomatología de la enfermedad de Parkinson. Diversas alteraciones no motoras (izquierda), anteceden al diagnóstico clínico motor de la EP (derecha).
Crédito: elaboración propia en BioRender.
La ep se caracteriza por la muerte de un tipo de células que predominan en el cerebro, las neuronas. Existen muchos tipos de neuronas, según su forma, función, estructuras de proyección y componentes químicos que liberan (neurotransmisores o neuromoduladores1). A aquellas neuronas que tienen la capacidad de sintetizar y liberar una sustancia química llamada dopamina, se les conoce como neuronas dopaminérgicas. La dopamina es considerada un neuromodulador por tener un amplio rango de respuesta a nivel no sólo del sistema nervioso central sino también periférico. Esto la involucra en múltiples funciones como el movimiento, procesos de aprendizaje, memoria, así como conductas motivantes.
Las neuronas dopaminérgicas se concentran en la parte central del cerebro, conocida como cerebro medio o mesencéfalo, el cual se divide en dos regiones: el área tegmental ventral (atv) y la sustancia negra pars compacta (snpc),2 siendo esta última la que se ve afectada en la ep. Durante el envejecimiento se presenta la muerte de algunas neuronas dopaminérgicas, pero en la ep su pérdida es drástica (70%). En la búsqueda de responsables, el principal sospechoso es la proteína α-sin.
Aunque necesaria para ciertos procesos neuronales como la liberación de neurotransmisores y el correcto funcionamiento de las sinapsis, la α-sin puede sufrir cambios en su estructura (mal plegamiento) que la vuelven propensa a agregarse con otras α-sin (Runwal y Edwards, 2021). Esto finalmente conduce a la formación de cuerpos de Lewy: inclusiones que se observan en la mayoría de los cerebros de pacientes que fallecieron por la ep (ver figura 2).
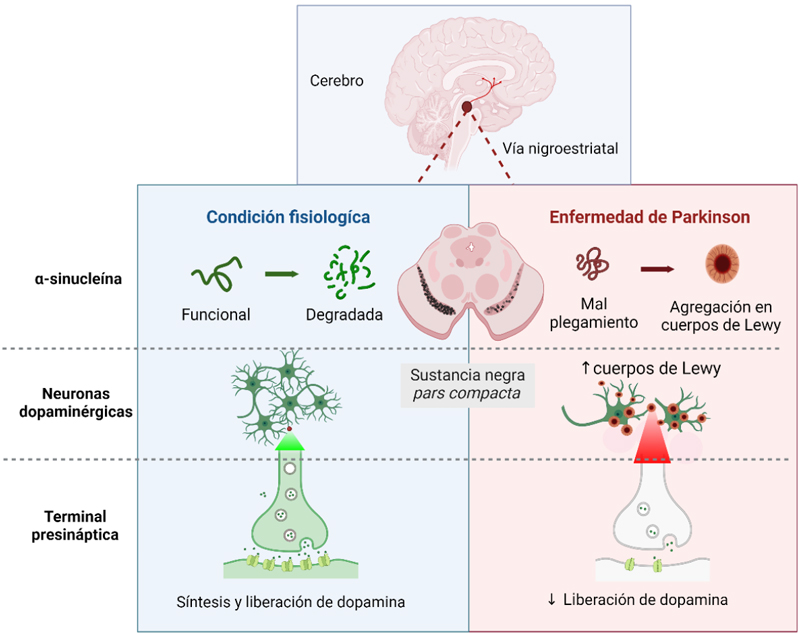
Figura 2. Características neuropatológicas que conllevan a las alteraciones motoras de la enfermedad de Parkinson. Izquierda. Descripción de la actividad fisiológica de las neuronas dopaminérgicas de la snpc con un enfoque en la síntesis y liberación de dopamina, así como en la correcta función y degradación de la proteína α-sin. Derecha. En condiciones patológicas, como la EP, ocurre un mal plegamiento y agregación de α-sin en cuerpos de Lewy, lo que conlleva a la neurodegeneración dopaminérgica. Crédito: elaboración propia.
Es importante destacar que las neuronas dopaminérgicas de la snpc son particularmente vulnerables a los agregados de α-sin en la ep. Entre las razones para ello está la gran cantidad de prolongaciones que presentan, término conocido como arborización axonal,3 que, a diferencia de otras poblaciones dopaminérgicas (como las del atv), demandan mayor cantidad de energía para su funcionamiento (Pacelli et al., 2015). Asimismo, esta mayor arborización implica un cambio en la regulación de las oscilaciones de calcio, proceso necesario para la actividad eléctrica de las células (ver figura 3). Todo esto contribuye en parte a la agregación de α-sin en la snpc, provocando una disminución en la producción de dopamina, lo que se refleja conductualmente en las alteraciones motoras características de la ep (Ghung et al., 2020).
De esta forma, se pensaría que la restitución de la dopamina es la clave para curar la sintomatología motora de la ep. En este contexto, la terapia actual y por excelencia es la administración de un precursor natural de la dopamina: la levodopa.3 No obstante, existen efectos secundarios asociados con este fármaco, así como su incapacidad para detener la progresión de la enfermedad, lo que ha llevado a nuevas perspectivas de estudio en la búsqueda de tratamientos. Éstos se centran en: 1) restituir los niveles fisiológicos de dopamina, incorporándola en las neuronas al utilizar nuevos materiales que permitan su estabilización y liberación controlada, y 2) disminuir la agregación de la α-sin, explorando mecanismos de regulación en las poblaciones de neuronas dopaminérgicas. Por ello, revisaremos estos dos enfoques actuales que contemplan diseñar nuevos métodos para el tratamiento de la ep.
Dopamina: un neuromodulador muy inestable
La dopamina es muy difícil de manipular: se oxida fácilmente produciendo moléculas dañinas para las neuronas dopaminérgicas. Por ello, entre las estrategias terapéuticas para la ep se han incluido compuestos que eviten la oxidación y promuevan la producción de la dopamina, asegurando que ésta no se degrade en compuestos tóxicos. Este acercamiento pareciera ser la respuesta contra la ep, mas no todo es color de rosa. A pesar de que la levodopa puede atravesar la barrera,5 presenta varias complicaciones, entre las que destacan reacciones adversas producidas por las inadecuadas concentraciones que llegan al blanco terapéutico.
Lo anterior ha obligado a que los acercamientos más recientes en la investigación básica opten por perspectivas fisiológicas, donde se pueda administrar directamente la dopamina mediante estrategias que eviten su oxidación. Aunque ha sido difícil, sorprendentemente se ha logrado en cierta medida gracias a la nanomedicina (ver figura 3), campo de la biotecnología que consiste en el desarrollo de nanopartículas que pueden ser utilizadas para mejorar la salud. A través de ella se ha logrado no sólo estabilizar a la dopamina en su estado basal (no oxidado), sino también liberarla de manera controlada (Ghazy et al., 2021).
El desarrollo de nanopartículas en modelos animales ha generado resultados prometedores en el tratamiento de la sintomatología de la ep. Particularmente, las nanopartículas capaces de administrarse por métodos no invasivos (como la vía nasal) son las que más atención están recibiendo en la comunidad científica (García-Prado et al., 2021; Trapani et al., 2021), por lo que las investigaciones continúan en estos modelos, con el fin de hacer la traslación a su aplicación clínica.
Ante esto, es importante resaltar los requisitos que cualquier acercamiento dirigido al uso de nanopartículas cargadas con dopamina debe de cumplir: 1) evitar la oxidación de la dopamina; 2) liberarla en las concentraciones y regiones cerebrales necesarias; 3) ser biocompatible, es decir, no generar toxicidad adicional a la que ya se presenta en la ep; y 4) poder atravesar la barrera hematoencefálica, de tal forma que su administración sea mediante vías no invasivas, que eviten la inyección directa en la zona afectada.
Los principales tipos de nanopartículas que cumplen con estos parámetros son: a) las poliméricas, relevantes por su biodegradabilidad y la posibilidad de administración no invasiva; b) los liposomas, con similitud a las membranas de las células humanas, que tienen una mayor eficacia de liberación controlada y una posible administración no invasiva; c) las inorgánicas, entre las que destacan las nanopartículas de oro y los puntos cuánticos; y d) las de óxidos metálicos, cuya composición superficial porosa permite la estabilización de dopamina en grandes concentraciones y su liberación controlada en tasas fácilmente modificables, mediante la síntesis a la medida de estas nanopartículas. Las propuestas son prometedoras, pero la investigación continúa para mejorarlas, siendo uno de los retos más grandes precisamente lograr cruzar la barrera hematoencefálica.
De esta forma, se busca que la administración de dopamina sea más eficiente que la levodopa, volviéndose una opción farmacológica para el tratamiento de la ep. Esto podría ocurrir una vez que estas nanopartículas sean capaces de restituir las concentraciones fisiológicas de la dopamina mediante su administración controlada, específica y no invasiva.
Salvar la acción de un neurotransmisor con la de otro
Al igual que la restitución de dopamina, si se quiere prevenir o disminuir la progresión de la ep también es crucial inhibir el daño por la agregación de α-sin. Curiosamente, la respuesta podría no encontrarse ni en la α-sin ni en la dopamina, sino en un elemento aparentemente independiente.
Esta parte de la historia comienza con las neuronas dopaminérgicas del atv, las cuales son más resistentes a la neurodegeneración en la ep, en comparación con las de la snpc. Prueba de ello es que muy pocas neuronas dopaminérgicas del atv mueren como consecuencia de esta enfermedad. Los mecanismos involucrados aún permanecen desconocidos; sin embargo, se han estudiado algunas hipótesis. La más fuerte es la ya mencionada, que hace referencia a la gran arborización axonal de las neuronas dopaminérgicas de la snpc, la cual demanda una gran cantidad de energía para solventar sus funciones. Aunque la arborización axonal de las neuronas no se puede modificar, una propuesta novedosa plantea que su funcionamiento sí.
Algunas neuronas dopaminérgicas del atv son capaces de liberar otro neurotransmisor con funciones distintas a la dopamina: el glutamato. Éste es considerado el principal neurotransmisor excitador en el cerebro, es decir, se caracteriza por aumentar la actividad eléctrica y los efectos subsecuentes de las neuronas que lo reciben. Cuando una neurona es capaz de liberar dos o más neurotransmisores, como la dopamina y el glutamato, se habla de un proceso de coliberación y de neuronas coliberadoras.
Se ha identificado que la coliberación de glutamato en las neuronas dopaminérgicas es un fenómeno conservado a través de la evolución, encontrándose en múltiples organismos como la mosca Drosophila, el pez cebra, roedores (rata, ratón), primates y humanos (Buck et al., 2022).
Diversos estudios sugieren que la coliberación de glutamato promueve el crecimiento y la conectividad axonal, así como el almacenamiento de vesículas y la liberación de la dopamina. Además, también se le relaciona con el aprendizaje mediado por recompensas (Buck et al., 2022). Todo esto contribuye a la necesidad de continuar con el estudio de la coliberación de neurotransmisores.
Curiosamente, todas las neuronas dopaminérgicas del cerebro medio (atv y snpc) expresan marcadores6 asociados con la coliberación de glutamato (como el transportador vesicular de glutamato tipo 2, VGluT2) en las etapas embrionarias tempranas, mientras que en la edad adulta muy pocas neuronas los conservan (30% en el atv y 5 a 10% en la snpc). En este sentido, la supervivencia generalizada de las neuronas dopaminérgicas del atv en la ep podría indicar que la coliberación de otro neurotransmisor, en este caso el glutamato, genera algún tipo de protección mediante propiedades aparentemente tróficas7 (ver figura 3).
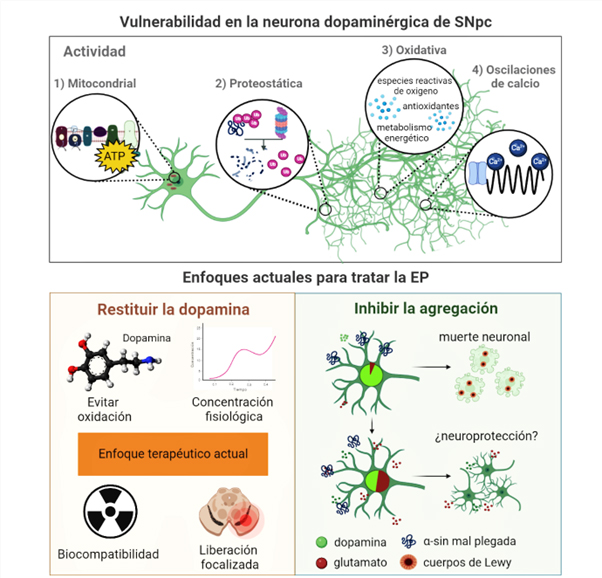
Figura 3. Enfoques actuales en el tratamiento de la enfermedad de Parkinson. Arriba. Características o actividades celulares que hacen vulnerables a las neuronas dopaminérgicas de la snpc en la EP. Abajo. Se proponen dos acercamientos para corregir estas alteraciones: restituir la dopamina de forma eficaz y controlada con el uso de nanopartículas (izquierda), y regular la coliberación de glutamato en las neuronas dopaminérgicas como posible neuroprotección a la agregación de α-sin. Los niveles relativos de dopamina (verde) y glutamato (rojo) se representan en el núcleo de las neuronas como gráfico de pastel (derecha). Crédito: elaboración propia.
Algo que intriga a los investigadores es que se ha encontrado que la expresión de marcadores involucrados en la coliberación de glutamato es capaz de resurgir en las neuronas dopaminérgicas de la snpc bajo condiciones similares a las presentes en la ep. Este resurgimiento cobra relevancia ya que podría ayudarnos a diferenciar entre los procesos normales de envejecimiento y los asociados con la ep. Además, la aparición de marcadores relacionados con la coliberación de glutamato parece proteger y regenerar los axones dopaminérgicos ante el daño (Buck et al., 2022).
Aunque se desconocen los mecanismos involucrados, se sugiere que la coliberación de glutamato podría salvar a las neuronas dopaminérgicas de la agregación de α-sin. Esto se atribuye principalmente a la regulación de las mitocondrias. Se sabe que el glutamato previene y disminuye especies reactivas de oxígeno que son tóxicas para las mitocondrias y para la neurona en general. Además, el glutamato sirve como fuente de energía que mantiene la síntesis de atp8 durante el estrés o daño celular (Buck et al., 2022). La combinación de estos mecanismos podría explicar la mayor resistencia de las neuronas dopaminérgicas (figura 3). Asimismo, surge la interrogante de que si estos marcadores asociados a la coliberación de glutamato podrían intervenir sobre la proteostasis de la α-sin,9 es decir, si podrían evitar su mal plegamiento o agregación en las neuronas dopaminérgicas.
Todas estas evidencias sugieren que mantener la regulación de la coliberación de glutamato en las neuronas dopaminérgicas de la snpc podría representar, hasta cierto nivel, una posible forma de prevenir la neurodegeneración ocasionada por la agregación de α-sin en la ep. Aunque las herramientas actuales limitan los estudios del proceso de coliberación, esto podría cambiar en un futuro cercano con los conocimientos y avances biomédicos que se están adquiriendo. Conocer cómo es la regulación celular entre el binomio dopamina-glutamato aportará información clave para el avance en el tratamiento de esta enfermedad.
Conclusiones
Hoy en día se están investigando dos áreas novedosas y con potencial para tratar la ep. Por un lado, se espera que la aplicación de dopamina a través de nanopartículas permita la restitución eficaz y controlada de sus niveles fisiológicos en etapas avanzadas de la enfermedad. Por otro, se están evaluando mecanismos celulares con propiedades neuroprotectoras, como la coliberación de glutamato en la snpc, que podrían aumentar la resistencia de las neuronas dopaminérgicas a la agregación de α-sin y prevenir su muerte en la ep. Gracias a los avances en nanomedicina y tecnologías que nos permiten profundizar en el conocimiento de la célula, nos acercamos al desarrollo de nuevas opciones de tratamiento de esta enfermedad incapacitante.
Referencias
- Buck, S.A., Erickson-Oberg, M.Q., Bhatte, S.H., McKellar, C.D., Ramanathan, V.P., Rubin, S.A., y Freyberg, Z. (2022). Roles of VGLUT2 and Dopamine/Glutamate Co-Transmission in Selective Vulnerability to Dopamine Neurodegeneration. acs Chemical Neuroscience, 13(2), 187-193. https://doi.org/10.1021/acschemneuro.1c00741.
- García-Pardo, J., Novio, F., Nador F., Cavaliere, I., Suárez-García, S., Lope-Piedrafita, S., Candiota, A. P., Romero-Gimenez, J., Rodríguez-Galván, B., Bové, J., Vila, M., Lorenzo, J., y Ruiz-Molina, D. (2021). Bioinspired Theranostic Coordination Polymer Nanoparticles for Intranasal Dopamine. acs Nano, 15(5), 8592-8609. https://doi.org/10.1021/acsnano.1c00453.
- Ghazy, E., Rahdar, A., Barani, M., y Kyzas, G.Z. (2021). Nanomaterials for Parkinson disease: Recent progress. Journal of Molecular Structure, 1231, 129698. https://doi.org/10.1016/j.molstruc.2020.129698.
- Ghung, S.J., Lee, H.S., Yoo, H.S., Lee, Y.H., Lee, P.H., y Sohn, Y.H. (2020). Patterns of Striatal Dopamine Depletion in Early Parkinson Disease. Neurology, 95(3), e280-e290. https://doi.org/10.1212/wnl.0000000000009878.
- Pacelli, C., Giguère, N., Bourque, M.J., Lévesque, M., Slack, R.S., y Trudeau, L.É. (2015). Elevated mitochondrial bioenergetics and axonal arborization size are key contributors to the vulnerability of dopamine neurons. Current Biology, 25(18), 2349-2360. https://doi.org/10.1016/j.cub.2015.07.050.
- Runwal, G., y Edwards, RH. (2021). The membrane interactions of synuclein: physiology and pathology. Annual Review of Pathology: Mechanisms of Disease, 16, 465-485. https://doi.org/10.1146/annurev-pathol-031920-092547.
- Trapani, A., Corbo, F., Agrimi, G., Ditaranto, N., Cioffi, N., Perna, F., Quivelli, a., Stefàno, E., Lunetti, P., Muscella, A., Marsigliante, S., Cricenti, A., Luce, M., Mormile, C., Cataldo, A., y Bellucci, S. (2021). Oxidized Alginate Dopamine Conjugate: In Vitro Characterization for Nose-to-Brain Delivery Application. Materials, 14(13), 3495. https://doi.org/10.3390/ma14133495.
Recepción: 05/08/2022. Aprobación: 16/05/2023.


