Páncreas artificial: un paso hacia la gestión eficiente de la diabetes
Vol. 24, núm. 5 septiembre-octubre 2023
Páncreas artificial: un paso hacia la gestión eficiente de la diabetes
Dolores Alejandra Ferreira de Loza, Héctor Ríos Barajas y José Roberto Franco Jaramillo CitaResumen
La diabetes mellitus, una enfermedad crónica incurable causada por problemas en la producción de insulina, resulta en hiperglucemia. Para abordar esto, se explora el páncreas artificial, un dispositivo destinado a emular las funciones reguladoras de la glucosa. Este artículo analiza la situación actual, los desafíos tecnológicos y las perspectivas para desarrollar un páncreas artificial seguro y completamente autónomo.
Palabras clave: páncreas artificial, diabetes mellitus, hiperglucemia, tratamiento de la diabetes, tecnologías de control glucémico.
Artificial pancreas: a step towards the efficient management of diabetes
Abstract
Diabetes mellitus, an incurable chronic disease caused by issues in insulin production, leads to hyperglycemia. To address this, the artificial pancreas is explored, a device intended to emulate the regulatory functions of glucose. This article examines the current status, technological challenges, and prospects for developing a safe and fully autonomous artificial pancreas.
Keywords: artificial pancreas, diabetes mellitus, hyperglycemia, diabetes treatment, glucose control technologies.
Enfermedad grave y debilitante
La diabetes mellitus (dm) es una enfermedad seria y debilitante, para la cual aún no se ha descubierto una cura. Esta afección se caracteriza por un aumento en los niveles de glucosa en la sangre, conocido como hiperglucemia. La hiperglucemia puede ser causada por la falta de insulina (dm tipo 1) o por una baja sensibilidad a la insulina (dm tipo 2). Cuando consumimos alimentos, especialmente carbohidratos, estos se descomponen en glucosa que se libera en el torrente sanguíneo. La insulina, una hormona producida en el páncreas, tiene la función de transportar las moléculas de glucosa desde el torrente sanguíneo hasta las células. Estas células utilizan la glucosa como fuente de energía para llevar a cabo sus funciones vitales. Con el transcurso del tiempo, la hiperglucemia puede dañar los vasos sanguíneos, lo que provoca complicaciones en diversos órganos y tejidos, como se muestra en la figura 1.
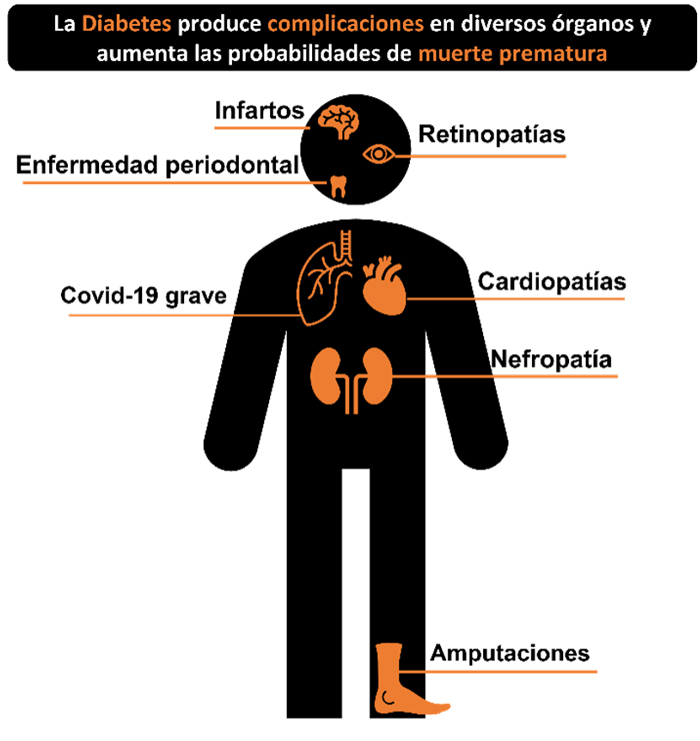
Figura 1. Complicaciones asociadas a la hiperglucemia.
Crédito: elaboración propia.
La diabetes mellitus también ha sido identificada como una importante comorbilidad durante pandemias virales, como la causada por el virus sars–cov-2 (Singh et al., 2020). Datos recientes demuestran que los individuos con covid-19 y con glucosa descontrolada1 tienen un 40% más de probabilidad de experimentar una enfermedad grave, lo que aumenta el riesgo de hospitalización y mortalidad. Además, se ha observado que los pacientes con dm tipo 1 presentan un mayor riesgo de enfermedad grave y muerte en comparación con los pacientes con dm tipo 2 (idf-t1d Index Report, 2023).
Carga económica onerosa
La diabetes mellitus representa una significativa carga económica tanto para naciones como para individuos. Los gastos directos, que pueden ser sufragados por pacientes o entidades tanto privadas como públicas, engloban medicamentos, suministros médicos, consultas, análisis clínicos y hospitalizaciones. En el año 2021, México destinó 19.9 mil millones de dólares al tratamiento de la diabetes, ubicándose en el octavo lugar a nivel global (idf, 2021). Según la Federación Mexicana de Diabetes, en 2019 el costo del tratamiento para un paciente con diabetes bajo control ascendió a alrededor de 90 mil pesos anuales.
Pandemia sin precedentes
Según la Federación Internacional de Diabetes, la diabetes mellitus constituye una pandemia de proporciones sin precedentes que está creciendo de manera desenfrenada. Para 2021, existían 535 millones de adultos con edades comprendidas entre 20 y 79 años que padecían diabetes, y se estima que esta cifra se incrementará a 700 millones para el año 2045. A nivel mundial, aproximadamente el 10.5% de la población sufre de diabetes, lo que significa que más de una de cada diez personas en el mundo vive actualmente con esta condición. México se posiciona en el séptimo puesto entre los países con mayor cantidad de adultos afectados por la enfermedad (idf, 2021). La figura 2 ilustra el aumento en el número de personas con diabetes y presenta el porcentaje de pacientes a nivel global y en México. Datos del 2022 ubican a la diabetes como la segunda causa de muerte en México después de las enfermedades cardíacas (inegi, 2022). Del total de personas que viven con diabetes a nivel mundial, cerca del 90% sufren de diabetes tipo 2. La evidencia sugiere que la diabetes tipo 2 puede prevenirse o retrasarse mediante cambios en la alimentación y el estilo de vida. En contraste, la diabetes tipo 1, no puede prevenirse y afecta a personas de todas las edades.
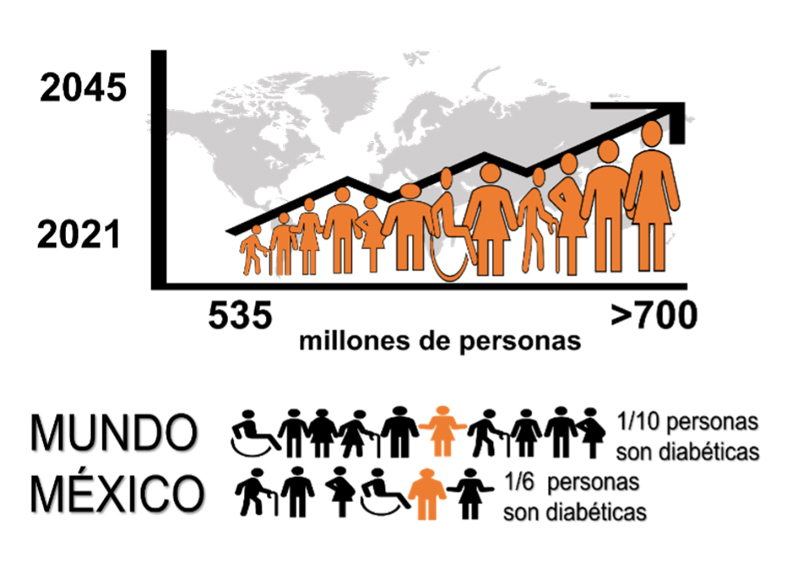
Figura 2. Número de pacientes adultos diabéticos entre 20 y 79 años, se estima que el 10% corresponde a pacientes insulino-dependientes. Porcentaje de pacientes adultos en el mundo y en México.
Crédito: elaboración propia.
Diabetes insulino-dependiente
La diabetes mellitus tipo 1, también conocida como diabetes insulino-dependiente, se origina debido a la destrucción de las células pancreáticas como resultado de una enfermedad viral o autoinmune. Los pacientes que padecen diabetes tipo 1, además de mantener una dieta rigurosa para controlar la ingesta de carbohidratos, necesitan administrarse múltiples inyecciones de insulina diariamente.
El tratamiento de la diabetes tipo 1 ha experimentado avances significativos desde el momento en que se aisló por primera vez la insulina en 1922 y se comenzó a usar en pacientes diabéticos, hasta la actualidad (Kovatchev, B. y Kovatcheva, A., 2021). La figura 3 ilustra la cronología de estos avances. A partir de la década de los 70, se empezaron a desarrollar sistemas de regulación de glucosa para pacientes hospitalizados, popularmente conocidos como “páncreas artificial”. La característica distintiva de estos sistemas radica en su capacidad para detectar aumentos en los niveles de glucosa y liberar insulina en el torrente sanguíneo de manera similar a un páncreas sano, es decir, mediante la administración intravenosa (iv).
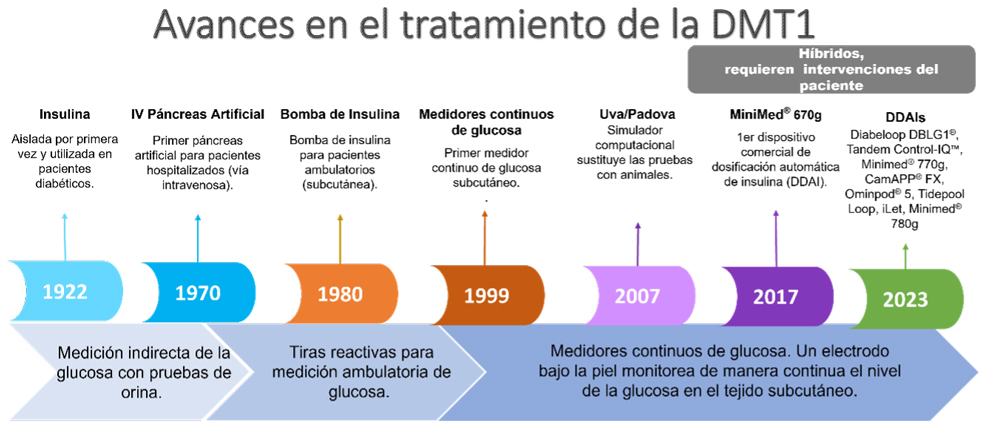
Figura 3. Evolución del tratamiento de la diabetes mellitus tipo 1 (DMT1) o insulino-dependiente. Las flechas indican la evolución en la medición de la glucosa.
Crédito: elaboración propia.
Páncreas artificial: sistema de control en lazo cerrado
Un páncreas artificial es un sistema de control diseñado para emular las funciones de un páncreas saludable. Un sistema de control en lazo cerrado es un enfoque de toma de decisiones que utiliza información disponible, como las mediciones de los niveles de glucosa, para alcanzar un objetivo específico: mantener los niveles de glucosa en sangre en un valor deseado, a pesar de las incertidumbres relacionadas con la edad, el peso y la condición fisiológica de los pacientes, así como las variaciones causadas por factores externos como la ingesta de alimentos, la medicación, el nivel de actividad física, el estrés, entre otros. Con este propósito, el sistema detecta las fluctuaciones en los niveles de glucosa y dirige a la bomba de insulina a administrar una cantidad predeterminada de insulina a través de un algoritmo de control. Este algoritmo, esencial para el funcionamiento, consiste en un conjunto de procedimientos matemáticos que determinan la acción requerida. Asegura que se alcance el objetivo de manera autónoma, segura y confiable, sin intervención por parte del paciente o el médico. La figura 4.A ilustra los componentes del páncreas artificial y su disposición en un lazo cerrado. Esta tarea se asemeja a la operación de un sistema de aire acondicionado, que monitorea constantemente la temperatura de una habitación para mantenerla en un nivel deseado. Una vez que la temperatura alcanza dicho nivel, el sistema se apaga y solo se vuelve a encender si la temperatura aumenta por encima del valor deseado. El encendido del sistema de aire acondicionado ocurre automáticamente, es decir, de manera autónoma.
Las mediciones de glucosa y la administración de insulina intravenosa son procedimientos invasivos que conllevan riesgos, como infecciones y formación de coágulos, por lo que solo son adecuados para pacientes hospitalizados. Estos métodos no son recomendables para pacientes ambulatorios, es decir, aquellos que realizan actividades cotidianas como usar el transporte público, asistir a la escuela o al trabajo, hacer ejercicio, entre otras. A partir de la década de los 80, el desarrollo y la comercialización de dispositivos portátiles, como los monitores continuos de glucosa y las bombas de insulina, han mejorado el tratamiento de la enfermedad y, en consecuencia, la calidad de vida de los pacientes. Estos dispositivos portátiles miden los niveles de glucosa y administran insulina debajo de la piel, en el tejido subcutáneo (sc), evitando así los riesgos asociados con la administración intravenosa. Siguiendo las indicaciones médicas, el paciente ingresa la cantidad necesaria de insulina en la bomba en función de la medición proporcionada por el monitor continuo de glucosa.
Otro avance significativo en el tratamiento de la diabetes tipo 1 ocurrió en 2013, cuando la Administración de Alimentos y Medicamentos de los Estados Unidos (fda, por sus siglas en inglés) aprobó el simulador metabólico Uva/Padova. Este simulador reemplaza las pruebas preclínicas en animales y permite afinar y validar nuevos algoritmos de control de manera segura y ética (Dalla Man, C. et al., 2014). Esta aprobación aceleró el desarrollo de nuevos esquemas de regulación y dispositivos para apoyar el tratamiento de la diabetes insulino-dependiente.
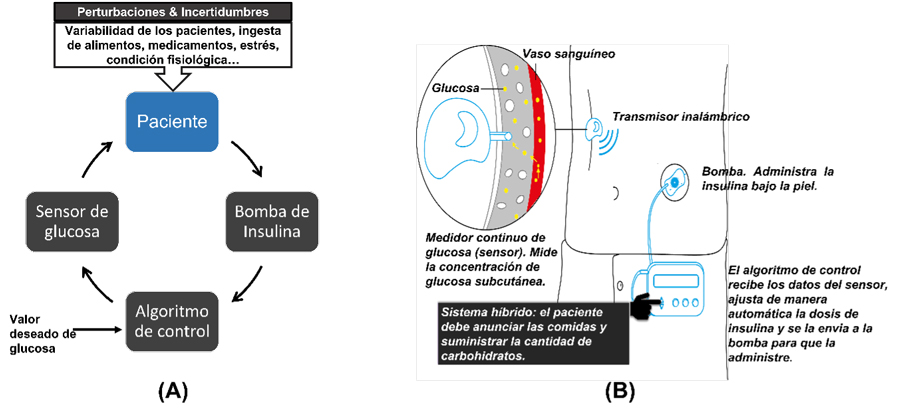
Figura 4. A) Páncreas artificial: sistema de control en lazo cerrado. B) Sistema comercial DDAI. El paciente debe de anunciar la ingesta de alimentos y la cantidad de carbohidratos que va a consumir.
Crédito: elaboración propia.
Riesgo de hipoglucemia en pacientes ambulatorios
Los medidores continuos de glucosa y las bombas de dosificación de insulina portátiles marcaron el inicio de la carrera tecnológica hacia el desarrollo de un páncreas artificial para pacientes en su vida cotidiana. No obstante, replicar el funcionamiento de un páncreas saludable ha demostrado ser excepcionalmente complicado en el ámbito ambulatorio. La dificultad radica en que los dispositivos portátiles utilizan la vía subcutánea (sc), en contraste con la vía intravenosa (iv) que emplearía un páncreas en óptimas condiciones. Esta diferencia provoca demoras en la acción de la insulina e inexactitudes en la medición de los niveles de glucosa. En consecuencia, los niveles de glucosa pueden experimentar fluctuaciones hacia la hiperglucemia o, en casos más graves, hacia la hipoglucemia. La hipoglucemia implica una disminución rápida de los niveles de glucosa que puede llevar al fallecimiento del paciente en cuestión de minutos.
Sistemas comerciales para pacientes ambulatorios
Los sistemas disponibles en el mercado son conocidos como Dispositivos de Dosificación Automática de Insulina (ddai). Estos sistemas constan de tres componentes esenciales: el medidor continuo de glucosa, la bomba de dosificación de insulina y el algoritmo de control en lazo cerrado (que puede estar integrado en la bomba o en una aplicación para dispositivos móviles). La figura 4.B proporciona un ejemplo de un sistema comercial en lazo cerrado. El medidor continuo de glucosa mide los niveles de glucosa en el tejido subcutáneo y transmite este valor al algoritmo de control cada cinco minutos. El algoritmo ajusta automáticamente la dosis de insulina y comunica a la bomba la cantidad precisa de insulina que debe administrarse cada cinco minutos. Sin embargo, es importante destacar que los ddai comerciales no son completamente autónomos; siguen un esquema de funcionamiento híbrido en el que el paciente debe realizar ciertas acciones en coordinación con el algoritmo de control. Por ejemplo, el paciente debe notificar cuando va a comer o a realizar actividad física, además de proporcionar la cantidad de carbohidratos que consumirá con la comida. La principal desventaja de este enfoque es su susceptibilidad a errores humanos.
El primer ddai comercial fue el Minimed® 670 g de Medtronic, aprobado por la fda en 2016 para su uso en pacientes ambulatorios. Desde entonces, han sido aprobados varios ddai, como el Diabeloop DBLG1® en 2018, Tandem Control-IQ™ en 2019, Minimed® 770 g y CamAPP® FX en 2020, Ominpod® 5 y Tidepool Loop en 2022, e iLet Bionic Pancreas y Minimed® 780 g en 2023 (Tubiana-Rufi et al., 2021) y (jdrf Blog, 2023).
Los ddai han desempeñado un papel importante en la reducción de eventos de hiperglucemia e hipoglucemia, al mantener los niveles de glucosa dentro del rango deseado durante períodos más prolongados. No obstante, es importante considerar que los ddai no son adecuados para todas las personas: su utilización puede ser incómoda y compleja, requiere capacitación previa y un manejo inadecuado puede poner en riesgo la vida del paciente. Además, los requisitos de dosificación de insulina deben superar la capacidad mínima de dosificación (por ejemplo, más de 8 UI diarias2 para el Minimed 670 g). Por último, los costos iniciales de inversión y los consumibles pueden ser una barrera para aquellos que carecen de seguro médico (Tubiana-Rufi et al., 2021). El médico especialista, en colaboración con el paciente, debe evaluar si los beneficios superan las posibles dificultades.
Alternativas para el porvenir
En la actualidad, distintos grupos y consorcios de investigación están abocados al desarrollo de un páncreas artificial completamente autónomo. Se están explorando diversas perspectivas:
- Explorar alternativas a las vías intravenosa (iv) y subcutánea (sc) para la ubicación de sensores y bombas de insulina, como la vía intraperitoneal (Huyett et al., 2018).
- Incorporar dispositivos “vestibles”, como rastreadores de actividad física (fitness trackers). La premisa de estos sistemas es minimizar la intervención del paciente y, en su lugar, emplear información como el ritmo cardíaco para detectar la realización de ejercicio, la conductividad eléctrica de la piel para detectar cambios emocionales, y datos sobre la ingesta y tipo de alimentos a través de aplicaciones móviles, entre otros (Patek et al., 2019).
- Desarrollar sistemas bihormonales que empleen tanto insulina como glucagón. Estas dos hormonas en conjunto emulan la regulación de la glucosa en sangre que realiza un páncreas saludable (Rickels et al., 2018).
- Utilizar biosensores basados en la integración de islotes pancreáticos funcionales. Estos biosensores ofrecen una respuesta más precisa a las necesidades de insulina, considerando una amplia variedad de entradas: medicamentos, factores nutricionales, hormonales, entre otros (Olcomendi et al., 2020).
Las tecnologías mencionadas anteriormente están en una etapa emergente y presentan un desafío constante para el desarrollo de nuevos sistemas de control en lazo cerrado, que aseguren los más altos estándares de seguridad y autonomía requeridos.
¿Qué hay de los pacientes con diabetes tipo 2?
La diabetes mellitus tipo 2 es una enfermedad de carácter progresivo, en la que con el tiempo los pacientes podrían necesitar inyecciones de insulina cuando otros tratamientos dejen de surtir efecto. Bajo estas circunstancias, los pacientes podrían considerar el uso de un ddai como una opción viable. En la actualidad, se están llevando a cabo ensayos clínicos con el fin de ampliar la aplicación de los ddai a pacientes con diabetes tipo 2 (Daly A. B. et al., 2023).
¿Sabías que en México…?
- Más de 89,000 personas viven con diabetes tipo 1. De este grupo, un 12.21% son menores de 20 años, el 76.99% tiene edades comprendidas entre 20 y 59 años, mientras que el restante 10.8% son adultos mayores de 60 años (idf-t1d Index Report, 2022).
- En nuestro país, el único ddai disponible es el Minimed® 670 g, el cual fue aprobado por la Cofepris3 en el año 2017. Para adquirir este sistema, es necesario realizar un pago inicial de aproximadamente 150,000 pesos mexicanos, que incluye la bomba de insulina con su algoritmo de control, un glucómetro y un sensor. Además, se deben destinar 12,000 pesos mensuales en consumibles, que abarcan sensores, cánulas, reservorios e insulina.
Conclusiones
La combinación de las nuevas tecnologías junto con los sistemas de control ha traído mejoras significativas al tratamiento de la diabetes y ha aliviado la carga psicológica tanto de los pacientes como de sus cuidadores. Sin embargo, los costos elevados constituyen una barrera fundamental que limita el acceso de los pacientes a estas innovaciones. Además, los actuales dispositivos ddai requieren de capacitación y están propensos a errores humanos que podrían poner en peligro la vida de los pacientes.
Los sistemas de control continuarán desempeñando un papel central en la integración de las tecnologías emergentes, como dispositivos complementarios para detectar la ingesta de alimentos, el ejercicio y el estrés, así como en la exploración de rutas alternativas para la administración de insulina y la implementación de biosensores. El objetivo es la creación de un dispositivo que regule los niveles de glucosa de manera autónoma, confiable y segura en pacientes en su vida cotidiana.
No obstante, abordar la diabetes requiere un enfoque multidimensional. Esto implica invertir en el desarrollo de nuevos medicamentos y dispositivos, ampliar el alcance de los sistemas de salud pública para garantizar el acceso al tratamiento, promover entornos saludables y educar a la población para que pueda tomar decisiones informadas en su manejo de la enfermedad. Solo a través de un esfuerzo conjunto en distintos frentes será posible abordar de manera efectiva el reto que representa la diabetes en la sociedad actual.
Referencias
- Dalla Man, C., Micheletto, F., Lv, D., Breton, M., Kovatchev, B., y Cobelli, C. (2014). The uva/padova type 1 diabetes simulator: New features. Journal of Diabetes Science and Technology, 8(1), 26-34. https://doi.org/10.1177/1932296813514502.
- Daly, A. B., Boughton, C. K., Nwokolo, M., Hartnell, S., Wilinska, M. E., Cezar, A., Evans, M. L., y Hovorka, R. (2023). Fully automated closed-loop insulin delivery in adults with type 2 diabetes: An open-label, single-center, randomized crossover trial. Nature Medicine,29(1), 203-208. https://doi.org/10.1038/s41591-022-02144-z.
- Huyett, L. M., Dassau, E., Zisser, H. C., y Doyle, F. J. (2018). Glucose sensor dynamics and the artificial pancreas: The impact of lag on sensor measurement and controller performance. ieee Control Systems, 38(1), 30-46. https://doi.org/10.1109/MCS.2017.2766322.
- idf-Diabetes Atlas (2021, 10 de diciembre) International Diabetes Federation, Diabetes Atlas, 2021, 10th Edition. IDF Diabetes Atlas | Tenth Edition.
- idf -Covid-19 and diabetes, (2023, 21 de mayo) International Diabetes Federation, Diabetes and covid-19: The role of glycemic control, diabetes subtype and blood glucose on covid-10 severity and death, 2022. IDF-COVID-19-and-diabetes.
- idf-t1d Index Report (2023, 24 de mayo), International Diabetes Federation, Type 1 diabetes estimates in children and adults, 2022. IDF-T1D-Index-Report (diabetesatlas.org).
- inegi (2023, 6 de junio), Instituto Nacional de Geografía e Informática (2022). Estadística de defunciones registradas de enero a junio 2022, INEGI(inegi.org.mx).
- jdrf Diabetes Blog (2023, 6 de junio), Latest in fda Regulatory, JDRF Diabetes Blog Resources.
- Kovatchev, B., y Kovatcheva, A. (2021, 10 de diciembre) A Smart artificial pancreas could conquer diabetes, A Smart Artificial Pancreas Could Conquer Diabetes – IEEE Spectrum.
- Olcomendy, L., Pirog, A., Lebreton, F., Jaffredo, M., Cassany, L., Gucik Derigny, D.,Cieslak, J., Henry, D., Lang, J., Catargi, B., Raoux, M., Bornat, Y., y Renaud, S. (2022). Integrating an islet-based biosensor in the artificial pancreas: In silico proof-of-concept. ieee Trans. Biomed., 69 (2), 899-909. https://doi.org/10.1109/TBME.2021.3109096.
- Patek, S. D. (2019). Multiple-signal artificial pancreas systems. The artificial pancreas: Current situation and future directions (pp. 219-235) https://doi.org/10.1016/B978-0-12-815655-1.00019-3.
- Rickels, M. R., DuBose, S. N., Toschi, E., Beck, R. W., Verdejo, A. S., Wolpert, H., Cummins, M. J., Newswanger, B., y Riddell, M. C. (2018). Mini-dose glucagon as a novel approach to prevent exercise-induced hypoglycemia in type 1 diabetes. Diabetes Care, 41(9), 1909-1916. https://doi.org/10.2337/dc18-0051.
- Tubiana-Rufi, N., Schaepelynck, P., Franc, S., Chaillous, L., Joubert, M., Renard, E., Reznik, Y., Abettan, C., Bismuth, E., Beltrand, J., Bonnemaison, S., Borot, S., Charpentier, G., Delemer, B., Desserprix, A., Durain, D., Farret, A., Filhol, N., Guerci, B., Benhamou, P. Y. (2021). Practical implementation of automated closed-loop insulin delivery: A French position statement. Diabetes Metab. J., 47(3) https://doi.org/10.1016/j.diabet.2020.10.004.
- Singh, A. K., Gupta, R., Ghosh, A., y Misra, A. (2020). Diabetes in covid-19: Prevalence, pathophysiology, prognosis and practical considerations. Diab Metab Syndr, 14(4), 303-310. https://doi.org/10.1016/j.dsx.2020.04.004.
Recepción: 11/10/2022. Aprobación: 27/07/2023.


