Ecologización de la industria farmacéutica: la química verde en el desarrollo de medicamentos
Vol. 25, núm. 1 enero-febrero 2024
Ecologización de la industria farmacéutica: la química verde en el desarrollo de medicamentos
Martiniano Bello y Erick Bahena Culhuac CitaResumen
Sin lugar a duda, la contaminación química al medio ambiente es uno de los problemas más grandes de la actualidad. En definición, un contaminante químico es una sustancia que no debería estar de forma natural en ese preciso lugar. Estas sustancias pueden entrar a nuestro cuerpo a través del aire, comida, agua o inclusive a través de la piel. El estar expuesto prolongadamente a estas sustancias, puede ocasionar enfermedades graves. Un ejemplo de estas sustancias es el Bisfenol A, una sustancia utilizada para producir plásticos. Bisfenol A tiene una estructura muy similar a las hormonas, por lo que el estar expuesto a esta sustancia puede afectar nuestro metabolismo, hacernos infértiles o inclusive provocar cáncer, y esta solo es una sustancia entre miles. La mayor cantidad de este tipo de contaminantes proviene de la industria. Por suerte, estos problemas generaron el surgimiento de la química verde. En este artículo se discuten algunas estrategias experimentales y computacionales verdes que tanto la industria como los grupos enfocados al desarrollo de fármacos han implementado para hacer dichos procesos más sostenibles y ecológicos.
Palabras clave: química verde, fármacos sostenibles, industria farmacéutica eco, estrategias verdes, informática y química.
Greening the pharmaceutical industry: green chemistry in drug development
Abstract
Without a doubt, chemical contamination of the environment is one of the biggest problems today. By definition, a chemical pollutant is a substance that should not be naturally in that precise place. These substances can enter our body through air, food, water or even through the skin. Persistent exposure to these materials can cause dangerous sickness. An example of this is Bisphenol A, a substance used to produce plastics. Bisphenol A has a very similar structure to hormones, so being exposed to this substance can affect our metabolism, make us infertile or even cause cancer, and this is only one substance among thousands. Most of this type of contaminant comes from industry. Fortunately, these problems spawned the rise of green chemistry. This article discusses some green experimental and computational strategies that both the pharmaceutical industry and groups focused on drug development have implemented to make these processes more sustainable and ecological.
Keywords: green chemistry, sustainable drugs, eco-friendly pharmaceutical industry, green strategies, computer science and chemistry.
¿Qué es química verde?
La química verde es un nuevo enfoque de la química que busca cambiar los procesos y productos contaminantes actuales por otros que no lo sean. Dos profesores norteamericanos, Paul Anastas y John Warner, fueron los pioneros en desarrollar una serie de postulados conocidos como “los 12 principios de la química verde” (Anastas y Warner, 2000:30) (Figura 1), los cuales son aplicables a la medicina, agricultura y la industria química. Estos 12 principios fácilmente se pueden resumir en un principio general que postula que “es mejor no producir contaminantes que tener que limpiarlos”. La vida como la conocemos actualmente sería imposible sin química, pero si seguimos con la química contaminante actual, la vida en unos 100 años será también imposible.

Figura 1. 12 principios de la Química Verde, aplicables en medicina, agricultura e industria química. Crédito: elaboración propia con información de Anastas y Warner, 2000.
Por lo tanto, es de suma importancia que se implementen procesos verdes a lo largo de la industria. Es fácil imaginarse la aplicación de estos principios en varios productos de la industria, pero ¿te imaginas un medicamento amigable con el medio ambiente?
Al abandonar el agua, las amenazas para los anfibios no disminuyen; ahora deben cuidarse de los depredadores terrestres y encontrar un refugio lo suficientemente húmedo que les permita soportar el calor e insolación. Cuando están bien alimentados y han crecido lo suficiente, los anfibios alcanzan la edad adulta y están listos para reproducirse, regresando a la charca o arroyo donde nacieron para encontrar pareja, depositar sus propios huevos y comenzar el ciclo nuevamente. Cuando las ranas de mi pueblo regresaban a esa charca, terminaban en los tamales de mi tía o de alguna otra señora.
La industria farmacéutica
Los diferentes procesos para el desarrollo de medicamentos y materiales se han venido realizando de la manera tradicional, en la cual se consumen grandes cantidades de recursos naturales y se generan gran cantidad de contaminantes que impactan de manera desfavorable en el medio ambiente. En la actualidad, se ha demostrado que dichos procesos pueden ser reemplazados por métodos y materiales compatibles con el entorno que tienen un menor impacto en el medio ambiente. Un mecanismo empleado por la industria farmacéutica ha sido la sustitución de rutas de síntesis química (Figura 2) tradicionales por otras alternativas, en las que se busca reducir las sustancias contaminantes. También existen otros tipos de síntesis química que incorporan procesos que aprovechan la energía solar (síntesis fotoquímica) y la asistida con horno de microondas, además de otras que emplean compuestos químicos poco dañinos y la utilización de recursos renovables que pueden ser reutilizados y recuperados.
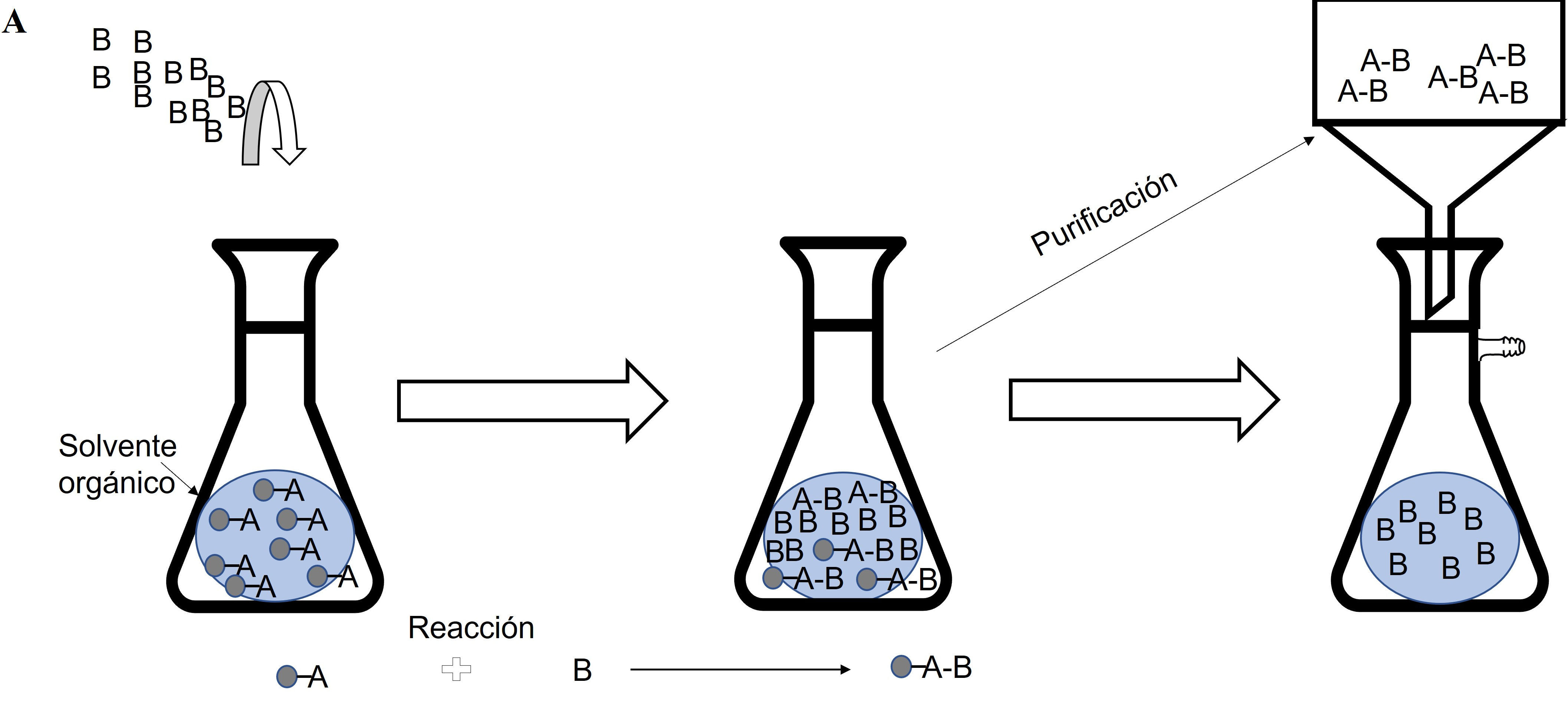
Figura 2. La figura ilustra el proceso de la síntesis química de un fármaco. A) Se muestran las moléculas que reaccionan entre sí (A y B) para formar el compuesto A-B, el cual posteriormente se separa mediante el proceso de purificación. Crédito: elaboración propia.
Ejemplos de Síntesis Verde de Fármacos
El desarrollo y síntesis de fármacos son procesos altamente costosos, por lo que la industria farmacéutica requiere del diseño de rutas de síntesis química que sean amigables con la naturaleza, sin descuidar la demanda de su producto en el mercado. En este sentido, varias industrias farmacéuticas han rediseñado sus rutas de síntesis aplicando los principios de química verde introducidos por Anastas y Warner, y también aplicando el concepto de “Economía Atómica”, introducido por Barry Trost (Trost et al., 1995). Este concepto implica que gran parte de los átomos presentes en las moléculas que van a reaccionar entre sí terminen en el producto y no en residuos o desechos (Figura 3).
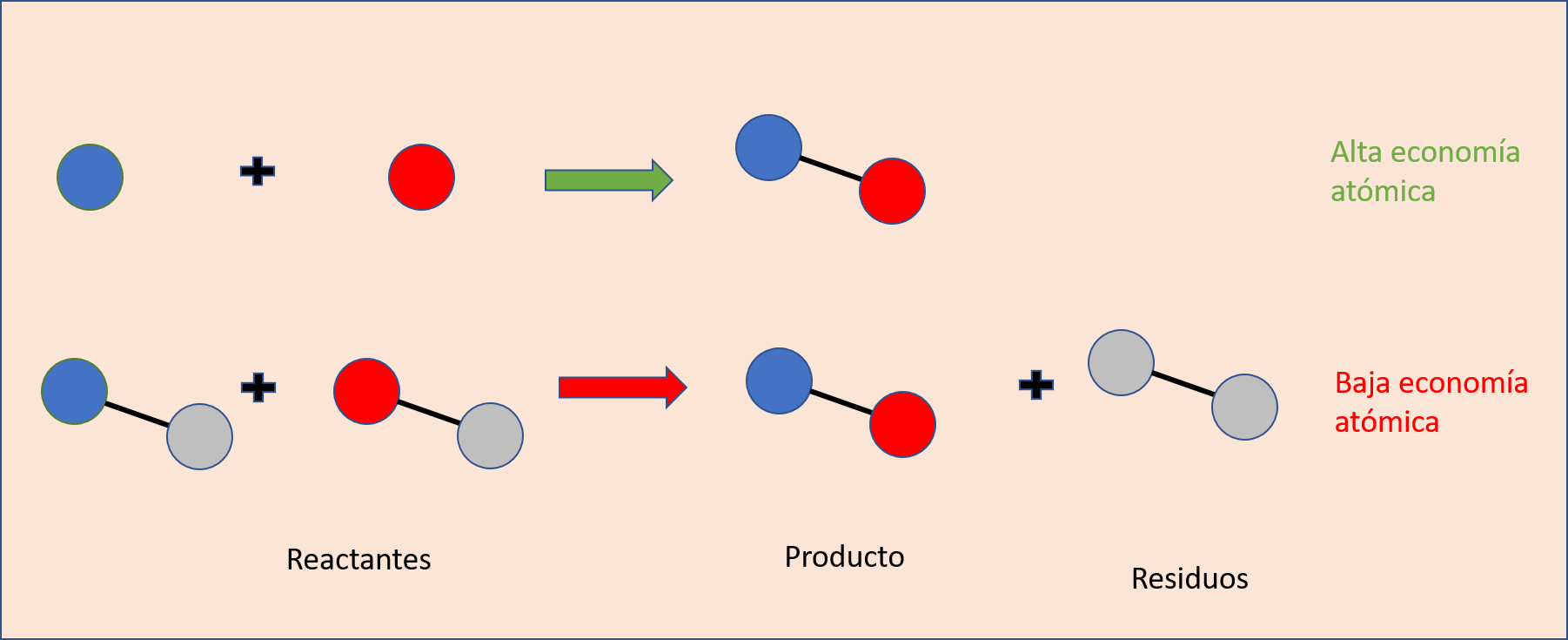
Figura 3. Economía atómica de una reacción química. La figura ilustra la representación entre una alta o baja economía. Crédito: elaboración propia con información de Trost et al., 1995.
Aplicando estos conceptos, la industria farmacéutica ha logrado optimizar la producción de ibuprofeno, cuyo nombre comercial es Advil o Motrin. Este fármaco inicialmente se sintetizaba en seis pasos con una eficiencia de alrededor del 40 % de economía atómica, mientras que, aplicando la química verde, se ha logrado sintetizar en 3 pasos con un rendimiento del 77 % (Figura 4). De esta forma, es posible ahorrar kilogramos de reactivos y disminuir la generación de grandes cantidades de desechos (Anastas et al., 2001).
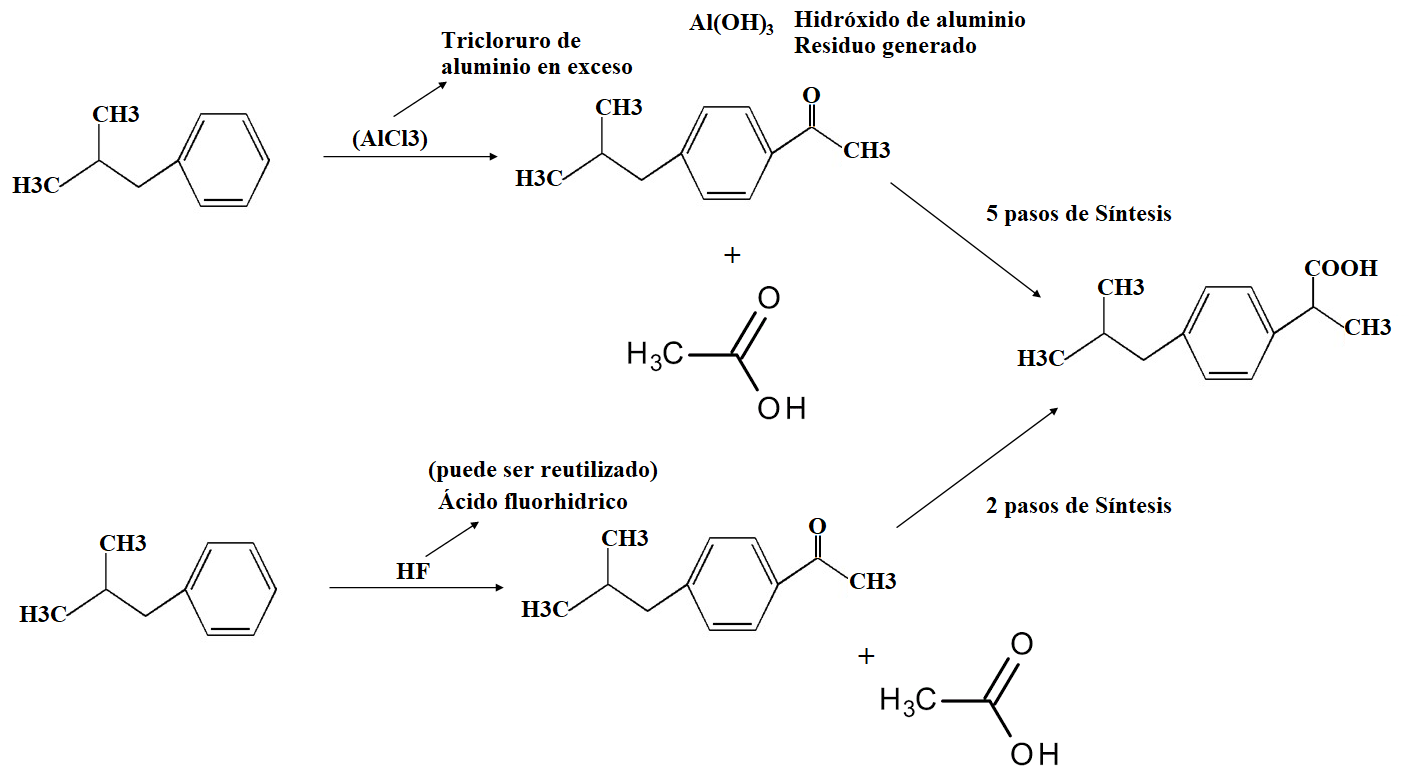
Figura 4. Síntesis de ibuprofeno mediante métodos tradicionales y aplicando la química verde. La ruta verde no produce hidróxido de aluminio, un contaminante al medio ambiente. Crédito: elaboración propia con información de Anastas et al., 2001.
Informática Verde
Síntesis química de fármacos de manera sostenible
Con la incorporación de la química verde en el diseño de la ruta de síntesis de fármacos y otros compuestos, ha surgido el desarrollo de herramientas informáticas para evaluar la sostenibilidad y “verdor” de la síntesis química (Derbenev et al., 2022). Muchas de estas herramientas permiten evaluar la eficiencia de una nueva ruta de síntesis verde. La mayoría de las herramientas informáticas que evalúan el “verdor” de un proceso químico miden la intensidad de masa del proceso (Process Mass Intensity, pmi, por sus siglas en inglés) (Borovika et al., 2019), el factor ambiental (factor E), el rendimiento de reacción y otros. Esto se hace para evaluar si un proceso químico es eficiente y si los productos químicos implicados son seguros, o si el uso de productos químicos peligrosos es minimizado. Otro reto es el desarrollo de software para ayudar a los químicos sintéticos a evaluar la sostenibilidad y “verdor” de la síntesis química (Derbenev et al., 2022). Un ejemplo es el uso de cuadernos electrónicos de laboratorio (Electronic Laboratory Notebooks, eln, por sus siglas en inglés), que son una versión digital (Figura 5A) del cuaderno de papel tradicional.
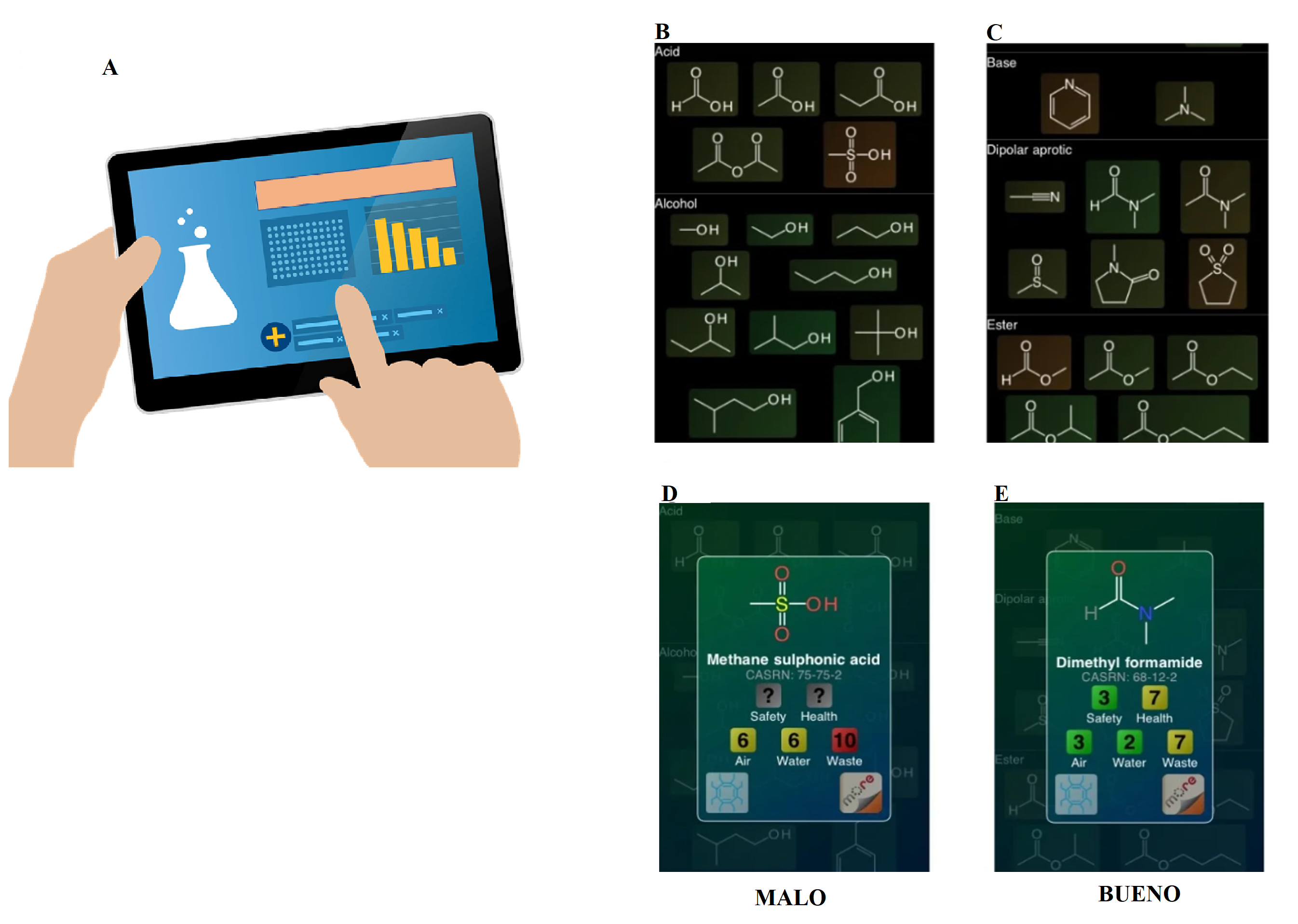
Figura 5. Cuaderno electrónico de laboratorio y página de entrada en la aplicación Green Solvents. Cuaderno electrónico (A), página de entrada para iPhone (B) y iPad (C). Se accede al contenido tocando la molécula, y se abre una nueva página (D y E) con información de las moléculas que asignan puntuaciones (bueno=1, malo=10) para diferentes criterios de seguridad, salud, aire, agua y residuos, además del número de identificación único de la substancia (cas). Panel D y E señalan un mal y buen solvente, respectivamente. Crédito: elaboración propia.
Estos dispositivos contienen secciones que consideran métricas de química verde. Un ejemplo sería en el caso de que quisiéramos elegir un solvente verde para una síntesis química; este software permite elegir entre distintos disolventes agrupados por clase química y codificados por color (Figura 5B-E). Dicha codificación se basa en la guía de selección de solventes de la Sociedad Química Estadounidense, Mesa Redonda Farmacéutica del Instituto de química verde (The American Chemical Society Green Chemistry Institute Pharmaceutical Roundtable, acsgcipr, por sus siglas en inglés), la cual clasifica los solventes con base en su impacto en la seguridad, salud y medio ambiente (aire, agua y residuos). No obstante, aunque el conocimiento de tales métricas es bastante útil, este conocimiento es solo el punto de partida, ya que se requiere más información para la elección de los pasos individuales de síntesis y el mejoramiento de la misma. Para este propósito se emplean métodos de retrosíntesis (Figura 6), que permiten retroceder paso a paso desde una molécula objetivo hasta un conjunto de compuestos sencillos.
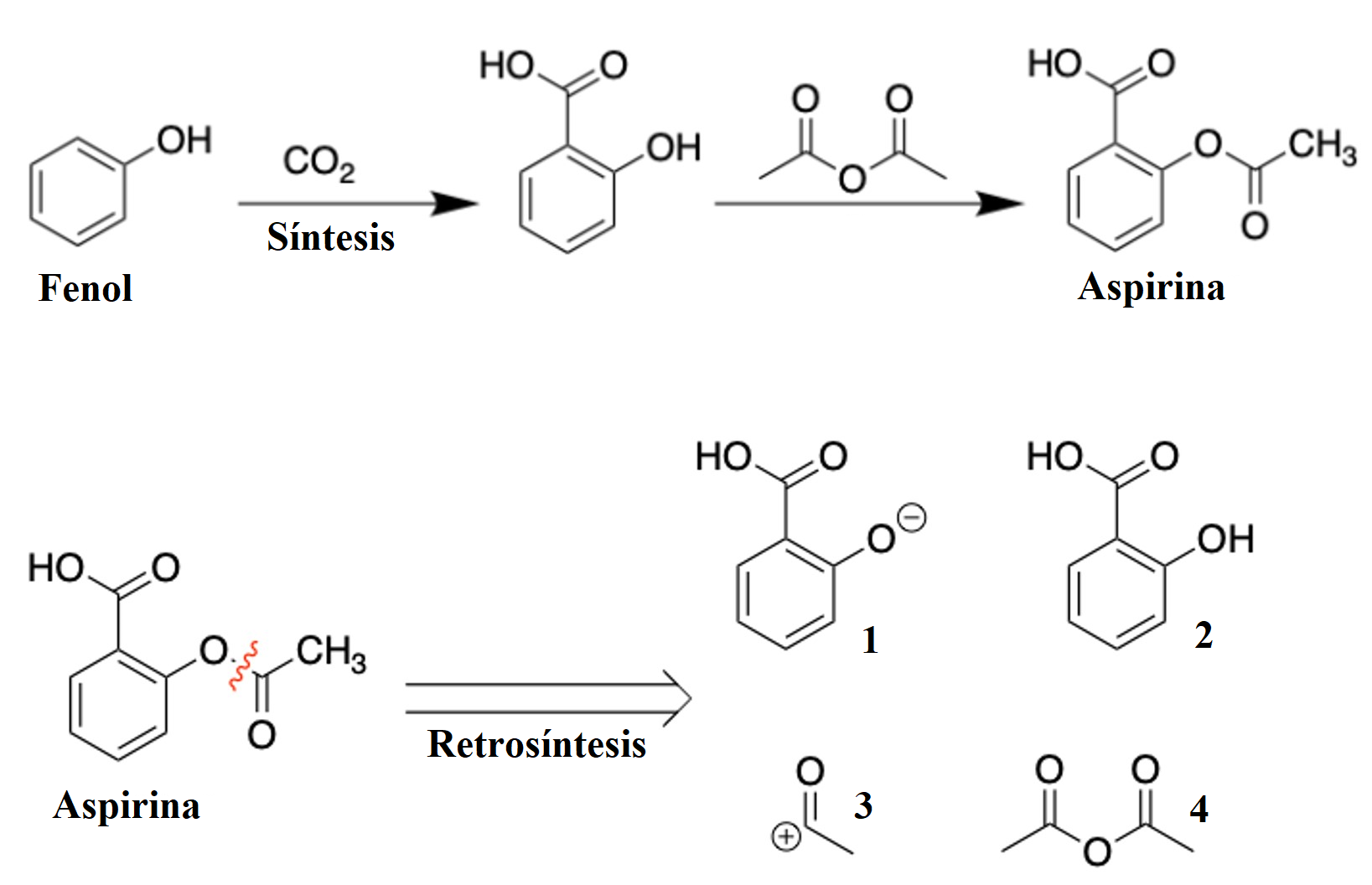
Figura 6. Síntesis y retrosíntesis de aspirina. La figura ilustra la disparidad entre la síntesis y la retrosíntesis, junto con un conjunto de compuestos simples que pueden ser contemplados para trazar la ruta de esta última. Crédito: elaboración propia.
Para lograrlo, se apoya en la inteligencia artificial junto con extensas bases de datos experimentales (Figura 7), que contienen información sobre reacciones químicas conocidas. Esto permite que el algoritmo de inteligencia artificial navegue por secuencias de reacción alternativas y proporcione nuevas propuestas (Lin et al., 2020). A pesar de los avances en estas herramientas informáticas, el progreso en su desarrollo recae principalmente en manos de químicos computacionales y no tanto en investigadores experimentales (Kanza et al., 2017; Kanza et al., 2021), dado que ya se dispone de suficientes bases de datos experimentales.
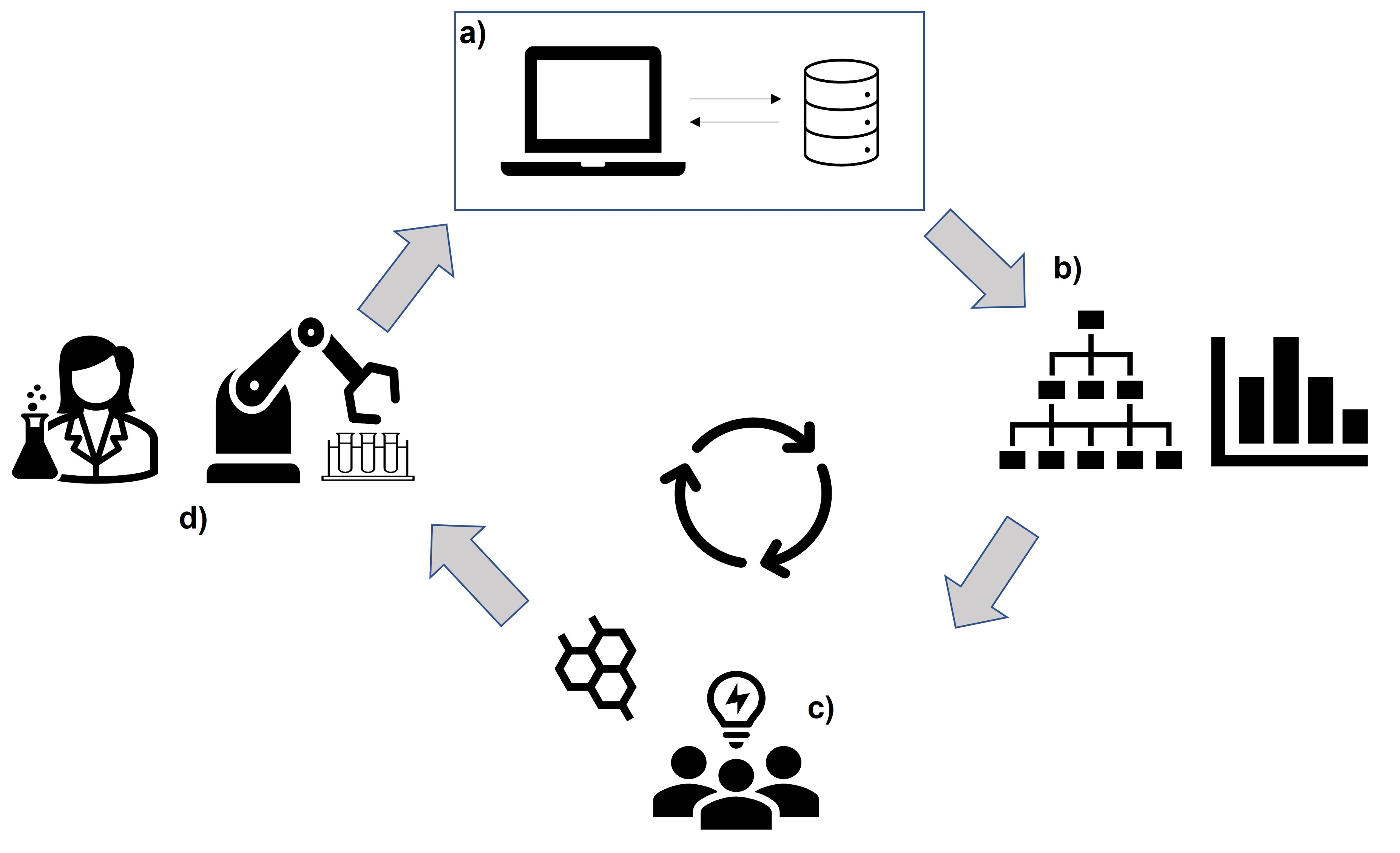
Figura 7. Representación del ciclo de la predicción de nuevas rutas de síntesis química. Bases de datos experimentales que contienen información sobre reacciones químicas conocidas (A), aprendizaje automático por algoritmo de inteligencia artificial (B), interpretación humana o automatizada y diseño de nuevas propuestas (C), y síntesis química, humana o robótica (D). Crédito: elaboración propia.
Diseño de Fármacos de manera sostenible
En un estudio reciente se señaló que el costo de traer un solo fármaco nuevo al mercado cuesta alrededor de 2.600 millones de dólares (DiMasi et al., 2016). El descubrimiento de fármacos de manera experimental conlleva muchas etapas que incluyen la identificación de la diana farmacológica —lugar del organismo donde un fármaco ejerce su acción—, validación de dicha diana, identificación del compuesto líder —núcleo químico con la mejor afinidad hacia la diana farmacológica—, optimización del compuesto líder, estudios preclínicos y clínicos (Figura 8). De estas etapas, la parte clínica involucra la mayor cantidad de dinero y tiempo, ya que implica la selección apropiada del modo de dosificación y la evaluación si el medicamento es seguro para uso en humanos. El proceso de desarrollo de nuevos fármacos es cada vez más desafiante, no solo por la sostenibilidad, sino también por los mayores requisitos para que el proceso sea más amigable con el medio ambiente. Este proceso tiene un tiempo aproximado de 15 años; sin embargo, con la implementación del Diseño Asistido por Computadora (Figura 8), se logra reducir a la mitad el tiempo y un tercio del costo total considerado para el desarrollo de nuevos fármacos, solo empleando métodos experimentales.
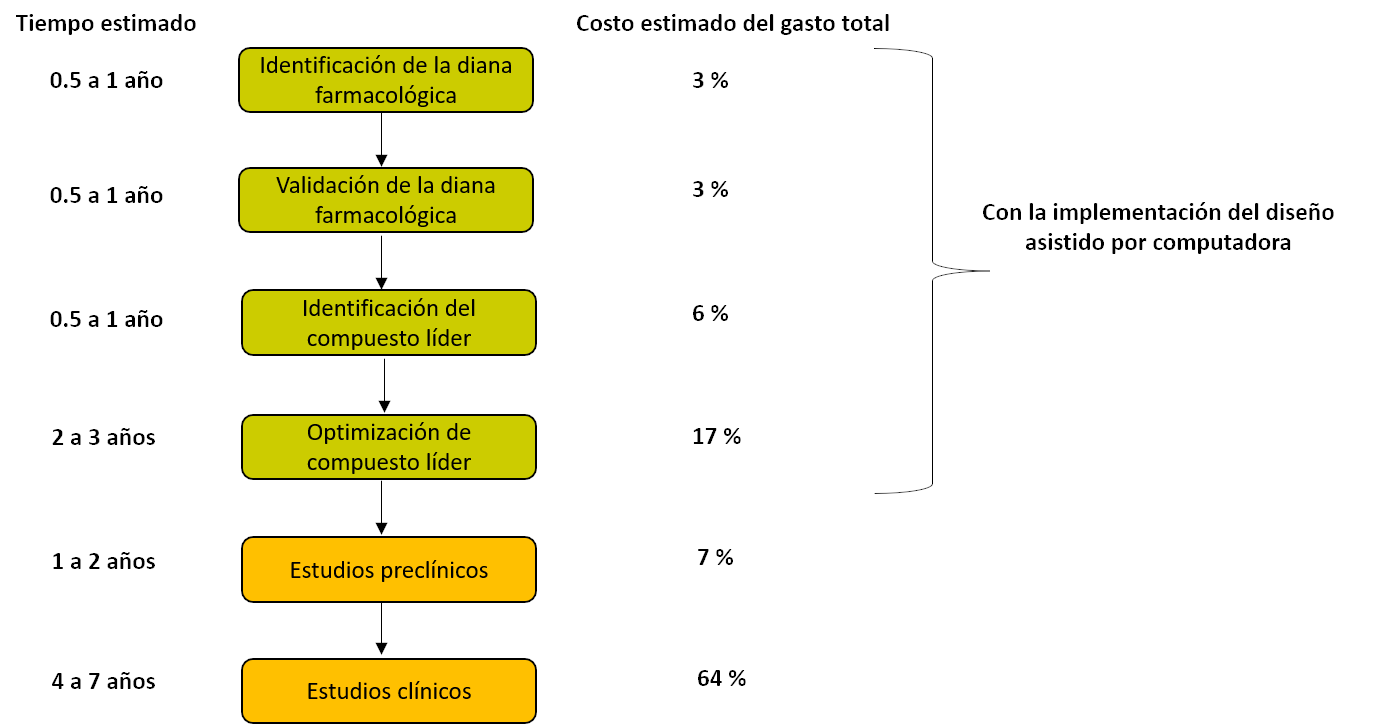
Figura 8. Tiempo requerido y costo por etapa para el desarrollo de una nueva entidad molecular comparado con la implementación de herramientas computacionales. Crédito: elaboración propia con información de Eli Lilly and Company en 2010 (Paul et al., 2010).
Dicho método se apoya en una serie de herramientas computacionales que permiten evaluar el potencial farmacológico de un nuevo compuesto (Figura 9), como el tamizaje virtual de las propiedades fisicoquímicas, farmacocinéticas (predicciones admet), la relación cuantitativa de estructura-actividad (Quantitative Structure-Activity Relationship, qsar) y el diseño racional de fármacos empleando acoplamiento molecular —método que predice la conformación preferida de una molécula al estar unida a otra, con el fin de formar un complejo estable— o docking (Meng et al., 2011).
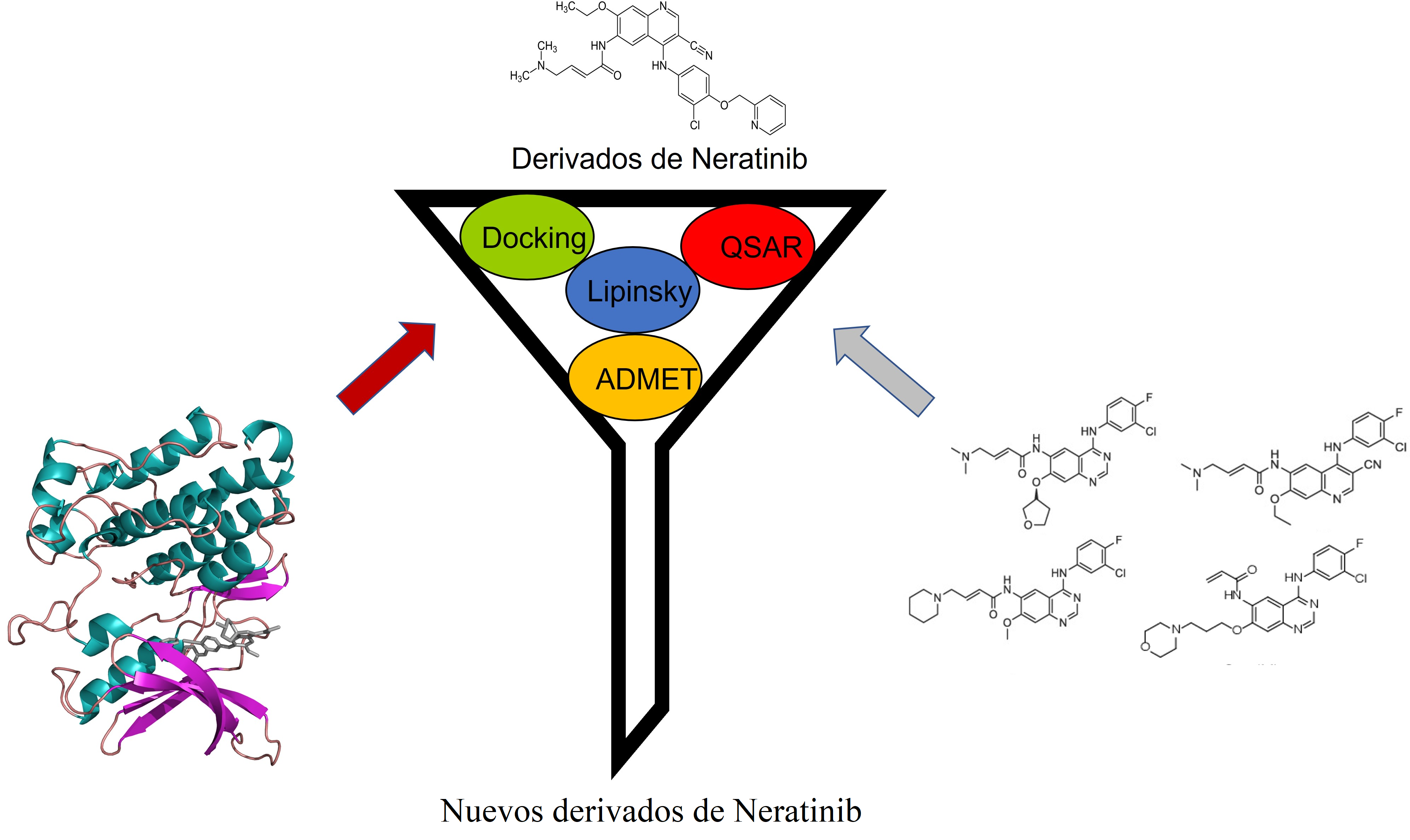
Figura 9. Desarrollo de fármacos mediante métodos computacionales. La figura ilustra la serie de métodos para el desarrollo de fármacos empleando el diseño racional (Lipinsky, ADMET y Docking) y empleando modelos QSAR. Crédito: elaboración propia.
Las propiedades fisicoquímicas de los compuestos se evalúan principalmente mediante la Regla de Lipinsky, que evalúa las siguientes propiedades: peso molecular, donadores y aceptores de puentes de hidrógeno, lipofilicidad, superficie total polar y enlaces rotables. Mientras que las propiedades farmacocinéticas evalúan las propiedades admet y proporcionan información sobre el metabolismo del compuesto en el ser humano.
Los estudios qsar evalúan de forma cuantitativa las actividades biológicas de compuestos basados en la variación de sus características estructurales. Para este fin, emplean un modelo matemático que utiliza diferentes parámetros biológicos para especular sobre las actividades biológicas de las nuevas moléculas propuestas basadas en sus similitudes estructurales. En tanto que el diseño racional emplea información experimental de la diana farmacológica y bases químicas de compuestos (quimioteca) para predecir la afinidad.
Conclusión
En los últimos años, la química verde ha ganado mucho terreno en diferentes áreas, permitiendo optimizar las rutas de síntesis química y reducir la contaminación. No obstante, requiere apoyarse en otras ramas de conocimiento como la informática verde. Esta rama actualmente provee una serie de herramientas que permiten trazar rutas de síntesis y diseño de fármacos aplicando los principios de química verde, permitiendo un ahorro de recursos aún mayor que el alcanzado sin su apoyo.
Referencias
- Anastas, P. T., Kirchhoff, M. M., y Williamson, T. C. (2001). Catalysis as a foundational pillar of green chemistry. Applied Catalysis A-General, 221(1-2), 3-13. https://doi.org/10.1016/s0926-860x(01)00793-1.
- Anastas, P. T., y Warner, J. C. (2000). Green Chemistry: Theory and Practice. Oxford University Press, USA.
- Borovika, A., Albrecht, J., Li, J., Wells, A. S., Briddell, C., Dillon, B. R., Diorazio, L. J., Gage, J. R., Gallou, F., Koenig, S. G., Kopach, M. E., Leahy, D. K., Martinez, I., Olbrich, M., Piper, J. L., Roschangar, F., Sherer, E. C., y Eastgate, M. D. (2019). The PMI Predictor app to enable green-by-design chemical synthesis. Nature Sustainability, 2(11), 1034-1040. https://doi.org/10.1038/s41893-019-0400-5.
- Derbenev, I. N., Dowden, J., Twycross, J., y Hirst, J. D. (2022). Software tools for green and sustainable chemistry. Current Opinion in Green and Sustainable Chemistry, 35, 100623. https://doi.org/10.1016/j.cogsc.2022.100623.
- DiMasi, J. A., Grabowski, H. G., y Hansen, R. W. (2016). Innovation in the pharmaceutical industry: New estimates of R&D costs. Journal of Health Economics, 47, 20-33. https://doi.org/10.1016/j.jhealeco.2016.01.012.
- Kanza, S., Bird, C., Niranjan, M., McNeill, W. E. S., y Frey, J. G. (2021). The AI for Scientific Discovery Network+. Patterns, 2(1), 100162. https://doi.org/10.1016/j.patter.2020.100162.
- Kanza, S., Willoughby, C., Gibbins, N., Whitby, R. J., Frey, J. G., Erjavec, J., Zupancić, K., Hren, M., y Kovač, K. (2017). Electronic lab notebooks: Can they replace paper? Journal of Cheminformatics, 9(1). https://doi.org/10.1186/s13321-017-0221-3.
- Lin, Y., Zhang, Z., Mahjour, B., Wang, D., Zhang, R., Shim, E., McGrath, A., Shen, Y., Brügger, N., Turnbull, R., Trice, S. L. J., Jasty, S., y Cernak, T. (2022). Author correction: Reinforcing the supply chain of umifenovir and other antiviral drugs with retrosynthetic software. Nature Communications, 13(1). https://doi.org/10.1038/s41467-022-29041-w.
- Meng, X., Zhang, H., Mezei, M., y Cui, M. (2011). Molecular Docking: a powerful approach for Structure-Based drug discovery. Current Computer – Aided Drug Design, 7(2), 146-157. https://doi.org/10.2174/157340911795677602.
- Paul, S. M., Mytelka, D. S., Dunwiddie, C. T., Persinger, C. C., Munos, B. H., Lindborg, S., y Schacht, A. L. (2010). How to improve R&D productivity: the pharmaceutical industry’s grand challenge. Nature Reviews Drug Discovery, 9(3), 203-214. https://doi.org/10.1038/nrd3078.
- Trost, B. M. (1995). Atom Economy—A challenge for organic synthesis: Homogeneous catalysis leads the way. Angewandte Chemie International Edition, 34(3), 259-281. https://doi.org/10.1002/anie.199502591.
Recepción: 04/11/2022. Aceptación: 01/11/2023.


