

Enzimas: aceleradores de reacciones químicas en las células y en la industria
Introducción
Los alimentos son parte de nuestra vida diaria y es muy común que los consideremos principalmente desde un punto de vista culinario, o quizá, de repente, algunos de nosotros les lancemos una fugaz mirada desde una óptica nutricional. Esta vez, los invitamos a observarlos desde un enfoque más profundo, ya que todo lo que constituye nuestra alimentación está formado por compuestos químicos más o menos complejos. Ya sea que estemos saboreando una fruta fresca, un mole poblano, un jugo de manzana o un vaso de leche, ahí está presente la química, y la bioquímica también.En efecto, los alimentos se pueden observar desde el punto de visto químico como una mezcla de moléculas entre las que se encuentran principalmente proteínas, carbohidratos, lípidos y agua; así como el resultado de reacciones que se dan entre dichos componentes para generar otras moléculas que aportan características sensoriales al alimento, como ocurre con el oscurecimiento de la costra del pan al ser horneado. Mientras que la bioquímica, por otro lado, permite explicar algunos cambios que ocurren cuando hay alguna actividad biológica implicada, por ejemplo, cuando se oscurece un plátano o una manzana al quitarles la cáscara y exponerlos al aire. Es normal que no seamos conscientes de que nuestra alimentación comprende el consumo de tejidos vegetales y animales (crudos o procesados), así como productos relacionados con el metabolismo de microorganismos sobre sustratos animales o vegetales, tales como los alimentos fermentados, por ejemplo, el yogurt, la cerveza o el pan. Cuando cambiamos nuestra perspectiva de observación de los alimentos surgen varias preguntas: ¿esas moléculas y compuestos químicos, las comemos tal cual como están en la naturaleza?, ¿sufren algún cambio para poder ser consumidas?, ¿es ese cambio necesario?, ¿es éste un proceso natural o se trata de algo que el hombre ha desarrollado?, ¿es seguro su consumo? Los invitamos a hacer un recorrido en nuestra relación diaria con las enzimas y los alimentos que consumimos.
Los alimentos, las células y las enzimas
Antes de que el gran científico alemán Eduard Buchner se ofreciera como voluntario para el servicio militar durante la Primera Guerra Mundial y muriera finalmente ametrallado a los 57 años, justo 10 años después de ser galardonado con el premio Nobel, este gran químico desarrolló trabajos en la Universidad de Tübingen en los que demostró que el proceso de fermentación, descubierto por Pasteur, se podía llevar a cabo en la ausencia de células. Por estas observaciones Buchner recibió el premio Nobel de Química en 1907,1 después de publicar el trabajo titulado Fermentación alcohólica sin células de levadura (Alkoholische Gährung ohne Hefezellen) (BUCHNER, 1897). El químico supuso que la fermentación era resultado de la actividad de un complejo enzimático, que él llamó zimasa. Su texto inicia: "Hasta ahora no se había conseguido separar la acción fermentativa de las células de levadura, a continuación se describe un procedimiento que resuelve el problema…."2 (Figura 1).

Figura 1. Eduard Buchner.
Actualmente se sabe que la primera etapa de la fermentación alcohólica se lleva a cabo por 10 enzimas y se llama glucólisis, del griego glycos (azúcar) y lysis (ruptura). Como producto de la glucólisis se obtiene piruvato, el que transforma en etanol debido a la acción de dos enzimas más. Buchner nunca imaginó la importancia que las enzimas tendrían décadas después de sus descubrimientos, ya que en la actualidad muchos de los procesos industriales se llevan a cabo en presencia de estas proteínas catalizadoras (aceleradoras) de reacciones químicas. Adicionalmente, ahora sabemos que virtualmente todas las reacciones en los seres vivos son catalizadas por enzimas.
Las enzimas son proteínas que forman parte de las células de todos los seres vivos. Debido a que son capaces de acelerar la velocidad de reacciones químicas es que se les considera catalizadores biológicos y son esenciales para que la célula esté metabólicamente activa. Sin ellas, muchas de las reacciones químicas dentro de la célula serían muy lentas, tanto, que no serían compatibles con la vida (VOET et al., 2013). En el área de alimentos, las enzimas juegan un papel destacado, dado que muchas reacciones catalizadas por éstas se llevan a cabo en los alimentos o en procesos alimentarios, tanto que el 30% de las enzimas que se producen industrialmente se utilizan en el área de alimentos y bebidas.
Estas proteínas se clasifican de acuerdo con las reacciones que catalizan en: oxidoreductasas (aceleran reacciones de óxido-reducción), transferasas (transfieren grupos químicos entre moléculas), hidrolasas (rompen o sintetizan enlaces covalentes de las moléculas), liasas (rompen enlaces formando a su vez dobles ligaduras), isomerasas (catalizan un rearreglo espacial de grupos químicos en la molécula sin modificar su composición química) y ligasas (promueven unión covalente de dos moléculas acopladas con la ruptura de un enlace pirofosfato como fuente de energía). En la Tabla 1 se muestran algunos ejemplos de enzimas y sus aplicaciones en alimentos.
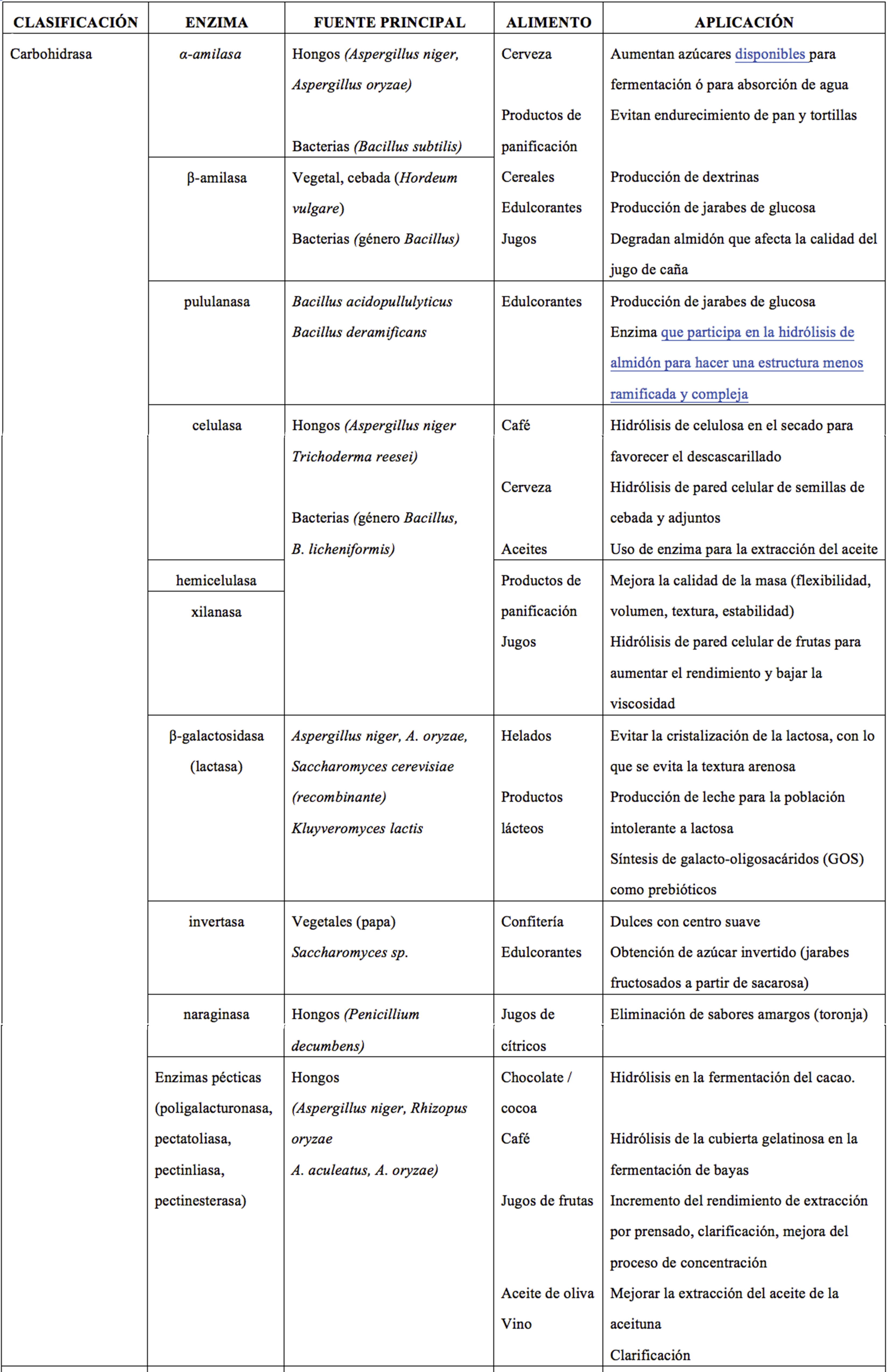
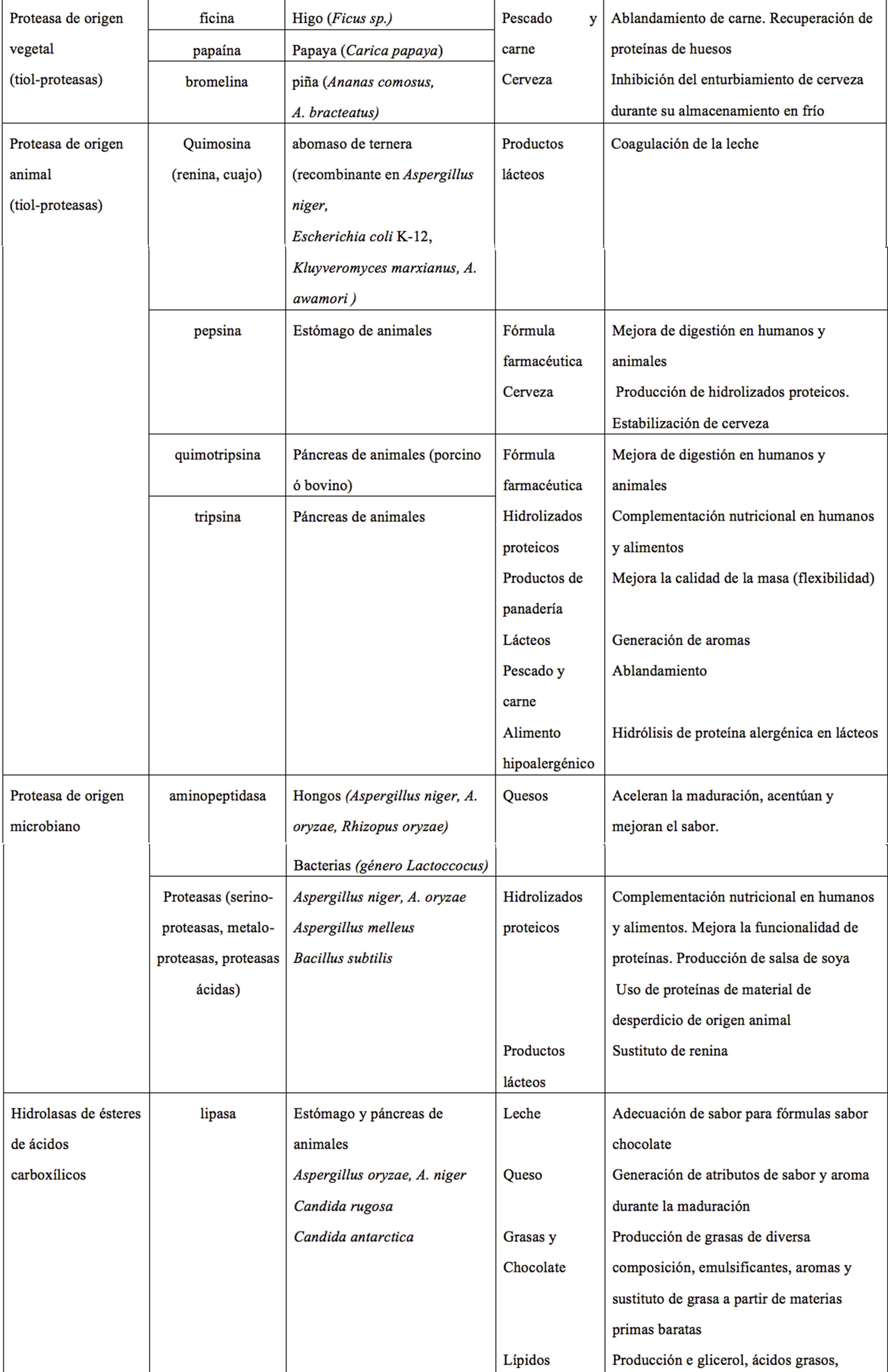
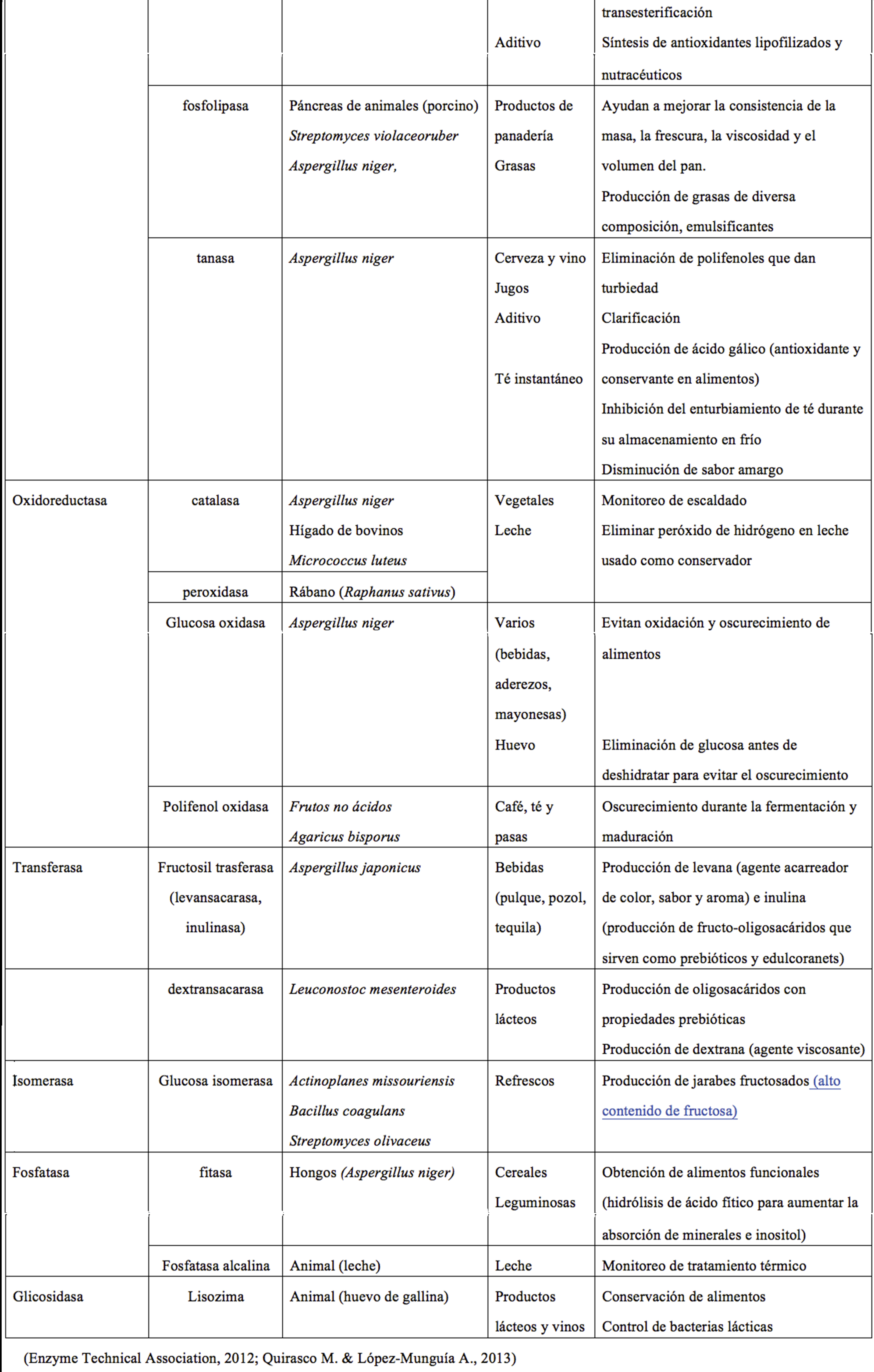
Tabla 1. Ejemplos de enzimas usadas en alimentos y su fuente de obtención.
Las enzimas pueden estar relacionadas directamente con las reacciones metabólicas de las células que constituyen un alimento. Por ejemplo, el que un fruto madure depende directamente de un grupo de enzimas que se expresan diferencialmente de acuerdo con la etapa de maduración. Este es el caso de las pectinasas del jitomate, manzanas y peras, entre otras, que son responsables del ablandamiento que sufren los frutos al madurar (QUIRASCO & LÓPEZ-MUNGUÍA, 2013). De igual forma, el proceso de germinación de una semilla depende de que ésta se hidrate y de que enzimas hidrolicen (degraden) el almidón –polisacárido de reserva–, haciendo disponible la glucosa que el embrión requiere para desarrollarse. En dicho proceso se basa la producción de malta dentro de la semilla de cebada (por acción concertada de las enzimas α y β-amilasas), que posteriormente se utilizará para la producción de cerveza (MATHEWSON, 1998). Los ejemplos anteriores muestran actividades propias del metabolismo de las plantas que dan como resultado un alimento listo para consumir o un sustrato o materia prima (la malta) apropiado para ser transformado. Particularmente, en el caso de la cerveza y otras bebidas alcohólicas obtenidas a partir de un proceso fermentativo, existe además el efecto de la actividad metabólica de las levaduras –del género Saccharomyces– para la producción de etanol a partir de los azúcares del mosto (VOET, 2013) (Figura 2).

Figura 2. Ruta metabólica de producción de etanol.
Las enzimas también son utilizadas en la preparación de alimentos. ¿Cuántos de nosotros empleamos ablandadores de carne como práctica en la cocina? El ingrediente activo de esa preparación culinaria son enzimas proteolíticas o proteasas, las cuales son de origen vegetal y se llaman papaína y bromelina (Tabla 1). Las proteasas hidrolizan proteínas, como las que forman parte de los filamentos musculares y el colágeno de la carne, con la subsecuente modificación de la textura del tejido muscular, haciéndolo más blando (GUERRERO, 1999).

Figura 3. Queso camembert. Ya que tocamos el tema de las proteasas, éstas son muy utilizadas en la industria de alimentos en procesos tales como la elaboración de cerveza y en la producción de salsa de soya. En el primer caso, en la producción de cerveza hay una etapa en la que ésta se enfría pudiéndose formar cierta turbidez indeseable en el producto. La papaína se utiliza para hidrolizar proteínas residuales de la malta responsables del enturbiamiento. El caso de la producción de la salsa de soya es muy interesante, pues involucra un proceso fermentativo de un hidrolizado de proteínas de soya y trigo. Dicho hidrolizado se obtiene por la acción de proteasas extracelulares de dos hongos microscópicos que participan en el proceso (Aspergillus oryzae y Aspergillus sojae), aunque se pueden agregar proteasas puras para acelerar la hidrólisis de las proteínas de soya y trigo.

Figura 4. Queso roquefort. Las enzimas proteolíticas han sido utilizadas por el hombre desde tiempos antiguos. Una de las aplicaciones que datan de las épocas más remotas de la civilización humana es la utilización de enzimas para la producción de queso. La renina o quimosina es una proteasa que se obtiene del cuarto estómago de rumiantes aún no destetados, es una enzima cuya actividad es muy específica ya que hidroliza un solo enlace de la proteína más abundante en la leche, llamada k-caseína. Al romper este enlace, se forma un coágulo que conocemos como cuajada. Ésta se separa del suero, se sala y se prensa, con lo que se obtiene el queso fresco que es altamente consumido en nuestro país (QUIRASCO & LÓPEZ-MUNGUÍA, 2013). Ahora que, si hablamos de quesos madurados, para su elaboración intervienen lipasas y proteasas extracelulares que producen, por ejemplo, hongos como Penicillium camemberti o Penicillium roqueforti, con lo que se obtienen los quesos camembert y roquefort, respectivamente. Las lipasas hidrolizan la grasa contenida en la leche de manera gradual, con la generación de compuestos de aroma y sabor como el ácido butírico, los cuales, a su vez, pueden ser transformados químicamente a otras moléculas llamadas aldehídos y cetonas que también aportan aromas característicos de los quesos. Por su parte, las proteasas hidrolizan parcialmente a las proteínas de la leche, con lo que se produce un cambio de textura en el producto, haciéndolo más suave. En algunos quesos fuertes, como el roquefort, es posible percibir un aroma a amoniaco, el que se produce por una posterior descomposición de los aminoácidos que se obtuvieron por la hidrólisis de las proteínas (MARILLEY & CASEY, 2004) (Figuras 3 y 4).
1 Para más información: http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1907/buchner-bio.html
2 BUCHNER, E. "Alkoholische Gärung ohne Hefezellen", Berichte der deutschen chemischen Gesellschaft, 1897, 30, pp.1110-1113.
Las enzimas y la conservación de alimentos
Las enzimas también tienen un papel importante en la conservación de las características químicas y sensoriales del alimento durante su proceso y almacenamiento. A nivel industrial es una práctica común manejar el huevo en polvo, con el fin de tener un producto más estable y más fácil de manejar. Para este fin, el huevo se debe secar después de haberle eliminado la glucosa (presente en la yema, principalmente), utilizando una enzima llamada glucosa oxidasa. De no hacerlo, durante el secado se llevaría a cabo una reacción entre la glucosa y las proteínas del huevo, dando como resultado un polvo de color oscuro. La glucosa oxidasa también consume oxígeno, por lo que se utiliza para evitar que productos con alto contenido de grasas se oxiden. Se han desarrollado empaques para alimentos donde la enzima se encuentra "atrapada" en el material de empaque de tal forma que consume el oxígeno, evitando así que el producto se enrancie. Este tipo de empaques se ha utilizado para mantener las propiedades sensoriales de quesos y mayonesa durante su almacenamiento (BANKAR et al., 2009).Durante siglos se han utilizado bacterias ácido lácticas para la conservación de alimentos. Por mucho tiempo se consideró que el ácido láctico producido por estos microorganismos era el único responsable de evitar que otras bacterias se desarrollaran en el alimento. Recientemente, se ha encontrado que algunas bacterias lácticas como Pediococcus y Enterococcus, aisladas de productos cárnicos y quesos, que además producen enzimas que tienen un efecto inhibitorio contra bacterias patógenas como Salmonella enterica, Staphylococcus aureus y Listeria monocytogenes (GARCÍA-CANO et al., 2014). Dichas enzimas se llaman peptidoglucán hidrolasas y se encargan de eliminar a los patógenos, debido a la ruptura de su envoltura celular, con lo que la utilización de estas enzimas en alimentos podría tener un efecto de bioconservación.
La respuesta biotecnológica a las necesidades cambiantes de la sociedad
Quizá la aplicación más importante de enzimas en la industria de alimentos es la relacionada con la hidrólisis del almidón para obtener edulcorantes: glucosa y fructosa. El maíz tiene como principal azúcar de reserva al almidón, el cual, al ser hidrolizado exhaustivamente con las enzimas α-amilasa (de la bacteria Bacillus licheniformis) y amiloglucosidasa (del hongo Aspergillus niger) (Figura 5), da como resultado un jarabe con un 97% de glucosa, que se utiliza ampliamente como agente espesante, edulcorante y humectante en la producción de dulces. Los jarabes glucosados pueden ser tratados con otra enzima, la glucosa isomerasa, con el fin de convertirla en fructosa, aumentando así su poder endulzante. Los jarabes fructosados, muy utilizados en la elaboración de bebidas azucaradas como jugos y refrescos, se producen en el mundo en una cantidad de 15 millones de toneladas por año (ADRIO & DEMAIN A, 2014).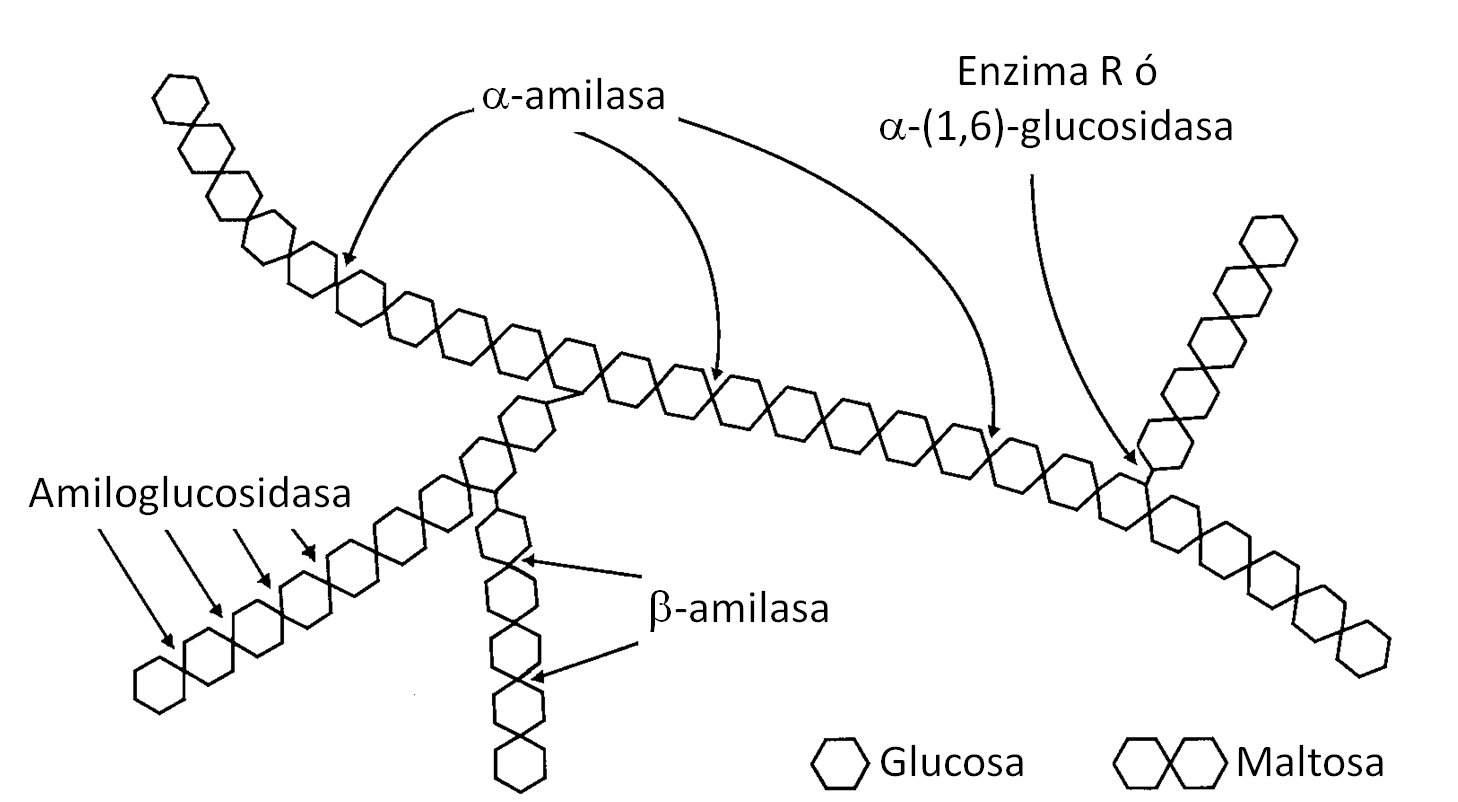
Figura 5. Hidrólisis enzimática del almidón. Uhlig H., 1998.
Hablando de jugos, existe otra aplicación importante de enzimas en dichos productos. Cualquiera que haya hecho jugo de manzana en casa habrá observado que éste es turbio, sin embargo, el comercial es translúcido. ¿Cuál es la razón de esa diferencia? Si piensas que es debido a la adición de una enzima, ¡estás en lo correcto! Se hace un tratamiento enzimático con pectinasas para clarificar el jugo (QUIRASCO & LÓPEZ-MUNGUÍA, 2013).
Un problema común en la población mexicana es que existen problemas digestivos al consumir leche, sobre todo en la edad adulta. Esto se puede deber a que no tengamos la capacidad de hidrolizar la lactosa de la leche, lo que se conoce como intolerancia a la lactosa. Si la lactosa llega al intestino grueso, es metabolizada por los microorganismos que ahí habitan con la generación de gas, que es el causante del malestar abdominal que sentimos. Actualmente tenemos a la mano la solución a ese problema. Comercialmente ya está disponible la leche deslactosada, la cual se obtiene al poner la enzima β-galactosidasa (de levaduras del género Kluyveromyces) en contacto con la leche. Quizá han notado que la leche deslactosada es más dulce que la regular, esto se debe a que los azúcares producto de la hidrólisis de la lactosa (glucosa y galactosa) son más dulces.
Los grupos de enzimas más importantes de aplicación en alimentos son: Las carbohidrasas (hidrolasas que rompen o sintetizan los enlaces glicosídicos en los carbohidratos) son uno de los grupos más utilizados en alimentos, sobre todo en la producción de edulcorantes derivados de almidón que confieren un sabor dulce al alimento enmascarando gustos amargos o desagradables, en la producción de derivados de panificación y como aditivos para evitar el endurecimiento de pan y tortilla y en la producción de caramelos de centro suave, entre otros usos.
Las proteasas (hidrolasas que rompen en enlace peptídico que une a los aminoácidos de las proteínas) constituyen también un grupo muy usado a nivel industrial, algunos ejemplos de uso son en el desarrollo de cuerpo y sabor en la cerveza, mientras que en panificación aumentan textura y volumen del pan, en la producción de quesos generan sabores en la maduración, e incluso se emplea para mejorar las propiedades de secado del huevo.
Las lipasas (que catalizan la ruptura de enlaces éster de las grasas y aceites presentes en los alimentos) se utilizan principalmente para la generación de sabores.
Las oxidoreductasas están involucradas en las reacciones oxidativas en alimentos, como son el oscurecimiento de frutas, la oxidación de ácidos grasos de origen animal o la degradación de vitaminas. Las transferasas son enzimas muy importantes para la generación de alimentos funcionales (aquellos que contribuyen a la salud del consumidor más allá de su beneficio puramente nutricional). Tanto transferasas como las levansacarasas, dextransacarasas e inulosacarasas generan azúcares que tienen utilidad como prebióticos –es decir, que favorecen el desarrollo de microorganismos benéficos en el intestino– entre otras aplicaciones.
Por último, las isomerasas, que fueron las primeras que se usaron industrialmente, con el fin de producir jarabes fructosados.
Es interesante saber que el mercado de producción de enzimas para la industria de alimentos es un negocio muy redituable, pues en 2011 representó ganancias de 1.2 mil millones de dólares, y tiene un crecimiento anual compuesto del 10.4 % (ADRIO & DEMAIN, 2014). Cada vez es mayor la demanda de enzimas con características catalíticas y de producción más adecuadas para los requerimientos industriales, por lo que desde hace varias décadas se han desarrollado enzimas recombinantes. Éstas se llaman así porque se obtienen de otro organismo diferente al que lo produce originalmente, a través de la utilización de una metodología bioquímica denominada ingeniería genética, que involucra la transferencia de material genético del organismo original al nuevo o recombinante. Uno de los ejemplos más importantes es la producción de quimosina bovina en un organismo diferente al ternero. La industria quesera requiere cada vez más cantidad de esta enzima tan particular y su obtención a partir de tejido animal es insuficiente. Entonces, una opción viable y segura fue la introducción del gen que codifica para la quimosina en una bacteria, de tal forma que actualmente se puede obtener una mayor cantidad de dicha enzima en menor tiempo, con la certeza de que la especificidad es la misma y que es seguro su consumo (MOHANTY et al., 1999).
Cabe mencionar que las enzimas que se aplican en alimentos han pasado por un proceso de evaluación muy riguroso para asegurar que su consumo es seguro. Quizá la duda sobre la seguridad de su consumo es mayor en el caso de nuevos desarrollos, pero tenemos la tranquilidad de que antes de que su aplicación sea comercial éstas debieron ser evaluadas. Las enzimas se consideran como aditivos alimentarios, por lo que su evaluación y regulación se lleva a cabo por organismos internacionales como el Comité Mixto de Expertos en Aditivos Alimentarios de la Organización Mundial de la Salud (http://www.fao.org/food/food-safety-quality/scientific-advice/jecfa/jecfa-additives/es/) (JECFA, por sus siglas en inglés) y la Administración de Medicamentos y Alimentos de Estados Unidos de América http://www.fda.gov/Food/IngredientsPackagingLabeling/GRAS/EnzymePreparations/default.htm) (FDA, por sus siglas en inglés).
Aromas y sabores – las lipasas
Las lipasas son un grupo importante dentro de las enzimas que se producen industrialmente debido a que pueden ser utilizadas en la obtención de una amplia variedad de productos (Tabla 2). Éstas son enzimas ubicuas, ya que se encuentran en los animales, plantas, hongos y bacterias, sin embargo, las que se producen industrialmente provienen de microorganismos, principalmente de hongos. Poseen una característica única, la capacidad de actuar en la interfaz entre una fase acuosa y una no acuosa, su estructura característica presenta una tapa o cubierta que cubre al sitio activo (que es el lugar donde se lleva a cabo la hidrólisis). Cuando la enzima se encuentra en la interfaz, la tapa se abre, dejando expuesto el sitio activo (DEREWENDA et al., 1992). La función biológica de estas enzimas es catalizar la hidrólisis de lípidos (triacilgliceroles, grasas, aceites). En la Figura 6 se puede observar la reacción característica de estas enzimas, donde el triglicérido (a) (que es una molécula que tiene unidos 3 ácidos grasos al glicerol por un enlace químico de tipo éster) es hidrolizado por acción de la lipasa para generar los ácidos grasos libres (b) y el glicerol (c) cuando se trata de una hidrólisis total. También las lipasas pueden sintetizar ésteres (compuestos que tienen aroma) cuando la actividad acuosa (cantidad de agua disponible para reaccionar) es baja, por lo que el crecimiento de la aplicación comercial de lipasas es muy significativo y prometedor (DEREWENDA, 1994).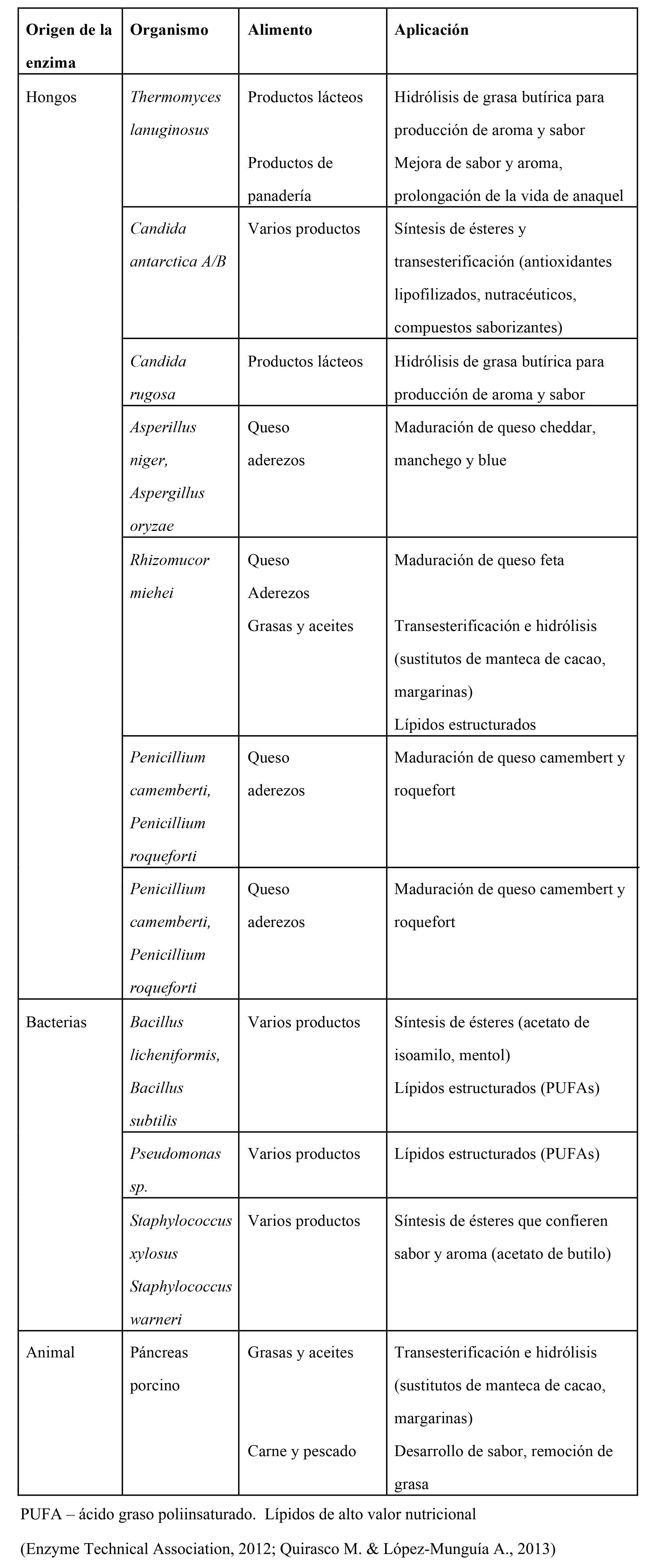
Tabla 2. Aplicación de lipasas en alimentos.

Figura 6. Reacción catalizada por lipasas.
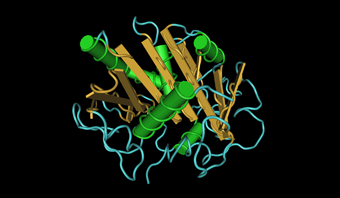
Figura 7. Modelo tridimensional de la lipasa de Thermomyces lanuginosa.
Actualmente se produce un gran número de lipasas a escala industrial, y la mayoría se utiliza en reacciones de hidrólisis para el desarrollo de sabor y aromas en los productos lácteos y el procesamiento de otros alimentos, como la carne, verduras, fruta, alimentos horneados y cerveza. Sin embargo, como se mencionó arriba, las lipasas se han empleado con éxito como un catalizador para la síntesis de ésteres, los cuales se producen a partir de ácidos grasos de cadena corta y se utilizan como agentes aromatizantes en la industria alimentaria.
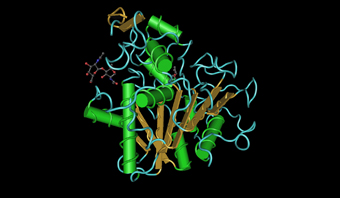
Figura 8. Modelo tridimensional de la lipasa de Candida antarctica.
Es importante mencionar que las moléculas de ácidos grasos que contienen los triglicéridos pueden ser todas iguales (oleico) o pueden ser diferentes. Además, los ácidos grasos tienen un nombre de acuerdo con su tamaño y estructura, por ejemplo: el conocido ácido oleico es una molécula que contiene 18 carbonos en su estructura y presenta la unión de dos carbonos por un doble enlace, y el ácido butírico (del cual está constituida en su mayoría la grasa de la leche) es una molécula con sólo 4 carbonos. En este contexto, las lipasas también se han utilizado atrapadas en soportes inertes para la generación de varios lípidos modificados como:
a) Lípidos estructurados. Son moléculas de lípidos cuya composición de ácidos grasos ha sido determinada por un proceso de laboratorio para mejorar o disminuir la capacidad de ser utilizada por el humano (biodisponibilidad) de uno o de los tres ácidos grasos que lo componen. En sentido coloquial, es un lípido hecho a la medida para una función nutricional o tecnológica específica. Un ejemplo de estos lípidos es el triacilglicérido OPO (oleico-palmítico-oleico), con la misma estructura al de la leche humana, el cual se obtiene de la interesterifiación (intercambio de moléculas de ácidos grasos en el lípido) de triplamitina con ácido oleico. Otro ejemplo es la producción de sustituto de manteca de cacao para chocolate, en este caso se utiliza una grasa proveniente de una materia prima barata como el aceite de palma, la cual por interesterificación enzimática es modificada intercambiando sus ácidos grasos por los que contiene la manteca de cacao (VALENZUELA et al., 2002).
b) Sustitutos de grasa bajos en calorías. Estructuralmente tienen similitud con las grasas de origen en sus propiedades físicas, químicas, y organolépticas, pero no constituyen sustrato para las lipasas digestivas humanas y, por tanto, el aporte calórico es menor. Éstas se obtienen por modificación enzimática con lipasas (VALENZUELA et al., 2002).
c) Antioxidantes lipofilizados. Muchos de los antioxidantes utilizados en alimentos limitan su aplicación debido a que son hidrosolubles (solubles únicamente en agua). En este contexto, las lipasas son una solución ya que se utilizan para catalizar la reacción de síntesis de ésteres adicionando al antioxidante una molécula lipofílica, como puede ser un ácido graso de cadena larga, aumentando así su solubilidad en grasas y aceites (liposolubilidad). De esta forma, se han modificado antioxidantes como los flavonoides, ácido kójico, vitamina E, vitamina C y compuestos fenólicos, para poderlos adicionar en alimentos como aceites, aderezos de ensalada, mayonesa, etc. (VILLENEUVE, 2007)
d) Nutraceúticos. Son moléculas presentes en los alimentos que aportan un beneficio a la salud del consumidor (bioactivos). Algunos tienen problemas de solubilidad en grasas, estabilidad e incluso disponibilidad; las lipasas pueden llevar a cabo reacciones bioquímicas en moléculas como el mentol, saponinas o fitoesteroles, que permiten la adición de ácidos grasos de cadena larga para aumentar su liposolubilidad o su hidrólisis para aumentar su biodisponibilidad (FERREIRA-DIAS et al., 2013).
Conclusión
Las enzimas están involucradas en diversos aspectos de la producción de alimentos. Se pueden agregar a un proceso, pero también pueden ser elaboradas por microorganismos presentes en fermentaciones, lo que da como resultado un alimento con características de composición y sensoriales deseables para su aceptación por el consumidor. Por otro lado, no se debe olvidar que forman parte del metabolismo de las células que consumimos como parte de nuestra alimentación: frutas, verduras y de tejidos animales. Adicionalmente, su utilización para la producción de materias primas en la industria alimentaria es muy relevante.Por lo anterior, nuestra relación diaria con las enzimas (y la bioquímica de los alimentos) es un hecho que no se puede soslayar.
Bibliografía
ADRIO, J. L., Demain, A. L. "Microbial Enzymes: Tools for Biotechnological Processes", Biomolecules, 2014, 4, pp. 117-139.
BANKAR, S. B., Bule, M. V., Singhal, R. S., Ananthanarayan, L. "Glucose oxidase - An overview", Biotechnology Advances, 2009, 27, pp. 489–501.
BUCHNER, E. "Alkoholische Gärung ohne Hefezellen", Berichte der deutschen chemischen Gesellschaft, 1897, 30, pp.1110-1113.
DEREWENDA, Z. S. "Structure and function of lipases", Advances in protein chemistry, 1994, 45, pp. 1-52.
DEREWENDA, Z. S., Derewenda, U., Dodson, G. G. "The crystal and molecular structure of the Rhizomucor miehei triacylglyceride lipase at 1.9 Å resolution", Journal of molecular biology, 1992, 227, pp. 818-839.
Enzyme Technical Association. http://www.enzymeassociation.org/
FERREIRA-DIAS, S., Sandoval, G., Plou, F., Valero, F. "The potential use of lipases in the production of fatty acid derivatives for the food and nutraceutical industries", Electronic Journal of Biotechnology, 2013, 16, pp. 1-28.
GARCÍA-CANO I., Serrano-Maldonado C. E., Olvera-García M., Delgado-Arciniega E., Peña-Montes C., Mendoza-Hernández G., Quirasco M. "Antibacterial activity produced by Enterococcus spp. isolated from an artisanal Mexican dairy product, Cotija cheese", LWT – Food Science and Technology, 2014, 59, pp. 26-34.
GUERRERO, I. "Productos cárnicos". En García M., Quintero R., López-Munguía A. (comp.) Biotecnología alimentaria, México D.F.: Limusa, 1999, p. 231.
MARILLEY, L. & Casey, M.G. "Flavours of cheese products: metabolic pathways, analytical tools and identification of producing strains", International Journal of Food Microbiology, 2004, 90, pp.139-59.
MATHEWSON, P. Enzymes. Practical Guide for the Food Industry. Minnesota: American Association of Cereal Chemists, 1998, pp. 59-63.
MOHANTY, A. K., Mukhopadhyay, U. K., Grover, S., Batish, V. K. "Bovine chymosin: Production by rDNA technology and application in cheese manufacture". Biotechnology Advances, 1999, 17, pp. 205-217.
QUIRASCO, M., López-Munguía, A. Enzimas. En Baduí, S. (ed.) Química de los Alimentos, 5ª. Ed., México: Pearson, 2013, pp. 275 - 339.
UHLIG, H. Industrial Enzymes and their Applications, New Jersey: John Wiley & Sons, Inc., 1998, pp. 224-252.
VALENZUELA, A., Sanhueza, J., Nieto, S. "El uso de lípidos estructurados en la nutrición: una tecnología que abre nuevas perspectivas en el desarrollo de productos innovadores", Revista chilena de nutrición, 2002, 29, pp. 106-115.
VILLENEUVE, P. "Lipases in lipophilization reactions", Biotechnology Advances, 2007, 25, pp. 515-536.
VOET, D., Voet, J., Pratt, C. Fundamentals of Biochemistry. Life at the Molecular Level, 4ª. Ed., New Jersey: John Wiley & Sons, Inc., 2013, pp. 440, 493.
COMENTARIOS
Dirección General de Cómputo y de Tecnologías de Información y Comunicación














