

Revista Digital Universitaria ISSN: 1607 - 6079 | Publicación mensual
1 de enero de 2015 vol.16, No.1
• TEMA DEL MES •
Estructura, función y organización de las proteínas. Un Homenaje al Dr. Armando Gómez Puyou
Introducción
Como le ocurre a la mayoría de los investigadores científicos, la mayor parte de los experimentos fallidos que he hecho en mi vida han tenido resultados irrelevantes. Una excepción a esta aseveración la constituye un experimento que hice en 1992, tratando de ayudar a quien entonces era estudiante de doctorado, Rafael Zubillaga Luna, cuyo tutor era el Dr. Armando Gómez Puyou. Dada mi experiencia en la modificación de proteínas con yodo radiactivo, tanto Rafael, como el doctor me solicitaron asesoría para yodar radioactivamente la triosafosfato isomerasa (TIM) de conejo, porque necesitaban detectarla en un sistema de micelas invertidas en el que la estaban estudiando. Esta enzima es muy importante por formar parte de una vía metabólica fundamental llamada glucólisis, la cual ocurre en casi todas las células que se conocen. En aquel entonces, el Dr. Gómez Puyou estudiaba el comportamiento de las enzimas cuando llevan a cabo su función catalítica en micelas invertidas. Inmediatamente accedí a hacerlo, pues tenía bastante experiencia yodando otras proteínas por varios de los métodos más comunes en aquella época, particularmente, utilizando un reactivo oxidante llamado cloramina-T.Algo de química
La cloramina–T es un reactivo oxidante, por la característica de que posee un grupo funcional llamado N-cloro-sulfonil-amida (Figura 1). El cloro de este grupo funcional puede ser electrofílico, es decir, amigo de átomos con electrones libres, como lo es el ion yoduro. Este átomo se simboliza como I-, yodo con una carga negativa, o sea con un electrón libre. Si la cloramina–T se pone en agua produce hipoclorito (ClO-), el cual es un agente oxidante para el yodo, quien forma cloruro de yodo (ICl) (Figura 1). Esta última molécula es capaz de reaccionar uniendo el yodo a la tirosina, uno de los 20 aminoácidos que conforman las proteínas. En caso de que el yodo que se utilice en esta reacción química sea un isótopo radioactivo, como el yodo 125, las tirosinas de la proteína quedarán marcadas radioactivamente y se podrán detectar cuantitativamente con aparatos que midan radiaciones tipo gama, que son las que emite el yodo 125. Así, al estar marcadas radiactivamente, con este método se pueden detectar, con muchísima precisión, cantidades pequeñísimas de la proteína.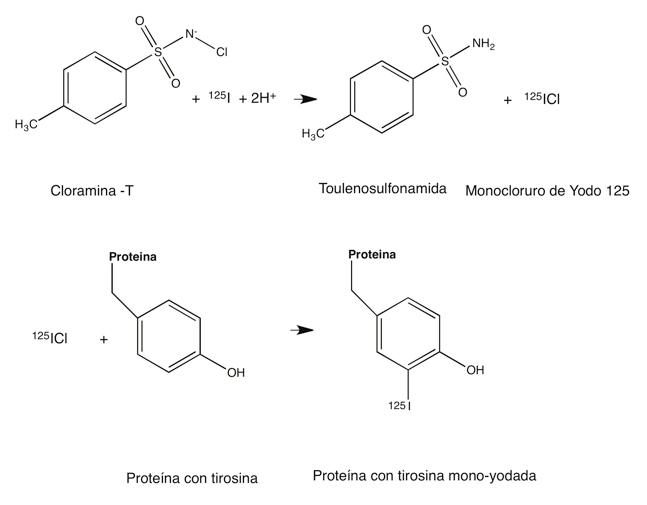
Figura 1. Yodación de tirosinas en proteínas por acción de la cloramina–T.
Yodación con cloramina–T
La metodología de la yodación con cloramina–T es sencilla y consiste en disolver una cantidad conocida de la proteína que se va a yodar en una solución amortiguadora neutra y agregar a dicha solución otras dos soluciones: la primera de yoduro de sodio marcado con yodo 125 (NaI125) y la segunda de cloramina–T. La mezcla se incuba durante 30 segundos (periodo en el que ocurre la radio-yodación) y, posteriormente, se agrega una cantidad suficiente del agente reductor metabisulfito de sodio para detener la reacción oxidativa de la cloramina–T.El siguiente paso consiste en separar la proteína marcada del yodo radioactivo que no reaccionó (y por tanto no quedó unido covalentemente a ella) y del agente reductor que se agregó. En el siguiente paso se hace una filtración molecular rápida utilizando una resina llamada Sephadex producida a partir de dextranas entrecruzadas, operación conocida como cromatografía de exclusión molecular. Las dextranas son un tipo de polisacárido que forma esferas porosas muy pequeñas que son capaces de separar moléculas de distintos tamaños, y muy eficientes para separar aquellas que son muy pequeñas (como el yoduro de sodio u otros derivados del yodo, la cloramina-T y el metabisulfito de sodio) de una molécula grande (100 veces más grande) que es la TIM yodada.
La separación puede hacerse con un método muy rápido, eficiente y barato que emplea cantidades muy pequeñas de Sephadex formando una pequeña columna en un tubo desechable de plástico con la ayuda de una centrífuga. En este método, al colocar la mezcla de reacción en que se hizo la yodación de proteína sobre la columna de Sephadex en el tubo de ensayo, las moléculas muy pequeñas viajan lentamente y
Figura 2. Esquema de una "columna de Penefsky" por lo mismo quedan atrapadas en las esferas porosas de las dextranas entrecruzadas, mientras que la molécula grande de la proteína yodada no puede penetrar en la estructura porosa del Sephadex y pasa directo al fondo del tubo, ayudada por la fuerza centrífuga a la que se somete la pequeña columna. Como ésta sólo tiene el agua de hidratación del amortiguador en que se preparó, el total de la proteína que se agrega inicialmente sale completamente pura en el líquido que se colecta a través de un agujero que se hace previamente en el fondo del tubo y que se capta en otro recipiente que lo rodea. La invención de este método de separación rápido de moléculas grandes de moléculas pequeñas se le atribuye al Dr. Harvey Penefsky, por lo que a esta metodología se le conoce como “separación con columnas de Penefsky” (Figura 2). Una vez que se obtiene la proteína pura yodada se puede saber cuánto yodo se pegó a la proteína determinando cuantitativamente la radioactividad que tiene una cantidad conocida de proteína.
El experimento fallido y el Dr. AGP en acción
Para yodar radioactivamente la TIM de conejo empleando la cloramina–T se siguió la metodología antes descrita. Fueron utilizadas disoluciones frescas de cloramina–T y de metabisulfito de sodio y se prepararon las columnas de Penefsky que eran requeridas. Cuando se obtuvo la muestra con lo que debía ser la TIM yodada, tomamos una muy pequeña porción de ella para determinar su actividad específica en un contador de rayos gama. Lo primero que llamó la atención es que había muy baja radioactividad en la muestra, es decir, de apenas entre un 10 y un 1% de la que usualmente se detecta en este tipo de experimentos.Algo había salido muy mal en la prueba: el yodo casi no se había unido a la TIM. Para averiguar lo que había ocurrido fue necesario realizar un experimento adicional, el cual rutinariamente se hace para confirmar que la mayor parte del yodo que se encuentra en la muestra después de emplear la columna de Penefsky, está realmente pegado covalentemente a la proteína. Hicimos una precipitación por desnaturalización con ácido tricloroacético. En presencia de este ácido la proteína se desnaturaliza, es decir, pierde su estructura tridimensional, se agrega y se precipita, dejando en solución al yodo radioactivo libre y no unido covalentemente a la proteína. Al centrifugar, se separa el precipitado del sobrenadante y se puede medir la radioactividad en ambas fracciones. Los resultados típicos de una buena yodación son que entre el 95 y el 99% de la radioactividad debe estar asociada covalentemente a la proteína y, por lo tanto, aparecer en la fracción del precipitado. En este experimento, determinamos que era muchísimo menos que eso, sólo entre el 40 y 60%. Es decir, comprobamos que el experimento de yodación había sido fallido.
Le comunicamos este fracaso al Dr. Gómez Puyou, quien nos pidió que en el segundo intento guardáramos muestras de los distintos pasos del procedimiento. Hicimos el segundo experimento de yodación y los resultados fueron iguales a los del primero: un fracaso. A los pocos días de ese segundo intento, el doctor nos explicó que había hecho algunos experimentos en su laboratorio, encontrando que en las condiciones en que habíamos trabajado, la cloramina–T inhibe completamente la reacción enzimática que realiza de la TIM de conejo, pero inhibe muy poco la de la TIM de la levadura. Alcanzó está conclusión determinando la actividad enzimática de la TIM de conejo supuestamente yodada en las soluciones del segundo experimento que le habíamos dado y, además, había hecho varios experimentos, ya sin radioactividad, con las TIMs de conejo y de levadura agregándoles sólo cloramina–T.
Para continuar, es necesario recordar que la TIM es una enzima que cataliza la interconversión reversible de D-gliceraldehido-3-fosfato y dihidroxiacetona fosfato, y su actividad catalítica se determina en forma acoplada a una segunda enzima, midiendo la conversión del D-gliceraldehido-3-fosfato a dihidroxiacetona
 | Así, un experimento fallido llevó a hacer otro tipo de experimentos y de todos ellos se alcanzó una conclusión relevante: es posible inactivar una enzima con un reactivo especie-específico, esto es, aquel que es capaz de inhibir la enzima de una especie afectando menos a la enzima equivalente proveniente de otra especie. | |
 | ||
Regresando a la inactivación diferencial de las TIMs de conejo y levadura, la explicación a las observaciones del Dr. Gómez Puyou era que, al ser la cloramina-T un agente oxidante, puede actuar sobre otros aminoácidos de las proteínas oxidándolos y no sólo sobre las tirosinas.El doctor también había averiguado que otros aminoácidos susceptibles de ser oxidados en proteínas eran las metioninas y las cisteínas; adicionalmente podían ser las histidinas o, en menor grado, los triptófanos. Así, un experimento fallido llevó a hacer otro tipo de experimentos y de todos ellos se alcanzó una conclusión relevante: es posible inactivar una enzima con un reactivo especie-específico, esto es, aquel que es capaz de inhibir la enzima de una especie afectando menos a la enzima equivalente proveniente de otra especie. El Dr. Gómez Puyou había encontrado que con las TIMs de conejo y levadura y la cloramina-T la inhibición es especie-específica.
Muy pronto determinamos los aminoácidos oxidados por acción de la cloramina-T. En el caso de las TIMs de conejo y levadura son metioninas y cisteínas. La TIM de conejo tiene 2 metioninas, mientras que la de levadura no tiene ninguna. A su vez, la TIM de conejo tiene 5 cisteínas y la de levadura 2, las cuales se encuentran en posiciones equivalentes a dos de las cisteínas en la secuencia de la enzima del conejo. Así, establecimos que la inactivación diferencial entre las TIMs de conejo y levadura se debía a la oxidación de una o de las dos metioninas que tenía la enzima del conejo. En experimentos posteriores se pudo determinar cuál de las dos metioninas que tenía la TIM de conejo es la principal responsable de la inactivación de la enzima por oxidación con cloramina–T.
Inactivación especie-específica de enzimas y el diseño de fármacos antitripanosomales
La inactivación especie-específica de enzimas puede ser una manera de desarrollar tratamientos para algunas enfermedades parasitarias que aquejan a un gran número de personas. Hay varios ejemplos de parásitos unicelulares de humanos que tienen una o más enzimas que sólo ocurren en las células de dichos parásitos y no en las células del huésped. Para inactivar dichas enzimas parasitarias se pueden diseñar moléculas que interactúen con su sitio activo y causen su inhibición. Sin embargo, frecuentemente existe el problema de que estas enzimas propias de los parásitos no son fundamentales para su sobrevivencia y estos pueden subsistir, proliferar y seguir causando la enfermedad, aunque esas enzimas parasitarias estén inactivadas.En cambio, si la inactivación especie-específica se enfoca en una enzima que exista tanto en las células parasitarias como en las células del huésped, el problema de la selectividad se vuelve más complejo, pero se pueden inactivar entonces enzimas que sean de importancia vital para el parásito (que frecuentemente también lo serán para el huésped, en caso de que la enzima del huésped también se inactive). Por lo tanto, en el diseño de agentes que inactiven enzimas que formen parte de las células de un huésped y un parásito, la meta es tener una molécula que se pegue específicamente, y con gran afinidad, a la enzima del parásito causando su inactivación, y no lo haga con la enzima del huésped. Esto sólo se puede lograr si hay regiones con diferencias significativas entre las enzimas del parásito y el huésped.
 | Por lo tanto en el diseño de agentes que inactiven enzimas que formen parte de las células de un huésped y un parásito, la meta es tener una molécula que se pegue específicamente, y con gran afinidad, a la enzima del parásito causando su inactivación, y no lo haga con la enzima del huésped. | |
 | ||
Después de haber inactivado en forma especie-específica las TIMs de conejo y levadura, fue notorio que la TIM era una enzima de importancia vital para los parásitos humanos que causan la enfermedad del sueño en algunas partes de África y la enfermedad de Chagas en Latinoamerica. Estos parásitos se llaman Trypanosoma brucei y Trypanosoma cruzi, respectivamente. En particular, el parásito T. brucei en la fase en que se encuentra en sangre incrementando periódicamente su número mientras es atacado por el sistema inmunológico de los enfermos, lo que hace que la cantidad de parásitos vuelva a disminuir, y entonces los tripanosomas cambien las moléculas que recubren su superficie para volver a incrementar su número, en lo que se llama parasitemias recurrentes, la energía que utilizan los tripanosomas la derivan exclusivamente de la glucosa de la sangre del huésped por medio de la glicólisis. Aunque los detalles del ciclo biológico de T. cruzi son diferentes de los de T. brucei, el primero también tiene fases sanguíneas y se supone que en algún momento de su interacción con el huésped genera su energía exclusivamente, o en forma muy importante, a partir de la glicólisis. La TIM es una de las enzimas de esa vía de la glicólisis, por lo que el estudio de las diferencias significativas entre las TIMs del ser humano y las de T. brucei y T. cruzi puede ayudar a encontrar moléculas que inactiven diferencialmente las enzimas de los parásitos sin inhibir, o sin inhibir tanto, la enzima de humano.
Este tipo de investigación puede, eventualmente, llevar a proponer una o más moléculas inhibidoras que sean especie-específicas para las TIMs de los tripanosomas y que puedan desarrollarse como posibles fármacos novedosos para tratar la enfermedad del sueño y la enfermedad de Chagas.
Las consecuencias del experimento fallido
El experimento fallido de yodación de la TIM de conejo y los subsecuentes experimentos del Dr. Gómez Puyou tuvieron, al menos, dos consecuencias importantes. La primera fue que Rafael cambió su tema de tesis y se concentró en estudiar a fondo las diferentes reacciones de inactivación por cloramina–T de las TIMs de conejo y levadura. Después de aquel experimento fallido, Rafael y yo nunca volvimos a intentar yodar ninguna TIM. De hecho, hasta hoy en día, no sabemos por qué la TIM de conejo reacciona tan mal con cloramina–T. La segunda fue que para el Dr. Gómez Puyou y para mí se abrió una línea de investigación muy interesante y relevante: el estudio de la inactivación diferencial de las TIMs. Poco a poco fuimos abandonando las líneas de investigación que habíamos tenido previamente, e iniciamos una colaboración que duró algo más de 20 años centrada principalmente en lograr inhibir las TIMs de los dos tripanosomas patógenos para el humano: T. brucei y T. cruzi. Esta colaboración me brindó un sinnúmero de oportunidades de pasar muchas horas con el Dr. Gómez Puyou, en las mejores y más interesantes discusiones científicas que he tenido en toda mi vida.Bibliografía
ZUBILLAGA, R.A., Pérez-Montfort, R. Gómez-Puyou, A. “Differential inactivation of rabbit and yeast triose phosphate isomerase. Effect of oxidations produced by chloramine-T”. Arch. Biochem. Biophys. 1994, 313(2): 328-336.COMENTARIOS
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
2013 Esta obra está bajo una licencia de Creative Commons 













