Revista Digital Universitaria ISSN: 1607 - 6079 | Publicación mensual
1 de enero de 2015 vol.16, No.1
• TEMA DEL MES •
Estructura, función y organización de las proteínas. Un Homenaje al Dr. Armando Gómez Puyou
La serendipia
Quisiera iniciar este artículo señalando que la publicación de mi primer trabajo en conjunto con el Dr. Armando Gómez Puyou y nuestro maestro, el Dr. Jesús Guzmán, referente al hecho de que la enzima glutamato deshidrogenasa tiene más actividad cuando se encuentra durante la reacción con fosfato de sodio, que con la misma sal de potasio (PEÑA et al., 1963) fue un hallazgo fortuito. Sucedió que mientras medía la actividad de esa enzima, utilizaba fosfato de potasio para mantener el pH del medio: todo estudioso de las enzimas debe saber que el pH de la reacción debe regularse para que las enzimas funcionen adecuadamente. Pero un buen día, en todo el Departamento de Bioquímica de la Facultad de Medicina, se terminó el fosfato de potasio; decidí entonces que no habría diferencia si utilizaba fosfato de sodio. La sorpresa fue que la actividad en esta sal era bastante mayor; completamos el dato con algunas medidas de la cinética de la enzima y lo publicamos.Pero este trabajo nos dejó con la inquietud de buscar algún sistema biológico adecuado para estudiar esta diferencia de comportamiento de la enzima frente al potasio y el sodio. Yo propuse estudiar la levadura; Armando decidió estudiarlo a través de la respuesta de las mitocondrias a un esteroide sintético, la triamcinolona, en presencia de sales de sodio o de potasio. Esto dio lugar a toda una serie de publicaciones interesantes, a las que no me referiré en este espacio.
El efecto del potasio en la levadura
Por mi parte, durante algún tiempo busqué un sistema que nos permitiera responder esa misma pregunta. Fue entonces cuando un trabajo publicado en una revista científica llamó mi atención. En él, se describía que la levadura de panadería, Saccharomyces cerevisiae, aceleraba la fermentación en presencia de potasio, pero no en presencia de sodio (ROTHSTEIN y DEMIS, 1953), lo que estaba íntimamente relacionado con nuestro hallazgo.Con dichos antecedentes, en 1965, planteé a nuestro maestro y jefe del Departamento de Bioquímica de la Facultad de Medicina, el Dr. José Laguna, mis intenciones de profundizar en este fenómeno, propuesta a la que accedió. Empezamos así algunos experimentos que quedaron plasmados en un trabajo sencillo, más bien descriptivo (PEÑA et al., 1967), en el que además de verificar los resultados de Rothstein -en el sentido de que la levadura fermentara mejor en presencia de iones de potasio que de sodio- encontramos que las células respondían mucho mejor si se les colectaba en una fase avanzada del crecimiento que en la fase temprana. La Figura 1 muestra en una gráfica de barras que la producción de alcohol es claramente mayor en presencia de la sal de potasio (KCl), que de sal de sodio (NaCl), y que la diferencia es más clara aun, si las células se colectan en la fase estacionaria, cuando la levadura ha dejado de crecer.
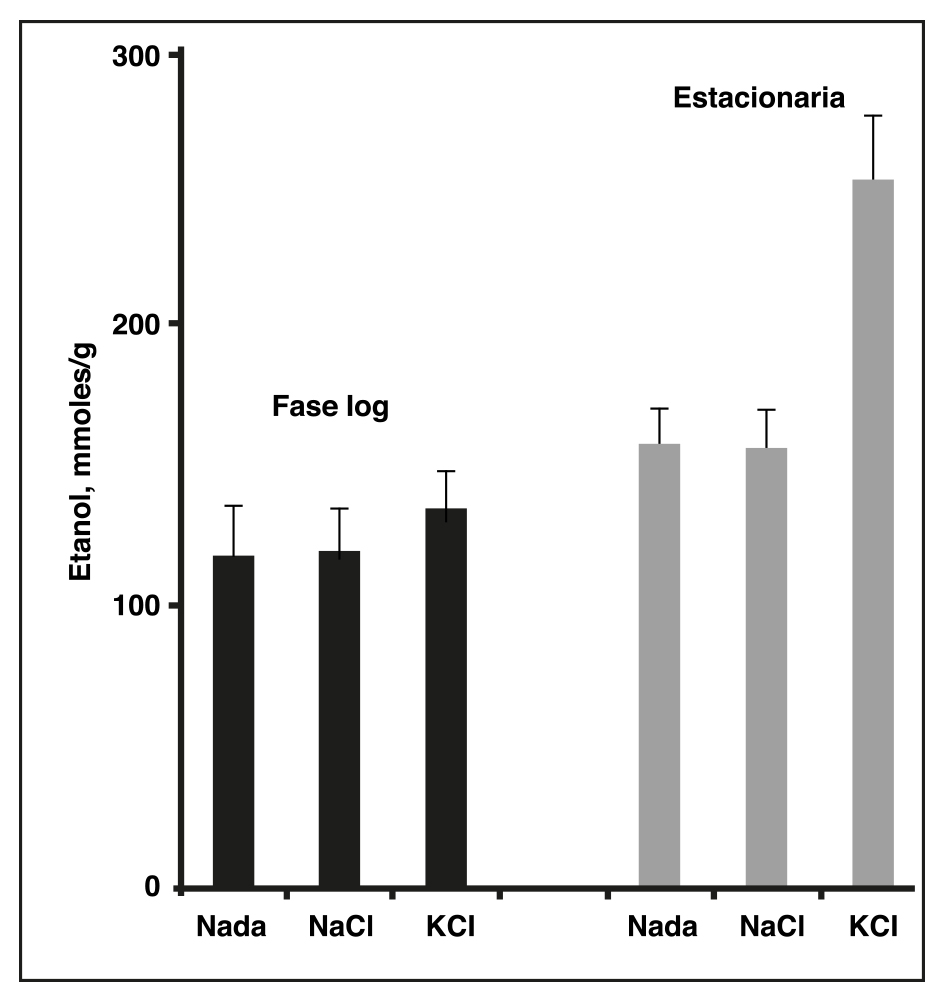
Figura 1. Comparación del etanol producido durante la fermentación de azúcar con S.cerevisiae para producir etanol en presencia de sodio y potasio, tanto en células cosechadas en la fase log, como células cosechadas en la fase estacionaria.
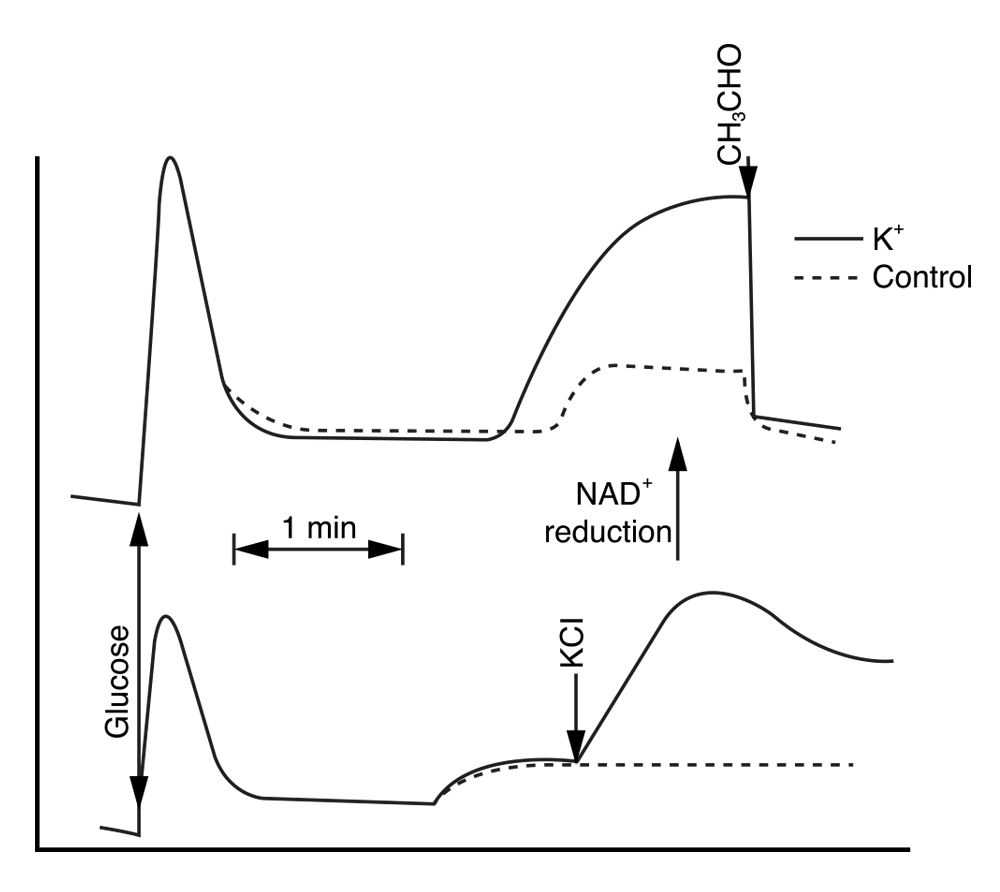
Con este sistema montado, iniciamos un análisis más cuidadoso de los cambios fisiológicos derivados de la presencia de potasio. Así, encontramos que los niveles de NADH (cofactor que se cuantifica a través de la fluorescencia que éste emite excitando la suspensión de células con luz de 340nm y recibiendo a 460 nm), cuando las células no tienen oxígeno en el medio de cultivo, aumentaba mucho más en presencia de potasio (KCl) en el medio, pero también que al agregarlo, después de alcanzada la anaerobiosis, producía un claro, rápido e importante aumento. Tal efecto, que se muestra en la siguiente figura, nos indicaba que una de las reacciones de la glucólisis se aceleraba al agregar potasio, pero también que el efecto era inmediato. Siguiendo la línea continua (con K+) puede verse que el nivel es más alto, pero también en la parte de abajo, que al agregarlo, el cambio es inmediato.
Después decidimos medir los cambios que ocurrían al agregar KCl (K+) en la concentración de algunos intermediarios de la que es probablemente la vía metabólica más importante de la levadura: la glucólisis. El resultado no pudo ser concluyente, ya que encontramos que si bien inmediatamente después de la adición de potasio ocurría una disminución en los niveles de algunos compuestos de la vía, había otros compuestos cuya concentración aumentaba.
Rothstein y Demis habían propuesto que el efecto del K+ podría deberse a que al entrar a las células producía la estimulación de algunas de las enzimas de la glucólisis. Sin embargo, nuestros estudios permitieron demostrar que no era así, debido a la rapidez de los cambios en concentración observados, ya que en tiempos tan cortos, era difícil suponer que el potasio pudiera aumentar significativamente al interior de la célula. Por esta razón, decidimos seguir en los mismos experimentos los niveles de ATP y ADP. Desafortunadamente, la técnica que usamos para su extracción y cuantificación, no nos permitió descifrar el mecanismo que daba lugar a los cambios observados.
Hasta ese momento, lo único que podíamos inferir era que la adición de iones K+ daba lugar a la aceleración de la vía glucolítica, específicamente a través del efecto de los iones en una de dos de las enzimas que al aumentar de actividad, daban lugar a niveles más elevados de NADH. Pero los cambios que observamos en los niveles de ATP y ADP no nos permitían llegar a conclusiones, a pesar de que sí observamos un ligero aumento en los niveles de fosfato al agregar el K+. Dichos cambios se resumen en la Figura 2, en la que se muestran en rojo los aumentos observados. En verde se muestra la variación en los niveles de ATP y el ADP obtenidas, pero dado que dichas mediciones, ahora sabemos, eran erróneas, no pudo obtenerse conclusión alguna.
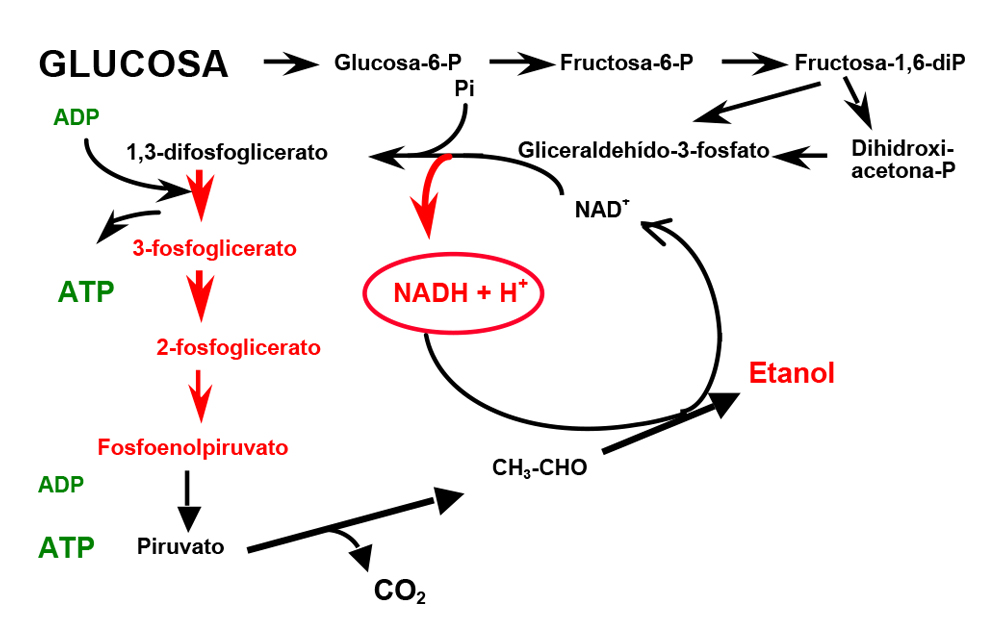
Figura 2. Cambios observados en los compuestos de la vía glucolítica de la levadura. En rojo se muestran los compuestos cuya concentración se modificó en presencia de potasio en el medio. En verde se muestra el ATP y el ADP derivado de la vía.
Tuvieron que pasar otros dos años más de trabajo, análisis e interpretación de datos, para que cayéramos en la cuenta de que había un error en la medición de los niveles de ATP y ADP del trabajo anterior. Tal consideración se debió en parte a que en otro experimento encontramos que el potasio también estimulaba la respiración (la fase aerobia del cultivo), pero que además, se obtenía el mismo efecto independientemente de si se utilizaba glucosa o etanol como sustrato para la respiración; también encontramos que este efecto ocurría inmediatamente y sin ningún retraso después de la adición del K+. Estos nuevos resultados fueron publicados en 1969 (PEÑA et al., 1969). Los trazos de la Figura 3 muestran la actividad respiratoria, que corresponde a la etapa durante la cual disminuye el oxígeno del medio en que se incuban las células.
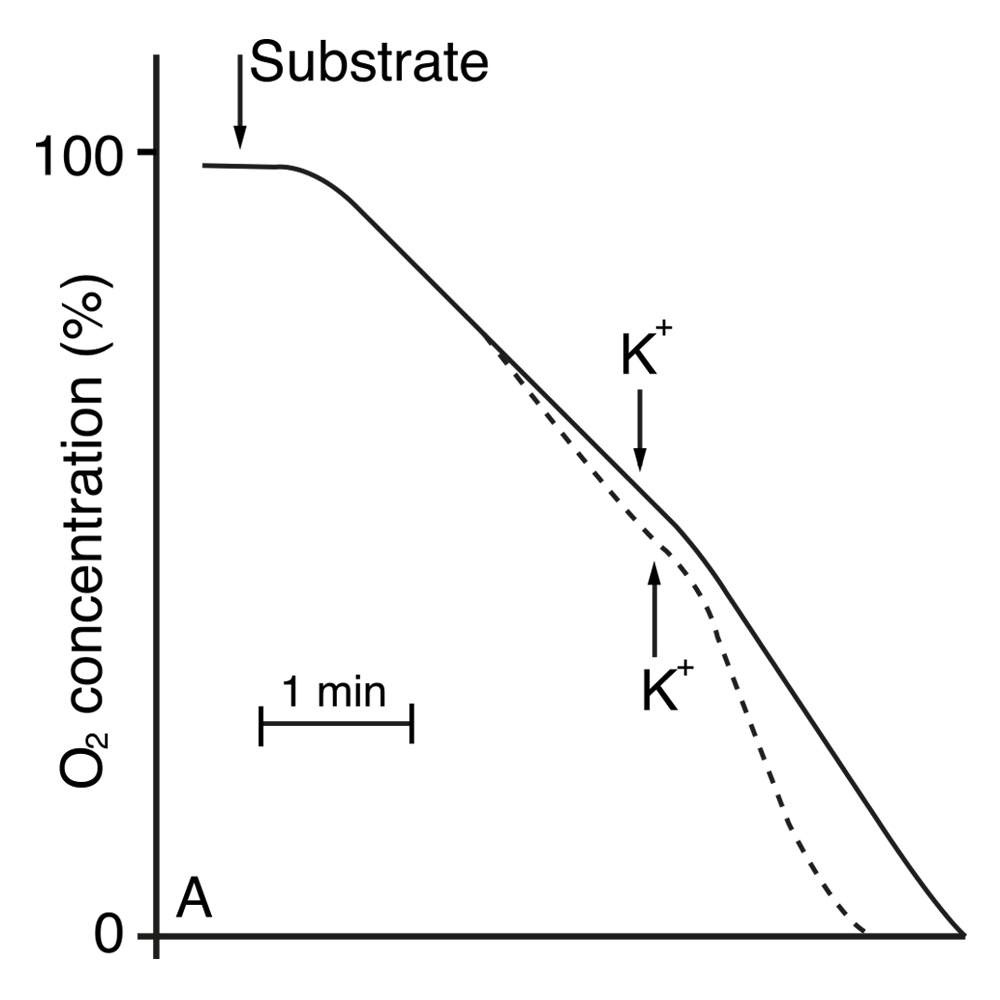
Figura 3. Actividad respiratoria de S. cerevisiae medida como el cambio en la concantración de oxígeno disuelto en el medio de cultivo. La línea continua representa la respiración en un medio con glucosa, mientras que la punteada en etanol.
Tal observación hacía difícil sostener la hipótesis de que el K+ debía entrar a las células para estimular la actividad de alguna enzima, pues los cambios observados eran inmediatos, y son muchas las enzimas que participan en los procesos de respiración y fermentación.
Fue entonces que comprendimos que estaban equivocados los resultados a partir de los cuales calculamos los cambios en las concentraciones de ATP y ADP, y que no tenían sentido. El error surgía en la concentración del ácido que habíamos utilizado en la extracción de estos nucleótidos. Sólo fue cuestión de aumentarla, así obtuvimos los resultados que se muestran en la Figura 4. En esta figura se pueden observar los cambios en los niveles de ATP y ADP que se producen segundos después de agregar el potasio (KCl), utilizando tanto etanol como butanol sustrato. Se constata claramente que en ambos casos el ATP disminuye y el ADP aumenta.
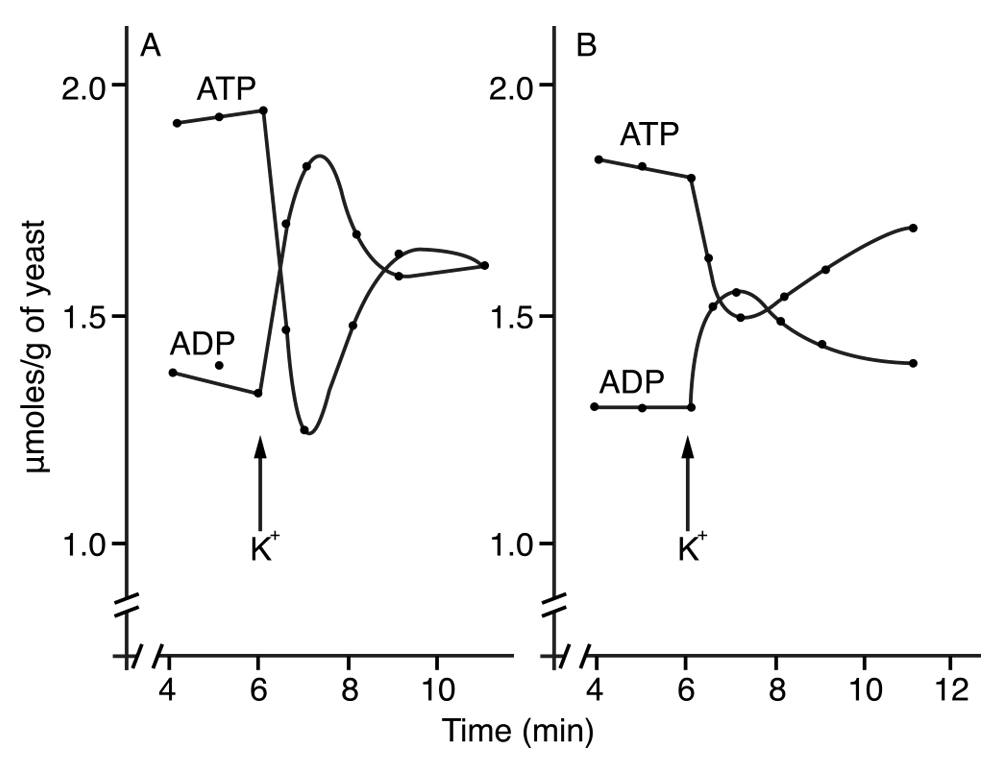
Figura 4. Cambios observados en los niveles de ATP y ADP que se producen segundos después de agregar iones potasio (KCl), en un cultivo aerobio de levadura utilizando etanol como sustrato. La flecha muestra el momento de adición. (A) Etanol como sustrato, (B) butanol como sustrato.
En otro experimento con glucosa como sustrato, los resultados mostraron que con este sustrato, aunque los cambios fueron semejantes, la magnitud del cambio fue notablemente menor, pero reproducible.
La presencia de una ATPasa
Una vez obtenidos estos resultados, el siguiente experimento era obvio: si baja el ATP y sube el ADP al agregar K+, lo más lógico era que al agregar el K+, se estimularía la enzima ATPasa, enzima que cataliza la reacción de hidrólisis del ATP:K+ ATP → ADP + Pi
Y en efecto, resultó que al agregar K+, constatamos que junto al ADP, aumentaba también la concentración del fosfato libre (Pi), el otro producto de la reacción (Figura 5) para tres diferentes fuentes de carbono: glucosa, etanol y butanol.

Figura 5. Cambios en la concentración de fosfato después de la adición de potasio (KCl) en la respiración de S. cerevisiae en presencia de A) butanol, B) etanol y C) glucosa como sustratos.
Sin embargo, aún había más: en el mismo trabajo, Rothstein y Demis reportaron que con sólo aumentar el pH del medio se estimulaba la fermentación, pero que con un pH más alto, la adición de iones K+ ya no tenía efecto. No obstante, en nuestro trabajo ya citado de 1969, también encontramos que al alcalinizar el medio aumentando el pH, se aceleraba la respiración, pero que en estas condiciones, la adición de iones K+ ya no tenía efecto (Figura 6).
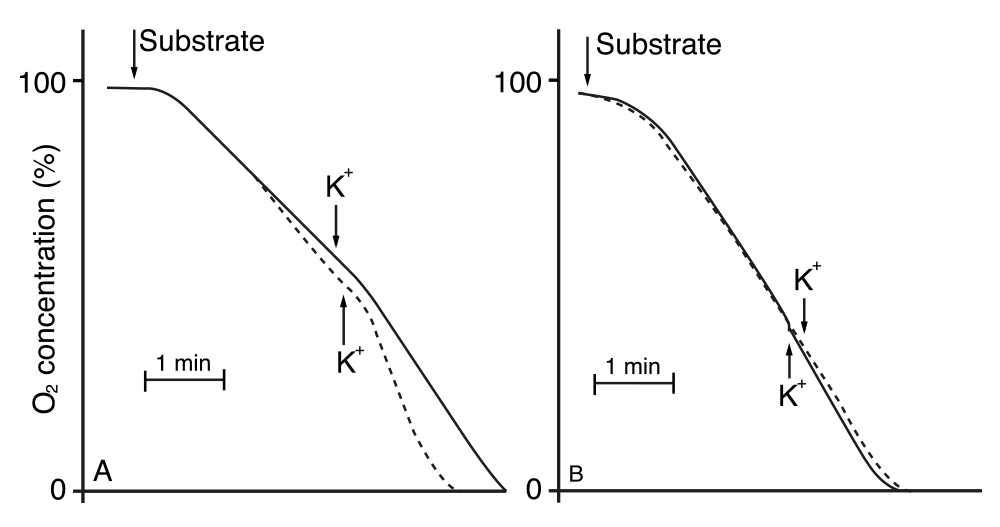
Figura 6. Efecto de la adición de iones potasio (KCl) sobre la velocidad de consumo de oxígeno realizada en presencia de glucosa A) pH=4.0, B) pH=7.5.
Si se analiza la velocidad del consumo de oxígeno en el experimento que se muestra en la Figura 6 A), realizado a pH 4.0, más ácido, puede observarse que el K+ claramente estimuló la respiración (línea punteada). Sin embargo, en la Figura 5 B), que muestra los resultados obtenidos a pH 7.5, se constata en primera que la respiración es más rápida, y en segunda que el K+ no estimula el consumo de oxígeno. La observación anterior nos llevó a medir los cambios del ATP y del ADP al agregar el K+ en células incubadas tanto a pH 4.0 como a pH 7.5.
En el nuevo experimento encontramos que los cambios de concentración del ATP y del ADP que tuvieron lugar al pH de 4.0, no se producían cuando las células se incubaban a pH 7.5.
Aunque era claro que la adición de K+ producía una disminución de los niveles de ATP y un aumento en los de ADP y fosfato inorgánico, que indicaba sin lugar a dudas que la adición del K+ estimulaba a una ATPasa, sólo nos atrevimos a postularla como la causa de la estimulación de la fermentación por la generación del ADP, que se requiere para el avance de las dos reacciones de la glucolisis siguientes:
1,3-bisfosfoglicerato + ADP → 3-fosfoglicerato + ATP
Fosfoenolpiruvato + ADP → Piruvato + ATP
No obstante, continuamos trabajando esta vez enfocados en los efectos del pH del medio sobre la fermentación y la respiración, que ya sabíamos se aceleraba al aumentarlo. Este trabajo se concretó a finales de 1971, y fue aceptado y publicado en 1972 (PEÑA et al., 1972).
Conociendo ya los efectos inmediatos de la adición del K+ sobre los niveles de los intermediarios de la glucólisis, procedimos a medirlos esta vez, antes y después de agregar una cantidad suficiente de una base orgánica para subir rápidamente el pH de 4.0 a 7.5. Fue una verdadera sorpresa encontrar que los cambios producidos por el aumento del pH eran prácticamente iguales a los observados al agregar K+ a este mismo pH inicial. Entusiasmados por los resultados, decidimos medir, también al cambiar el pH, los cambios de la fluorescencia del NADH. Nuevamente, los cambios eran semejantes a los observados con la presencia o la adición del K+. El cambio del pH de 4.0 a 7.5 producía un aumento de la fluorescencia (y los niveles) del NADH.
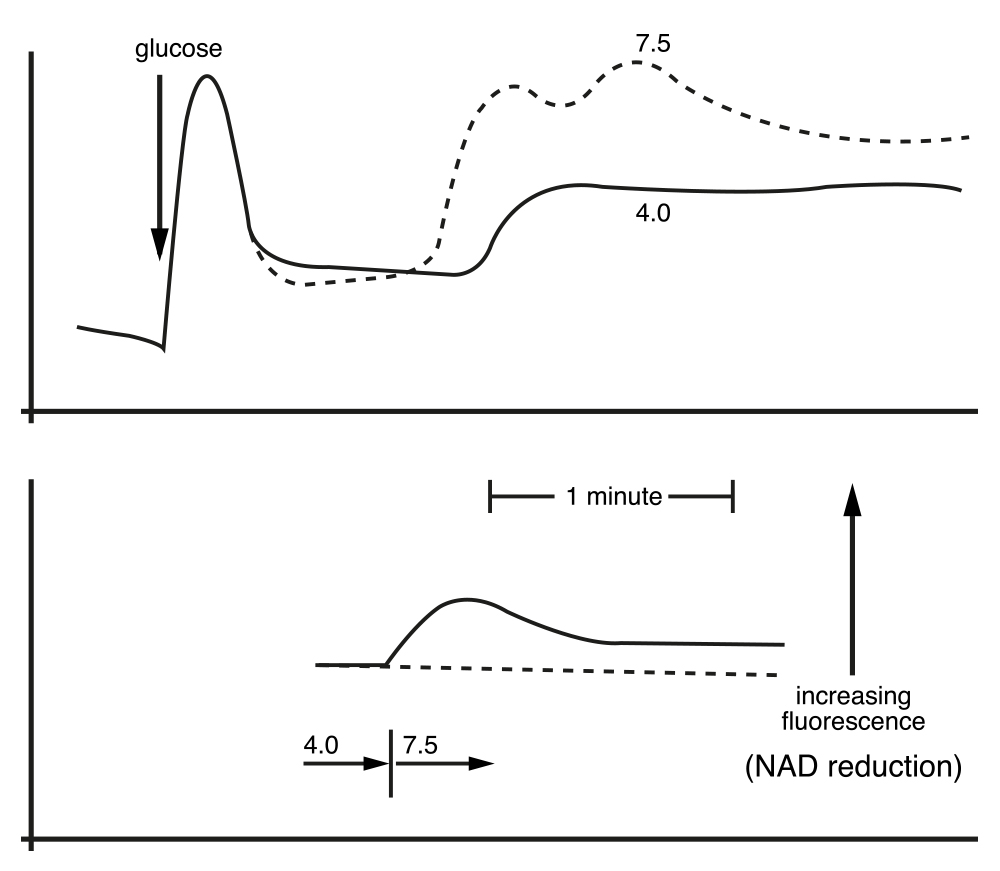
Figura 7. Cambios en la concentración de NADH durante la incubación de la levadura en glucosa al modificar con una base orgánica el pH del medio de 4 a 7.5.
El resultado antes mencionado nos llevó a medir los cambios resultantes del aumento del pH sobre los niveles de ATP y ADP, tanto con glucosa como con etanol como sustratos. Nuevamente, la sorpresa fue que al aumentar el pH aumentaba el ADP y disminuía el ATP, como lo muestra la Figura 8. Como puede constatarse en la figura, los cambios son similares a los obtenidos con la adición de K+, pero más claros cuando el sustrato es etanol.
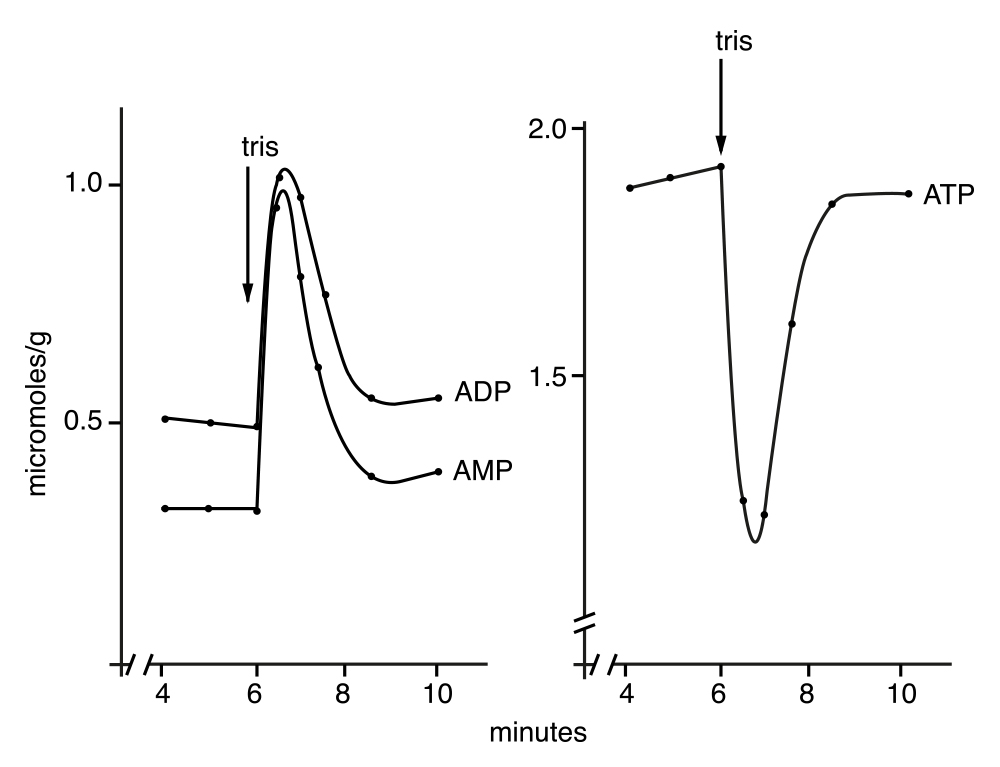
Figura 8. Cambios en la concentración de ATP, ADP y AMP durante el cultivo de levadura en etanol al modificar el pH con una base orgánica. No cabía duda ya, tanto la adición de K+ al incubar a pH bajo, como el simple aumento del pH, además de forma excluyente, producían la estimulación de una actividad de ATPasa.
La explicación y propuesta del mecanismo del transporte del K+ en la levadura
Desde mucho tiempo atrás era conocida la capacidad de S. cerevisiae, tanto para acidificar como para tomar K+ del medio con gran eficacia. De hecho, esta levadura debe su prevalencia sobre casi cualquier otro microorganismo en un medio azucarado, a que: a) puede acidificarlo hasta niveles muy bajos (pH de 3.0 o menor); b) que puede respirar, y por ello es capaz de consumir todo el oxígeno, volviendo el medio anaeróbico; pero además, c) ella misma no requiere de oxígeno para vivir, pues puede obtener toda su energía de la fermentación. Dado entonces que el medio es muy ácido y anaeróbico, la única que puede sobrevivir en él es la misma S. cerevisiae.Esta gran capacidad, tanto para acidificar como para tomar el K+ del medio, hizo suponer al grupo de Conway (1950) que existía un sistema en la levadura que se encargaba de intercambiar protones (H+) del interior de la célula por K+ del exterior. Además, consciente de que en el proceso se acumula una alta concentración de K+ en el interior, no sólo supuso que debería haber una fuente de energía para llevar a cabo el proceso, sino que, a través de una complicada serie de experimentos, propuso que la fuente de energía para este intercambio debería ser el potencial redox de la célula, es decir, el NADH.
Por otra parte, Jan Skou (1957) había encontrado que en el sistema nervioso había una ATPasa que se estimulaba por la presencia de distintos cationes, el Mg2+, que participa en las reacciones en que interviene el ATP, pero también el Na+ y el K+. Con el paso del tiempo se llegó a concluir que hay una proteína que no sólo es una enzima que rompe al ATP, sino que utilizando la energía de su hidrólisis se encarga de transportar al Na+ y al K+ a través de la membrana de las células animales.
Otro dato importante fue que unos años antes, Peter Mitchell propuso, y más tarde se demostró, que en las mitocondrias la cadena de transporte de electrones se encarga de expulsar protones hacia el exterior, generando una diferencia de potencial eléctrico y de concentración de protones, como había propuesto Conway para la levadura. También propuso que una enzima, también mitocondrial, que se había descrito como una ATPasa, no era precisamente hidrolítica, sino al contrario, podía ser impulsada por los protones (H+), que tendían a regresar al interior de la mitocondria, generando con la energía de ese regreso, la síntesis del ATP a partir de ADP y fosfato inorgánico (Pi). Más aun, propuso que esta ATPasa, ahora llamada ATP sintasa, podía ella misma, con la energía del ATP, expulsar protones al exterior; es decir, era una enzima a la que, si se le daba ATP, aun en ausencia de la respiración, podía expulsar protones. Este autor no sólo publicó su teoría, sino que escribió un libro sobre ella (MITCHELL, 1968).
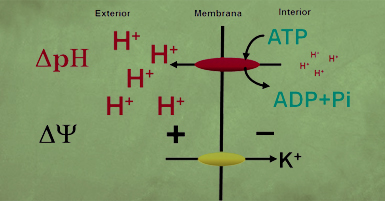
En esta etapa de nuestro trabajo, hubo una influencia importante de uno de nuestros colegas, Sergio Estrada, quien regresó de una estancia en la Universidad de Wisconsin, en los Estados Unidos, convencido de lo que entonces era sólo una teoría por parte de Mitchell. Fue la suya una influencia definitiva para que planteáramos un esquema según el cual existiría una enzima en la membrana plasmática, capaz de expulsar protones al exterior, utilizando, no la energía de óxido-reducción como había propuesto Conway, sino de la hidrólisis del ATP, como ilustra el esquema siguiente.
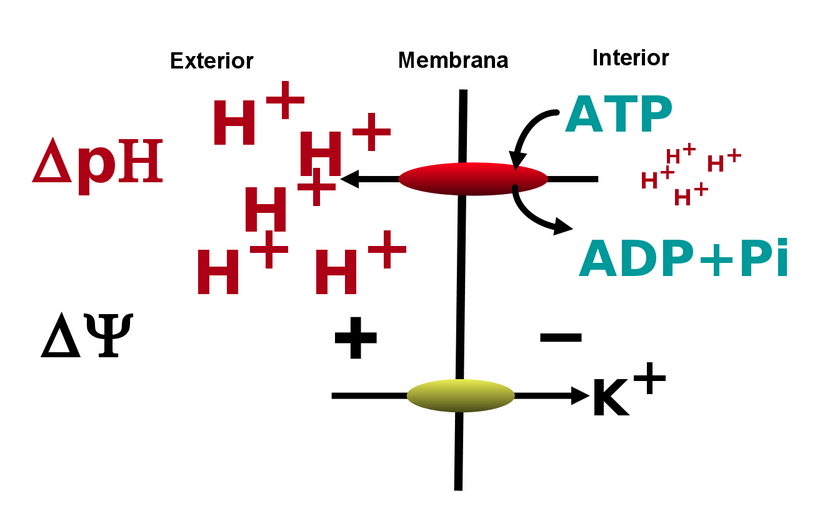
Las condiciones de su actividad serían las siguientes:
1. Debería estar en la membrana plasmática de la célula.
2. Debería funcionar poco a un pH bajo y estimularse a un pH alto.
3. Su actividad debería acidificar el medio externo, pero alcalinizar el interno.
4. Debería, por la expulsión de las cargas positivas de los protones, generar una diferencia de potencial, negativo en el interior y positivo en el exterior.
5. Esta diferencia de potencial impulsaría al K+ hacia el interior.
6. Dado que podía funcionar en ausencia de K+, sólo con aumentar el pH, los sistemas de bombeo de protones y del transporte del K+ deberían ser diferentes.
7. La presencia de K+, a valores bajos del pH estimularía la actividad de la ATPasa porque el catión al entrar neutralizaría parcialmente el potencial generado, "liberando", por así decirlo, a la ATPasa para facilitar una hidrólisis y producir más ADP.
8. Finalmente, dado que, ante un pH externo elevado, en presencia o ausencia de K+, o a un pH bajo en presencia del catión, se estimulaba la ATPasa, el ADP generado produciría la aceleración de la respiración o la fermentación.
Faltaba un experimento más. Dado que ya sabíamos que las células acidificaban el medio, debíamos demostrar que en las condiciones adecuadas el interior se alcalinizaba. Lo realizamos y confirmamos que, en efecto, el interior de las células se alcalinizaba bajo las siguientes condiciones:
1. Requería de la presencia de glucosa.
2. No se observaba a valores bajos del pH, a menos que se agregara K+.
3. Se producía ante valores altos del pH, independientemente de la presencia de K+.
Fue así que propusimos:
1. La existencia de una ATPasa encargada del bombeo de protones y de la capacidad de acidificar el medio, pero al mismo tiempo de generar una diferencia de potencial eléctrico a ambos lados de la membrana.
2. Otro sistema diferente para el transporte del K+, impulsado por la diferencia del potencial eléctrico entre el interior y el exterior de la membrana.
3. Algunos años más tarde, este esquema fue demostrado con mayores detalles, en el trabajo que fue tema de mi tesis doctoral (PEÑA, 1975).
Conclusiones y trascendencia del trabajo
Un año más tarde, el grupo de Carolyn Slayman encontró evidencias para proponer un mecanismo semejante para Neurospora crassa (SLAYMAN et al., 1973).
Ya en 1985, se demostró la existencia de un transportador de K+ a través de encontrar una mutante del mismo (RAMOS et al., 1985). Posteriormente, Ramón Serrano, en el laboratorio de Gerald Fink, aisló y secuenció el gen de la ATPasa (SERRANO et al., 1986), encontrando además que este gen es muy parecido a la ATPasa de Na+ y K+ y a la que bombea Ca2+ en las células animales.
Otros autores encontraron una actividad semejante en otras levaduras, en especial en Schizosaccharomyces pombe; el mecanismo se extendió también a muchos otros hongos, y finalmente a las plantas.
Hay varias revisiones que describen otras versiones sobre la manera en que se llegó a definir el mecanismo del transporte del K+ en los hongos y las plantas. Sin embargo, nosotros, es decir, Armando Gómez Puyou, Martietta Tuena y yo, gracias a una muy amable colaboración, adornada con la amistad que siempre nos unió, tuvimos la fortuna de ser los primeros en proponerlo, dejándolo suficientemente claro para el resto de los colegas del mundo.
Agradezco la amable revisión de este trabajo a mis colaboradoras Martha Calahorra y Norma Silvia Sánchez.
Bibliografía
CONWAY EJ., Brady TG., and Carton E. "Biological production of acid and alkali. II. A redox theory for the process in yeast with application to the production of gastric acidity", Biochemical Journal, 47:369-374, 1950.
MITCHELL P. Chemiosmotic coupling and energy transduction. Bodmin, Cornwal: Glynn Research Ltd. 1968.
PEÑA DÍAZ A., Gómez Puyou A., Guzmán J. "Effects of ions on the glutamic dehydrogenase reaction", Archives of Biochemistry and Biophysics, 100, 426 430, 1963.
PEÑA A., Cinco G., García A., Gómez Puyou A., Tuena M. "Effect of externally added sodium and potassium ions on the glycolytic sequence of Saccharomyces cerevisiae", Biochimica et Biophysica Acta, 148, 673 682, 1967.
PEÑA A., Cinco, G., Gómez-Puyou A., Tuena M. "Studies on the mechanism of the stimulation of glycolysis and respiration by K+ in Saccharomyces cerevisiae", Biochimica et Biophysica Acta, 180:1-8, 1969.
PEÑA A., Cinco G., Gómez-Puyou A., Tuena, M. "Effect of the pH of the incubation medium on glycolysis and respiration in Saccharomyces cerevisiae", Archives of Biochemistry and Biophysics, 153: 413-425, 1972.
PEÑA A. "Studies on the mechanism of K+ transport in yeast", Archives of Biochemistry and Biophysics, 167, 397 409, 1975.
SKOU JC. "The influence of some cations on an adenosine triphosphatase from peripheral nerves", Archives of Biochemistry and Biophysics, 23:394, 1957.
ROTHSTEIN A., Demis C. "The relationship of the cell surface to metabolism. The stimulation of fermentation by extracellular potassium", Archives of Biochemistry and Biophysics, 44:18-29, 1953.
RAMOS J., Contreras P., Rodríguez Navarro A. "A potassium transport mutant of Saccharomyces cerevisiae", Archives of Microbiology. 143:88-93, 1985.
SLAYMAN CW., Long WS, Lu CH. "The relationship between ATP and electrogenic pump in the plasma membrane of Neurospora crassa", The Journal of Membrane Biology, 14:305-338, 1973.
SERRANO R., Kielland-Brandt MC., Fink GR. "Yeast plasma membrane ATPase is essential for growth and has homology with (Na+ + K+), K+- and Ca2+-ATPases", Nature, 319:689-693, 1986.
COMENTARIOS
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
2013 Esta obra está bajo una licencia de Creative Commons