Revista Digital Universitaria ISSN: 1607 - 6079 | Publicación mensual
1 de enero de 2015 vol.16, No.1
• TEMA DEL MES •
Estructura, función y organización de las proteínas. Un homenaje al Dr. Armando Gómez Puyou.
Introducción
En 1987 llegué al laboratorio del Dr. Armando Gómez Puyou en el Instituto de Fisiología Celular de la UNAM para realizar mi trabajo de maestría bajo su dirección. El tema de investigación consistía en explorar las propiedades de las proteínas en sistemas no convencionales, un tema novedoso y diferente, ya que la mayoría de las investigaciones en las proteínas, a diferencia de la nuestra, se desarrollan en agua. Ese momento fue el inicio de una colaboración que duró más de doce años y que hasta la fecha ha marcado mi vida como investigadora, o mejor dicho, como experimentalista. El Dr. Gómez Puyou era un experimentador nato que siempre supo transmitir su pasión por la ciencia. En las siguientes líneas son descritos algunos de los hallazgos de nuestro trabajo en estos sistemas de micelas invertidas.Micelas invertidas
Los tensoactivos son moléculas anfifílicas, esto es, poseen en su estructura química dos grupos que difieren en sus relaciones de solubilidad: un grupo hidrofílico soluble en agua y un grupo lipofílico, soluble en hidrocarbonos y repelente al agua. Los jabones, los detergentes y los emulsificantes, entre otros, pertenecen a esta clase de compuestos, los cuales pueden ser de origen sintético o natural, como es el caso de los fosfolípidos y algunas proteínas (GRACIA, 2014).En disoluciones acuosas los tensoactivos pueden formar estructuras esféricas llamadas micelas en las que los grupos polares están en la superficie y las partes hidrocarbonadas se orientan hacia el centro de la micela formando un núcleo esférico. Esta disposición del tensoactivo elimina los contactos desfavorables entre el agua y las regiones hidrófobas, permitiendo la solvatación de los grupos polares. Un ejemplo muy común de este tipo de microemulsiones lo constituyen los jabones y detergentes que al contacto con el agua propician que las grasas de la suciedad queden atrapadas en el interior de las micelas y sean arrastradas por el agua. Otro caso son las lipoproteínas de la sangre que forman micelas para transportar los lípidos o grasas: en la superficie, una monocapa de fosfolípidos, colesterol y proteínas específicas forman la micela, mientras que el núcleo está formado por triacilgliceroles y ésteres de colesterol (Figura 1A).
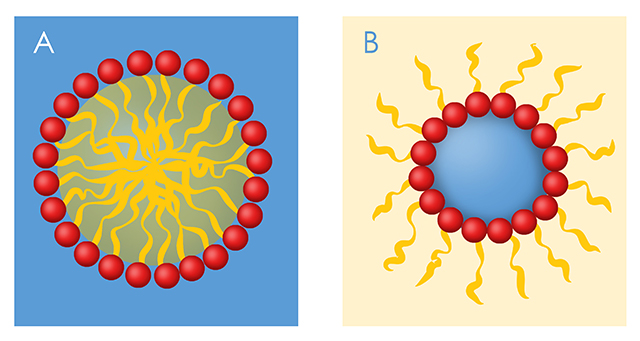
Figura 1. A) Micela formada en una disolución acuosa. Los grupos polares de las moléculas del tensoactivo (rojos) están en la superficie en contacto con la fase acuosa y las partes hidrocarbonadas (amarillas), se encuentran en el interior de la micela.
B) Micela invertida formada en un solvente orgánico apolar. Los grupos polares del tensoactivo se orientan en el interior acuoso, mientras que sus cadenas hidrofóbicas están en contacto con el disolvente apolar (externo).
Ahora bien, ¿qué sucede cuando las moléculas anfifílicas se dispersan en un disolvente orgánico de baja polaridad como el hexano, en vez de dispersarlas en un medio acuoso? Se forman micelas con una orientación invertida, ya que la región hidrocarbonada queda orientada hacia la fase orgánica mientras que los grupos polares se encuentran en el interior de la micela donde pueden interactuar con el agua. Éstas, llamadas micelas invertidas, son gotas esféricas de agua rodeadas por una monocapa de uno o más tensoactivos anfifílicos que se dispersan en el disolvente orgánico (Figura 1B). La adición de agua al sistema aumenta el número de agregación promedio y el tamaño del centro acuoso de la micela. Los cambios en la cantidad de agua y la temperatura alteran la forma micelar y su equilibrio múltiple. Esto hace que se consideren estructuras dinámicas, que pueden disociarse y asociarse rápidamente cuando se inducen cambios en las condiciones locales. Debido a la cantidad de agua que albergan, el diámetro de las micelas invertidas varía entre 10 y 200 nm, y pueden contener un número elevado de solutos, que incluyen macromoléculas como proteínas, ácidos nucleicos o incluso células completas.
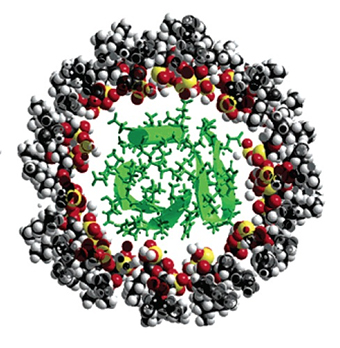
Figura 2. Representación de una proteína atrapada en una micela invertida de dioctilsulfosuccinato (AOT). Modelo molecular tridimensional de esferas llenas. Los átomos de carbono se muestran en negro, los hidrógenos en blanco, los oxígenos en rojo y los azufres en amarillo. En el interior acuoso está atrapada la proteína ubiquitina, que se muestra en verde (Tomada de Van Horn, W. D., Simorellis, A.K y Flynn, P. F. 2005. JACS 127, 13553-13560).
La transferencia de las proteínas al sistema es muy simple. La proteína deshidratada o muy concentrada en una solución acuosa, se mezcla directamente en una solución compuesta por el tensoactivo y el disolvente orgánico apolar. En condiciones definidas se puede obtener una solución ópticamente transparente, en la cual, la proteína se encuentra encapsulada en las micelas invertidas (Figura 2). El contenido de agua en la suspensión coloidal y, por consiguiente, la cantidad de agua que rodea a la proteína en la micela, se pueden modificar ampliamente. Otro aspecto interesante del sistema de micelas invertidas es la posibilidad de llevar a cabo catálisis enzimática en ellas. Esta reacción se produce cuando se mezclan micelas llenas de enzima con micelas llenas de sustrato, las cuales se fusionan y transfieren su contenido a otras.
Fueron estas propiedades únicas de las micelas invertidas las que aprovechamos para estudiar el papel del agua en la catálisis enzimática y en la estabilidad funcional y estructural de las proteínas.
Catálisis y termoestabilidad
Las enzimas son moléculas biológicas, capaces de aumentar la velocidad de las reacciones químicas, es decir, actúan como catalizadores. Las enzimas, como la mayoría de las proteínas, son estructuras dinámicas que vibran y fluctúan constantemente. Los movimientos internos que se llevan a cabo durante la catálisis sólo son posibles si las enzimas poseen cierta flexibilidad conformacional que al mismo tiempo les permita mantener su estructura tridimensional nativa y permanecer estable. Esta estructura nativa y funcional de las proteínas se mantiene gracias a la formación de innumerables interacciones no covalentes, como los puentes de hidrógeno, pares iónicos o interacciones de van der Waals. Estas interacciones se modifican como consecuencia de los movimientos que se dan durante la catálisis, los cuales, a su vez, se acompañan de rearreglos continuos de las moléculas de agua que interactúan con distintos grupos funcionales de la proteína. Por consiguiente, la solvatación es necesaria para que funcionen las proteínas, sin embargo, la misma, a temperaturas relativamente altas, provoca la desestabilización de los enlaces débiles que mantienen su estructura nativa funcional. Por lo tanto, inferimos que en un entorno con poca agua, como el de las micelas invertidas, las enzimas deben mostrar una alta resistencia a la desnaturalización térmica.Cuando me incorporé al grupo del Dr. Gómez-Puyou, él colaboraba con el Dr. Alberto Darszon, entonces en el CINVESTAV-IPN y ahora en el Instituto de Biotecnología-UNAM. El interés en el sistema de micelas invertidas estaba enfocado principalmente al estudio de enzimas de la membrana mitocondrial, el complejo de la citocromo oxidasa y la ATP sintasa1. La particularidad de estos estudios radicaba en el uso de fosfolípidos como agentes tensoactivos con el fin de entender más acerca del funcionamiento y el arreglo de estos complejos proteicos en un sistema que mimetizaba la interfase de una membrana biológica. La transferencia de estas proteínas de membrana a un solvente orgánico apolar, fosfolípidos y pequeñas cantidades de agua, se hizo en forma de complejos lípido-proteícos; ambas enzimas mostraron un incremento en su estabilidad térmica, la cual dependía del contenido de agua en el sistema.
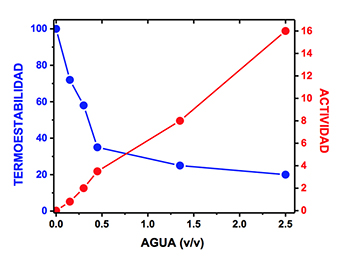
Figura 3. Relación entre la catálisis y la termoestabilidad de la F1-ATPasa mitocondrial en micelas invertidas de fosfolípidos y tolueno con diferentes cantidades de agua. La reacción de hidrólisis del ATP se inicia cuando el contenido de agua en las micelas alcanza un valor ≥ 0.15 % (v/v). A esa misma cantidad de agua la F1-ATPasa empieza a ser sensible a la desnaturalización a temperaturas altas, en este caso la incubación se realizó a 70 oC. Modificada de Garza-Ramos et al., 1989.
Las micelas formadas por fosfolípidos en tolueno podían albergar muy poca agua y fácilmente se salían de fase. Añadiendo el detergente no iónico, Triton X-100, como co-tensoactivo se observó que las micelas podían disolver mayor cantidad de agua y mantenerse estables a altas temperaturas. A éstas se les transfirió el sector F1 (hidrofílico) de la H+-ATPasa mitocondrial con diferentes cantidades de agua y se determinó su actividad y estabilidad térmica. El resultado probó que cuando se disminuye la cantidad de agua, a un porcentaje tal que la enzima es incapaz de catalizar la hidrólisis del ATP, se aumenta su termoestabilidad (Fig. 3). Al aumentar la cantidad de agua su actividad catalítica se incrementa a costa de disminuir su termoestabilidad (GARZA-RAMOS et al., 1989).
Se transfirieron muchas otras enzimas, membranales y solubles, como deshidrogenasas, cinasas e hidrolasas, a las micelas de fosfolípidos que contenían Tritón X-100 y se determinaron sus propiedades catalíticas y de estabilidad. De manera general observamos que las enzimas atrapadas en el interior de una micela invertida compuesta por fosfolípidos y cantidades limitadas de agua, muestran actividades muy bajas comparadas con las catalizadas en solución acuosa y temoestabilidad elevada. Esta relación inversa entre la catálisis enzimática y la termoestabilidad, puede explicarse en términos de rigidez o flexibilidad conformacional. En un espacio de agua limitante se restringen las interacciones entre la proteína y el solvente que la rodea, haciendo que la flexibilidad conformacional necesaria para llevar a cabo la catálisis disminuya. De igual manera, la alta estabilidad térmica es el resultado de las restricciones en la movilidad de las proteínas impuestas por un entorno con bajo contenido de agua.
1 Para más información, consultar el artículo “ATPasa”
Desamidación de la TIM
¿Qué es la desamidación de proteínas? Se trata de un proceso no-enzimático y espontáneo al cual están sometidas las proteínas en la célula y representa un ejemplo de modificación postraduccional asociada al envejecimiento celular. En la desamidación, se libera amonio de las cadenas laterales de los aminoácidos asparagina o glutamina (mediante una reacción hidrolítica, Figura 5), y los productos generados, el ácido aspártico o el ácido glutámico respectivamente, introducen cargas negativas en las proteínas que las desestabilizan, haciéndolas más susceptibles a degradación.Un ejemplo de este proceso se puede observar de forma directa como consecuencia del paso del tiempo en obras de arte antiguas. Entre los materiales que componen estos objetos, las sustancias de origen animal, usadas como adhesivos o recubrimientos, son las que están sujetas a fenómenos de degradación y envejecimiento. Los frescos del Camposanto Monumental de Pisa en Italia datan del siglo XVI. Durante la Segunda Guerra Mundial, una bomba incendiaria explotó sobre el cementerio y las pinturas de los murales se restauraron usando materiales adhesivos de origen animal, como las colas, preparadas a base de colágena de pieles, huesos y tendones, y de la caseína de la leche. Con los años se han ido perdiendo las propiedades adhesivas de dichas colas, y los frescos se han deteriorado nuevamente (Figura 4).

Figura 4. Frescos del Camposanto Monumental de Pisa en Italia (fotografías tomadas de http://www.esacademic.com/pictures/eswiki/66/Buonamico_Buffalmacco_001.jpg y http://iltirreno.gelocal.it/polopoly_fs/1.2945064!/httpImage/image.jpg_gen/derivatives/gallery_642/image.jpg).
En un esfuerzo por determinar las principales modificaciones químicas asociadas al envejecimiento de obras de arte, las pinturas de los murales del Camposanto se analizaron mediante técnicas de proteómica, con las que se identificó la desamidación de proteínas como una de las principales alteraciones que llevaron a su deterioro y envejecimiento en los últimos 65 años (LEO et al., 2011).
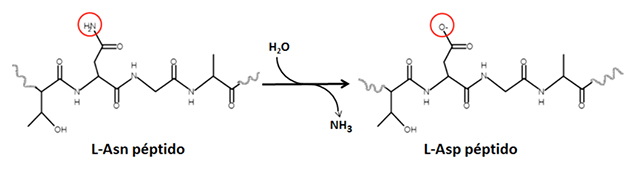
Figura 5. Reacción de desamidación. La desamidación es una reacción hidrolítica espontánea que se da en algunas proteínas, en la cual se libera amonio de las cadenas laterales de residuos de asparagina. El producto de la reacción es un residuo de ácido aspártico con carga negativa.
Aun cuando son varios los factores que pueden influir en la velocidad de reacción de desamidación de residuos de asparaginas y glutaminas en péptidos y proteínas, como el pH, la temperatura, la fuerza iónica, la secuencia de la estructura primaria de la proteína y su estructura tridimensional local, se ha propuesto este mecanismo como un cronómetro molecular del envejecimiento. La desamidación contribuye a controlar el recambio de las proteínas en la célula (las cuales están sujetas a una biosíntesis y degradación continua, proceso que se define como recambio proteico). En las células de tejidos envejecidos se acumulan formas desamidadas de algunas proteínas, entre las cuales destaca la triosafosfato isomerasa (TIM), una enzima de la glucólisis (vía metabólica mediante la cual las células oxidan la glucosa para obtener energía).
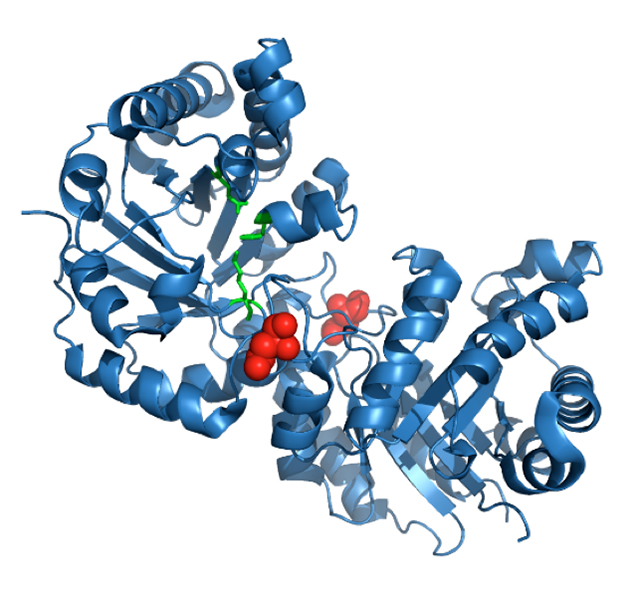
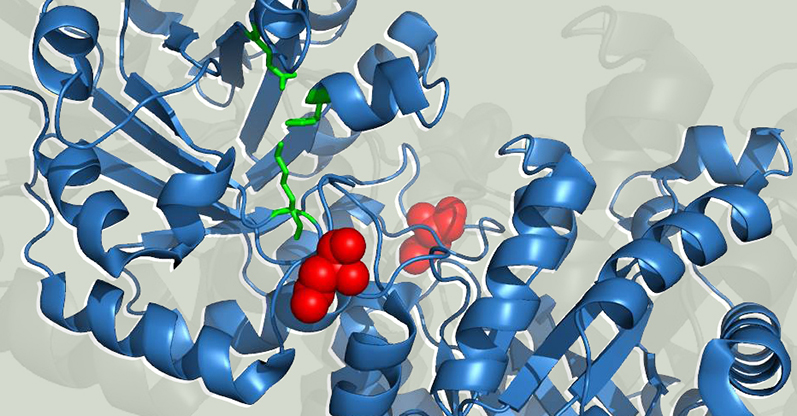
Figura 6. Estructura de la TIM de conejo. Se muestra la posición de la asparagina 71 (esferas en rojo) en la interfase de ambas subunidades. Los residuos del sitio activo están marcados en verde. El grupo del Dr. Robert W. Gracy, en la Universidad del Norte de Texas, estudió durante varios años el fenómeno de desamidación de la TIM de mamíferos. Los resultados de sus experimentos, tanto in vivo como in vitro, demostraron que la desamidación específica de una asparagina en la posición 71 es el evento que desencadena la degradación de la enzima. La TIM es un dímero de subunidades idénticas, mientras que la asparagina 71 (Asn71) forma parte de un asa que conecta a las dos subunidades (Figura 6), al desamidarse se introducen cargas negativas en la interfase entre subunidades que llevan al aumento en la disociación y la desnaturalización de las mismas. Los cambios conformacionales que se generan como producto de la desamidación afectan su actividad catalítica y aumentan la susceptibilidad de la enzima a la proteólisis específica.
Una de las aportaciones más importantes de estos estudios fue la demostración de que la desamidación específica de la Asn71 en la TIM se estimula por la unión del sustrato al sitio activo y la catálisis (SUN et al., 1986). El Dr. Gracy y su grupo propusieron que los cambios conformacionales inducidos por la catálisis se transmiten a la interfase del dímero donde se encuentra la Asn71. En cada ciclo catalítico este residuo se expone al solvente favoreciendo su desamidación. Es decir, en su funcionamiento natural la enzima se desgasta.
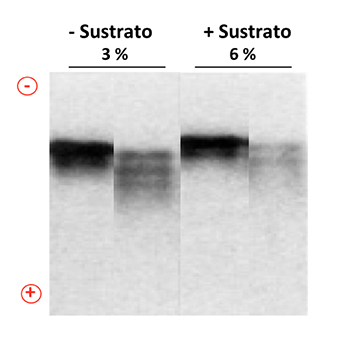
Figura 7. Desamidación de la TIM. Las formas desamidadas de la TIM se pueden observar mediante electroforesis en geles nativos. Las bandas que migran más cerca del polo positivo son las formas que por desamidación adquieren cargas negativas extras. En las micelas invertidas a 3 y 6 % de agua (v/v) el sustrato estimula la desamidación (se observan más bandas en presencia de sustrato). Modificada de Garza-Ramos et al., 1994. En colaboración con el grupo del Dr. Gracy, estudiamos la desamidación de la TIM de conejo en micelas invertidas. La enzima se transfirió al sistema micelar (formado por el detergente catiónico CTAB, hexanol y octano) con diferentes cantidades de agua para regular su velocidad catalítica y se cuantificó el grado de desamidación. Las micelas invertidas representaban el sistema ideal para hacer funcionar el ciclo catalítico de la TIM en cámara lenta e inducir un tiempo de permanencia más largo de la Asn71 expuesta al solvente, en una conformación favorable para desamidarse. Esta condición permitiría establecer la relación entre la velocidad de catálisis de la TIM y su desamidación.
Los resultados de estos experimentos mostraron que, a medida que la velocidad de catálisis disminuye por la reducción en el contenido de agua, la desamidación por ciclo catalítico aumenta (Figura 7). Esto implica que en el sistema micelar, los pasos del ciclo catalítico tienen un tiempo de vida más grande, por tanto, la velocidad de desamidación se relaciona con el tiempo en el cual la Asn71 se encuentra en una conformación o en un ambiente más favorable para desamidarse. Cuando el contenido de agua se redujo casi totalmente, condición en la cual disminuye la flexibilidad conformacional y la velocidad catalítica se hace extremadamente lenta, la TIM se “congela” en una conformación que no es susceptible a la desamidación. En esta misma condición la TIM presenta una elevada termoestabilidad, haciéndola resistente a la hidrólisis de los enlaces amida por altas temperaturas (GARZA-RAMOS et al., 1994).
Plegamiento y asociación de la TIM
La funcionalidad de las proteínas requiere de una estructura tridimensional específica, la forma nativa, que es la única con actividad biológica. El proceso mediante el cual una cadena polipeptídica adquiere la forma nativa se llama plegamiento. Los aminoácidos en las proteínas se enlazan por medio de uniones peptídicas en una secuencia lineal específica que está determinada por la información contenida en el DNA de los genomas. La cadena se pliega espontáneamente y se favorece la formación de interacciones no covalentes entre los distintos grupos químicos de los aminoácidos que conducen a la adquisición de la estructura tridimensional (Figura 8).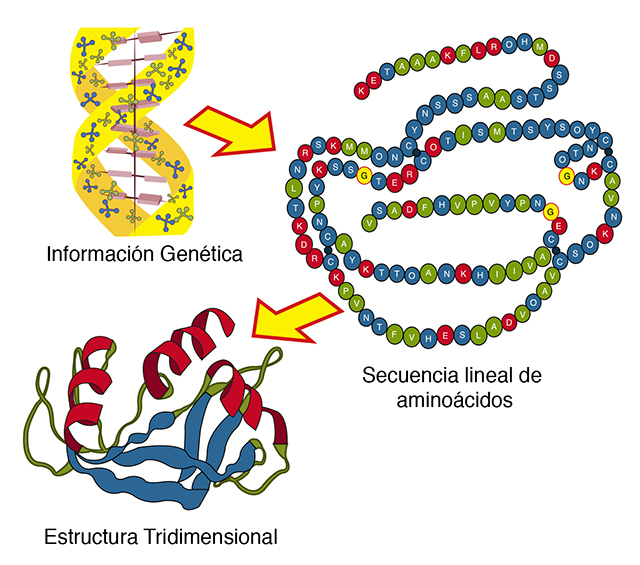
Figura 8. Plegamiento de proteínas. La información necesaria para especificar la estructura tridimensional nativa de una proteína está en la secuencia de aminoácidos, la cual está determinada por la secuencia de nucleótidos del DNA. La conformación nativa de una proteína se mantiene gracias a innumerables interacciones no covalentes entre los átomos de la proteína y entre éstos y el solvente que los rodea.
Estudiar el plegamiento de las proteínas ha llevado a entender en detalle los principios que dictan la formación de la estructura tridimensional y de ahí determinar el mecanismo de plegamiento. Esto es de particular interés debido a la notable característica de las proteínas que, a pesar del número astronómicamente grande de conformaciones posibles, adoptan sólo la conformación específica, la forma nativa.
El proceso de plegamiento puede estudiarse observando los cambios que se presentan en diferentes propiedades de la proteína, como sus características espectroscópicas o su actividad biológica. En general se ha encontrado que las estructuras plegadas de muchas proteínas son casi esféricas y muy compactas, mientras que en el estado desplegado presentan propiedades similares a un polipéptido extendido o random coil (Figura 9). Las diferencias en energía entre el estado nativo y el desnaturalizado se deben a un rearreglo entre los átomos de la proteína y el solvente acuoso. Durante el proceso de plegamiento las moléculas de agua se excluyen de la vecindad de los aminoácidos no polares. La desolvatación de estos residuos promueve la interacción entre ellos, su empaquetamiento y la formación de una estructura compacta.
Consideramos que estudiar el plegamiento de las proteínas en micelas invertidas nos permitirá determinar el efecto del agua y cuantificar cuánta agua se necesita para plegar de manera correcta una proteína. Con este fin se escogió la TIM de conejo, puesto que conocíamos bien cómo se comportaba dicha enzima en las micelas, y contábamos con datos en la literatura sobre su proceso de plegamiento en solución acuosa, los cuales nos servirían como referencia.
Como ya se mencionó, la TIM es una proteína oligomérica conformada por dos subunidades idénticas. Las proteínas oligoméricas adquieren sus propiedades funcionales cuando las subunidades plegadas se asocian entre ellas, en una estructura cuaternaria particular. Las proteínas diméricas como la TIM constituyen el modelo más sencillo para estudiar el plegamiento y asociación de proteínas oligoméricas. Los estudios del plegamiento in vitro de proteínas oligoméricas son complicados, debido a la tendencia que tienen las subunidades desplegadas o parcialmente plegadas de formar agregados no funcionales (Figura 9). La agregación es una reacción que compite fuertemente con las reacciones consecutivas de plegamiento y asociación entre las subunidades que llevan a las proteínas oligoméricas a su estado nativo. Si cada micela invertida atrapa un monómero desplegado de la TIM, manteniéndolos separados durante su replegamiento, se disminuirían las interacciones moleculares que conduce a la agregación favoreciendo la asociación de las subunidades correctamente plegadas.
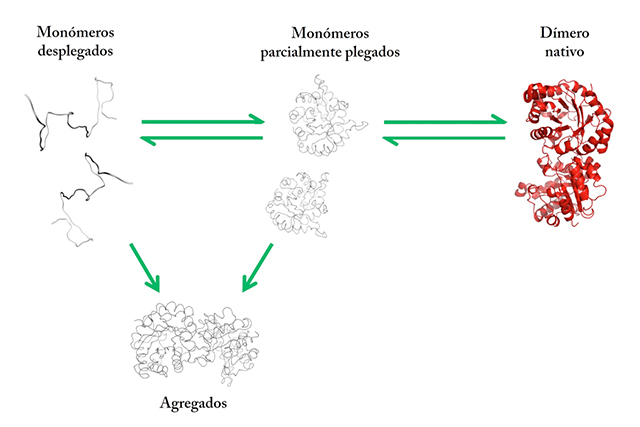
Figura 9. Esquema que representa la vía de plegamiento de la TIM. Los monómeros desplegados se renaturalizan en dos pasos. Primero se forman monómeros parcialmente plegados y en un segundo paso se asocian adquiriendo con ello la conformación nativa y funcional. Los monómeros parcialmente plegados pueden interaccionar dando lugar a agregados inactivos.
La TIM desnaturalizada y sin actividad catalítica se transfirió a micelas invertidas formadas con el detergente catiónico CTAB, hexanol y octano. En este paso de transferencia, los monómeros desnaturalizados de la TIM se distribuyen individualmente en una micela diluyendo hasta 100 veces el agente desnaturalizante. Después de 24 horas de incubación, se observó que la TIM recupera totalmente su actividad catalítica, esto es, la enzima en el sistema micelar fue capaz de plegarse y recuperar su conformación nativa.
La velocidad de reactivación es función de la concentración de proteína: a mayor concentración de proteína, menor velocidad de reactivación, indicando que en el sistema micelar, al igual que en un medio totalmente acuoso, la asociación entre subunidades es el paso limitante en el plegamiento de la TIM. La magnitud de la reactivación depende de la cantidad de proteína: al aumentar su concentración se incrementa la cantidad de enzima catalíticamente activa, lo cual sugiere que los monómeros se encuentran separados en las micelas. La velocidad de asociación y reactivación de la enzima depende del contenido de agua. La reactivación sigue un comportamiento de tipo sigmoidal en función del contenido de agua: a bajos porcentajes se recupera muy poco de la actividad debido a la formación inmediata de estructuras inactivas estables, a medida que se aumenta la cantidad de agua en la micela aumenta la población de enzima plegada y catalíticamente activa (Figura 10). Para que la vía de plegamiento avance hacia la formación de la estructura nativa de la TIM, se necesita agua en una cantidad suficiente para hidratar completamente a la proteína. A 3.6% de agua (v/v), el centro acuoso de la micela sin proteína puede albergar hasta 750 moléculas de agua (GARZA-RAMOS et al., 1992).
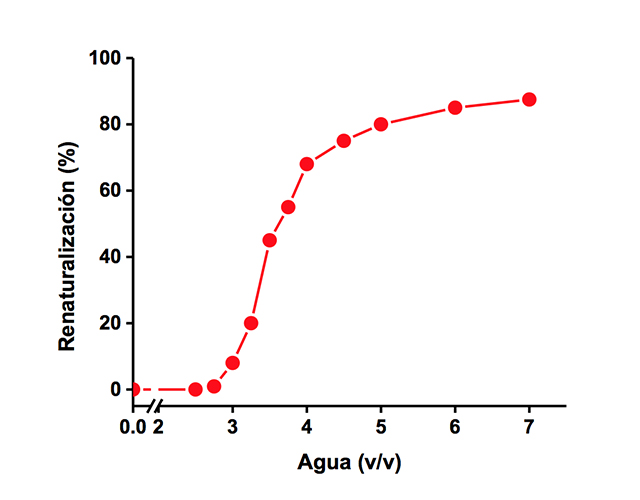
Figura 10. Efecto del agua en la renaturalización de la TIM atrapada en micelas invertidas. El plegamiento, medido como porcentaje de renaturalización, sigue un comportamiento de tipo sigmoidal en función del contenido de agua. La magnitud de renaturalización, incrementa al aumentar la cantidad de agua. Modificada de Garza-Ramos et al., 1992. Otro resultado importante fue el hallazgo de que el proceso de renaturalización en las micelas se lleva a cabo en rangos de tiempo de minutos, órdenes de magnitud mayor al tiempo de reactivación en agua. Esto, aunado al hecho de que la solución micelar es ópticamente transparente, abrió la posibilidad de utilizar métodos espectroscópicos para realizar la caracterización cinética y estructural, de los pasos intermedios en la formación de la estructura nativa y catalíticamente activa de la TIM (FERNÁNDEZ-VELASCO et al., 1995).
Cambiando la cantidad o las propiedades del agua en la que se coloca una enzima, demostramos que se pueden modificar sus propiedades catalíticas y estructurales. Tiempo después, sacamos a la TIM de las micelas, la regresamos al agua y continuamos estudiándola con un enfoque diferente. En colaboración con el Dr. Ruy Pérez-Montfort incursionamos en la caracterización de las TIMs de algunos organismos parásitos, con la idea de diseñar compuestos que las inhibieran de manera especie-específica. La TIM fue el tema de estudio del Dr. Gómez Puyou durante sus últimos años. Muchos de sus estudiantes nos formamos con ella, creando un grupo importante de “TIMólogos”. Sin duda, otro gran legado de nuestro querido y entrañable Doctor Puyou, como lo llamamos sus estudiantes, colaboradores y amigos.
Bibliografía
FERNÁNDEZ-VELASCO D.A. et al., “Water requirements in monomer folding and dimerization of triosephosphate isomerase in reverse micelles. Intrinsic fluorescence of conformers related to reactivation”, Biochemistry, 1995, 34, 361-369.
GARZA-RAMOS, G., Darszon, A., Tuena de Gómez-Puyou, M. and Gómez-Puyou, A. “Catalysis and thermostability of mitochondrial F1-ATPase in toluene-phospholipid-low-water systems”, Biochemistry, 1989, 28:3177-3182.
GARZA-RAMOS, G., Tuena de Gómez-Puyou, M., Gómez-Puyou, A. and Gracy, R. W. Deamidation of triosephosphate isomerase in reverse micelles: effect of water on catalysis and molecular wear and tear. Eur. J. Biochem 208, 389-395, 1992.
GARZA-RAMOS, G et al. “Dimerization and reactivation of triosephosphate isomerase in reverse micelles”, Biochemistry, 1994, 33, 6960-6965.
GRACIA, J. “¿Qué es la espuma?”, Revista Digital Universitaria. 2014, Vol. 15, No. 5.
LEO, G., et al. “Deamidation at asparagine and glutamine as a major modification upon deterioration/aging of proteinaceous binders in mural paintings”, Anal. Chem. 2011, 83:2056-2064.
REGLA, I., Vázquez Velez, E., Cuervo Amaya, D. H., Neri, A. C. “La química del jabón y algunas aplicaciones”, Revista Digital Universitaria. 2014, Vol. 15, No. 5.
SUN, A.-Q., Yüksel, K. Ü. and Gracy, R. W. “Interactions between the catalytic centers and subunit interface of triosephosphate isomerase probed by refolding, active-site modification, and subunit Exchange”, J. Biol. Chem. 1992, 267:20168-20174.
COMENTARIOS
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
2013 Esta obra está bajo una licencia de Creative Commons