Mangles al rescate: cómo estos árboles purifican ecosistemas costeros
Vol. 25, núm. 5 septiembre-octubre 2024
Mangles al rescate: cómo estos árboles purifican ecosistemas costeros
Victoria Sabrina Pérez Hernández, Olivia Guadalupe Millán Aguilar, Mercedes Marlenne Manzano Sarabia, Miguel Ángel Hurtado Oliva y Carmen Cristina Osuna Martínez CitaResumen
El acelerado crecimiento de la población humana en las últimas décadas ha llevado a un aumento en la tecnificación industrial, generando grandes cantidades de contaminantes, como aguas residuales, desechos sólidos y emisiones gaseosas. Estos contaminantes, al no recibir un tratamiento adecuado, pueden dañar el ambiente y la salud humana. Para mitigar estos efectos, se han desarrollado estrategias como la biorremediación, que emplea organismos como bacterias, hongos, algas y plantas para rehabilitar entornos contaminados por metales pesados, hidrocarburos, pesticidas y plásticos. Aunque no es una tecnología nueva, su continua actualización a través de la investigación y la incorporación de nuevos organismos específicos para cada ecosistema es crucial. Una estrategia prometedora es el uso de mangles, plantas altamente tolerantes a altas temperaturas y salinidad, que muestran un gran potencial en la biorremediación de ecosistemas costeros contaminados por metales pesados.
Palabras clave: biorremediación, contaminación, ecosistemas costeros, mangles, metales pesados.
Mangroves to the rescue: how these trees purify coastal ecosystems
Abstract
The rapid growth of the human population in recent decades has led to increase the industrial technology, generating large amounts of pollutants such as wastewater, solid waste, and gaseous emissions. These pollutants, if not properly treated, can harm the environment and human health. To mitigate these effects, strategies such as bioremediation have been developed, using organisms like bacteria, fungi, algae, and plants to rehabilitate environments contaminated with heavy metals, hydrocarbons, pesticides, and plastics. Although not a new technology, their continuous improvement through research and the incorporation of new organisms specific to each ecosystem is crucial. A promising strategy is the use of mangroves, plants highly tolerant to high temperatures and salinity, which show great bioremediation potential in coastal ecosystems polluted by heavy metals.
Keywords: bioremediation, coastal ecosystems, heavy metals, mangroves, pollution.
Introducción
Los metales pesados son elementos químicos que, debido a su alta densidad, están presentes en el ambiente de manera natural. Sin embargo, dependiendo de su concentración, pueden ser tanto esenciales como peligrosos. En bajas concentraciones, metales como el zinc (Zn), cobre (Cu), magnesio (Mg), hierro (Fe) y arsénico (As) juegan un papel crucial como micronutrientes, regulando procesos metabólicos vitales en plantas y animales (Cavada-Prado et al., 2022; Taboada, 2017).
Por otro lado, existe un grupo de metales pesados que representan un riesgo significativo para el medioambiente: el plomo (Pb), mercurio (Hg), cadmio (Cd) y cromo (Cr). Estos metales no se descomponen ni desaparecen con el tiempo; por el contrario, se acumulan en los organismos vivos y se vuelven más tóxicos a medida que avanzan por la cadena alimentaria, un proceso conocido como bioacumulación y biomagnificación (Lira et al., 2023).
La contaminación por metales pesados es una consecuencia directa de diversas actividades industriales como la minería, la metalurgia, la fabricación de plásticos y la agricultura. Estos procesos liberan desechos al ambiente, contaminando el aire, el suelo y el agua, lo que impacta negativamente a los organismos que dependen de estos recursos, incluidos los seres humanos. La exposición prolongada a estos metales a través del consumo de alimentos contaminados puede causar daños en los órganos e incluso desarrollar enfermedades como el cáncer (Rodríguez, 2017; Reyes et al., 2016).
Fitorremediación: una solución natural
Afortunadamente, la naturaleza ofrece una solución a este problema: la fitorremediación. Esta técnica utiliza plantas para absorber, acumular y, en algunos casos, degradar los contaminantes presentes en el suelo y el agua. Es una forma de biorremediación, donde ciertos organismos —como bacterias, algas y plantas— tienen la capacidad de reducir o eliminar compuestos tóxicos del ambiente (Cortón y Viale, 2006).
Una de las grandes ventajas de la fitorremediación es que es económica y amigable con el medio ambiente. Las plantas seleccionadas para esta tarea no sólo limpian el entorno, sino que lo hacen sin interrumpir los procesos naturales del ecosistema, lo que las convierte en una opción sostenible (Garzón et al., 2017).
Las plantas tienen adaptaciones fisiológicas que les permiten acumular contaminantes en sus raíces o traslocarlos (movimiento de nutrientes o compuestos dentro de su sistema) a otras partes como tallos, hojas o frutos. Esto ayuda a identificar qué especies son más eficaces para remediar distintos tipos de contaminantes, convirtiéndolas en herramientas valiosas para la restauración ambiental (Figura 1; Beltrán y Gómez, 2016).
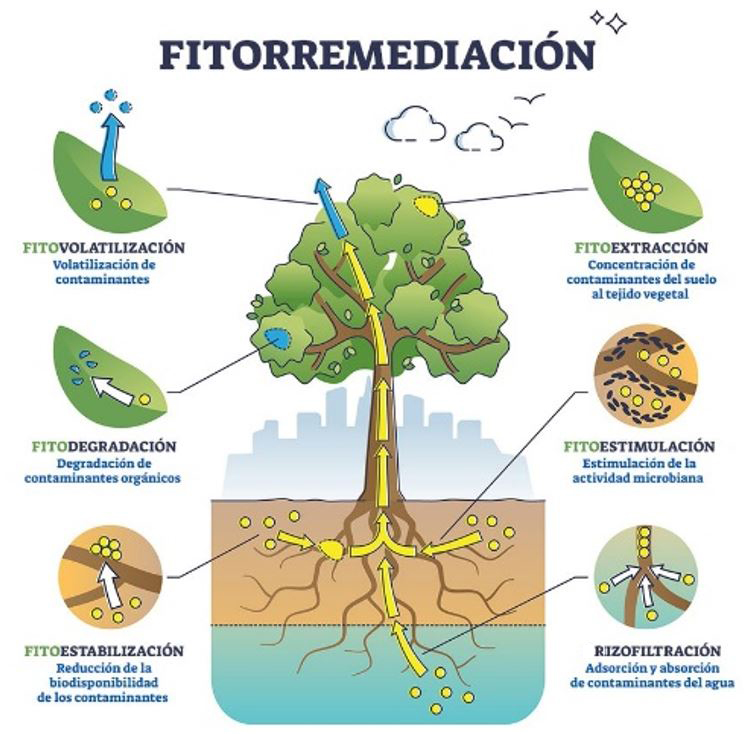
Figura 1. Proceso de fitorremediación y traslocación de contaminantes.
Crédito: Vector Mine (2023).
La elección de las plantas para fitorremediación se basa en su capacidad para tolerar y asimilar sustancias tóxicas, su velocidad de crecimiento, la profundidad de sus raíces y su habilidad para bioacumular y/o biodegradar contaminantes (Peña et al., 2013). Dependiendo de la planta, el tipo de metal al que esté expuesta y su concentración, las plantas pueden comportarse de manera diferente. Algunas son excluyentes, acumulando metales, principalmente en las hojas, mientras que otras, como las hiperacumuladoras, pueden extraer y acumular metales en niveles muy altos (Covarrubias y Peña, 2017).
Antes de implementar la fitorremediación, es crucial analizar factores como la tolerancia de la planta al metal, la concentración del metal en el entorno, el pH del suelo, el contenido de nutrientes y la materia orgánica disponible. Estos factores determinan la eficacia con la que las plantas pueden remover los metales del ambiente (Beltrán y Gómez, 2016).
Ejemplos de especies remediadoras
Algunos árboles tienen una sorprendente capacidad para limpiar su entorno, acumulando metales pesados en su organismo y aportando nutrientes al suelo. Aquí te presentamos algunos ejemplos destacados:
- Mezquite (Prosopis laevigata): Este árbol, común en zonas áridas y semiáridas, no sólo se adapta a suelos difíciles, sino que también puede remediar áreas contaminadas con metales. En Zimapán, Hidalgo, se ha visto cómo estos árboles no sólo sobreviven en suelos cargados de residuos mineros, sino que prosperan, acumulando plomo y cobre en sus hojas. Por esto, se considera una especie acumuladora de metales (Duarte et al., 2020).
- Guarumo (Cecropia peltata): En Colombia, el guarumo ha mostrado una notable capacidad para limpiar suelos contaminados con mercurio. En estudios de invernadero, esta especie fue capaz de eliminar entre un 15.7% y un 33.7% del mercurio presente en el suelo, sin sufrir efectos tóxicos significativos (Vidal et al., 2010).
- Álamos (Populus spp.): Los álamos son conocidos por su capacidad para reducir la toxicidad de metales como el cobre y el cadmio. Estudios genéticos han demostrado que estos árboles pueden absorber cobre e inhibir sus efectos dañinos mediante procesos celulares que atrapan los metales, reduciendo su toxicidad (Guerra et al., 2015).
- Mangle rojo (Rhizophora mangle): Este árbol, común en zonas costeras, puede absorber metales pesados como el plomo y movilizarlos desde las raíces hasta el tallo. En un experimento en invernadero, plántulas de mangle rojo expuestas al plomo durante un mes mostraron que eran capaces de absorber el metal sin afectar su capacidad de fotosíntesis o su crecimiento (Cabañas, 2014).
Contaminación por metales pesados en ecosistemas de manglar
Los ecosistemas costeros, como los de manglares, son áreas vitales donde la tierra y el mar se encuentran. Estos ambientes no sólo protegen las costas de huracanes e inundaciones, sino que también albergan una increíble diversidad biológica, sirviendo como refugio y lugar de crianza para muchas especies, algunas de importancia comercial. Además, los manglares proporcionan recursos esenciales para la vida sostenible, como la pesca, la acuicultura y materiales de construcción (legeepa, 2018; ramsar, 2022).
Sin embargo, estos ecosistemas están bajo amenaza debido a la contaminación por metales pesados. Las actividades industriales liberan grandes cantidades de estos metales, que son transportados por ríos y lluvias hasta lagunas costeras, donde se encuentran los manglares. Los metales son entonces absorbidos por microorganismos, plantas y animales, alterando la cadena alimentaria a través de la bioacumulación.1 Este proceso puede afectar la salud humana, ya que los metales tóxicos pueden llegar a nuestros cuerpos a través del consumo de alimentos contaminados (Cruz, 2013).
El mangle negro: un guardián contra los metales pesados
El mangle negro (Avicennia germinans) es un árbol que en general no excede 15m de altura, y cuenta con adaptaciones únicas que le permiten prosperar en suelos lodosos y ligeramente inundados. Una de sus características más notables son sus raíces aéreas, llamadas neumatóforos, que sobresalen del suelo y facilitan el intercambio gaseoso entre el árbol y el ambiente. Además, este árbol es resistente a la alta salinidad gracias a sus glándulas excretoras, que eliminan el exceso de sal (Figura 2). En México, se puede encontrar tanto en las costas del Golfo de México como en el Pacífico (conafor, 2023).

Figura 2. A) Mangle negro y B) Neumatóforos del mangle negro en el estero de Urías, Mazatlán, Sinaloa.
Crédito: elaboración propia.
Diversas investigaciones han demostrado que el mangle negro no sólo tolera la contaminación por metales pesados, sino que también juega un papel crucial en su remediación. Por ejemplo, un estudio realizado por Hernando y Gallo (1997) encontró altas concentraciones de cadmio (Cd), cobre (Cu) y zinc (Zn) en las hojas de esta especie, indicando su capacidad para remover e inmovilizar estos metales.
Además, se ha observado que el mangle negro puede almacenar grandes cantidades de hierro (Fe), magnesio (Mg) y zinc (Zn), que, aunque esenciales para las plantas, en altas concentraciones pueden ser tóxicos. También se ha reportado la acumulación de otros metales como cobre (Cu), aluminio (Al), plomo (Pb) y mercurio (Hg) en estos árboles (Mejías et al., 2013).
El potencial del mangle negro va más allá de los metales pesados. Investigaciones han explorado su uso en la recuperación de zonas afectadas por derrames de hidrocarburos. Por ejemplo, un estudio de Olguín et al. (2007) demostró que, con el apoyo de procesos de oxigenación y la adición de microorganismos, es posible promover el crecimiento de manglares negros en áreas contaminadas. De igual forma, Marín (2009) reportó que, a pesar del estrés y la reducción en el tamaño de las hojas, el mangle negro sometido a tratamientos con hidrocarburos continúa mostrando un crecimiento constante, confirmando su viabilidad en la recuperación de zonas afectadas por crudo.
Con su capacidad para absorber una amplia gama de metales y estabilizar otros contaminantes como el petróleo, el mangle negro se posiciona como una herramienta valiosa en los planes de manejo de ecosistemas de manglar contaminados (Figura 3).

Figura 3. Envés de una hoja del mangle negro, mostrando la formación y liberación de gránulos salinos a través de su sistema de glándulas excretoras de sal.
Crédito: elaboración propia.
Caso actual de estudio: metales pesados en el estero de Urías, Mazatlán, Sinaloa
El Estero de Urías, ubicado en el puerto de Mazatlán, es un humedal que abarca aproximadamente 700 hectáreas de manglares (Millán-Aguilar et al., 2019). Este ecosistema ha sido sometido a décadas de contaminación, recibiendo aguas residuales de diversas actividades industriales, pesqueras, acuícolas y del sector naval. Los daños acumulados en el estero han llevado a los investigadores a examinar la concentración de metales pesados en sus sedimentos, agua y en el material vegetal del mangle negro. Se analizaron cuatro sitios a lo largo del estero con el objetivo de evaluar el daño y explorar el uso del mangle negro como una posible solución para la biorremediación de estos ecosistemas. Los resultados preliminares son prometedores: el mangle negro muestra una notable capacidad para retener metales pesados en sus hojas y raíces, lo que sugiere su potencial como especie biorremediadora.
Conclusiones
Este caso subraya la gravedad de la contaminación y la pérdida continua de ecosistemas críticos. Por ello, es esencial seguir investigando y promoviendo la fitorremediación como una herramienta viable para la recuperación de estos ecosistemas. Las especies mencionadas anteriormente, con su capacidad para adaptarse y absorber contaminantes, representan una opción valiosa para la reforestación y restauración de áreas degradadas. Sin embargo, este esfuerzo no recae sólo en los científicos. Los sectores industriales, principales responsables de la generación de residuos contaminantes, junto con las autoridades gubernamentales, deben asumir su parte y hacer cumplir las normativas que regulan sus actividades.
Como sociedad, también podemos contribuir significativamente. Reducir nuestro impacto ambiental es posible si adoptamos hábitos más conscientes: antes de hacer una compra, pregúntate: ¿realmente lo necesito? Si la respuesta es no, considera opciones más sostenibles, como comprar ropa y calzado en bazares, reducir el consumo de carne, ahorrar energía eléctrica, consumir productos locales y, por supuesto, decir “NO” a los productos plásticos de un sólo uso. Cada pequeña acción cuenta y juntos podemos reducir la basura que generamos y minimizar nuestro impacto en el planeta.
Referencias
- Beltrán, P. M. E., y Gómez, R. A. M. (2016). Biorremediación de metales pesados cadmio (Cd), cromo (Cr) y mercurio (Hg) mecanismos bioquímicos e ingeniería genética: Una revisión. Revista Facultad de Ciencias Básicas, 12(2), 172-197. https://doi.org/10.18359/rfcb.2027.
- Cabañas, M. M. F. (2014). Efectos fisiológicos, morfológicos y bioquímicos de la exposición al plomo en las especies Avicennia germinans, Laguncularia racemosa y Rhizophora mangle [Tesis de maestría, Centro de Investigación Científica de Yucatán, a.c.]. cicy. https://cicy.repositorioinstitucional.mx/jspui/handle/1003/997.
- Cavada, P. K. A., Gonzáles, S. C. S., y Alanís, R. E. (2022). Biorremediación de metales pesados en México: Técnicas y tendencias de uso para aplicación en actividades mineras. e-cucba, 17. https://doi.org/10.32870/ecucba.vi17.205.
- Comisión Nacional Forestal [conafor]. (2023). Paquetes tecnológicos: Avicennia germinans (L.). http://www.conafor.gob.mx:8080/documentos/docs/13/888Avicennia%20germinans.pdf.
- Covarrubias, S. A., y Peña, C. J. J. (2017). Contaminación ambiental por metales pesados en México: Problemática y estrategias de fitorremediación. Revista Internacional de Contaminación Ambiental, 33, 7-21. https://doi.org/10.20937/RICA.2017.33.esp01.01.
- Cruz Casanova. F. E. (2013). Efecto de la contaminación por metales pesados en los ecosistemas costeros del suroeste de México. Kuxulkab, 37, 65-68. https://doi.org/10.19136/kuxulkab.a19n37.351.
- Duarte, Z. V. M., Pérez, H. V. S., Hernández, A. E., y Villanueva, M. A. (2020). Estudio exploratorio de la acumulación de plomo y cobre en Prosopis laevigata en depósitos mineros. Ecosistemas y Recursos Agropecuarios, 7(2), e2311. https://www.scielo.org.mx/pdf/era/v7n2/2007-901X-era-7-02-00011.pdf.
- Garzón, J. M., Rodríguez-Miranda, J. P., y Hernández-Gómez, C. (2017). Aporte de la biorremediación para solucionar problemas de contaminación y su relación con el desarrollo sostenible. Revista Universidad de la Salud, 19(2), 309-318. https://doi.org/10.22267/rus.171902.93.
- Guerra, F. P., Reyes, L., Vergara-Jaque, A., Campos-Hernández, C., Gutiérrez, A., Pérez-Díaz, J., Pérez-Díaz, R., Blaudez, B., y Ruíz-Lara, S. (2015). Populus deltoides Kunitz trypsin inhibitor 3 confers metal tolerance and binds copper, revealing a new defensive role against heavy metal stress. Environmental and Experimental Botany, 115, 28–37. https://doi.org/10.1016/j.envexpbot.2015.02.005.
- Hernando, C. N., y Gallo, M. C. (1997). Contenido de Cd, Cu y Zn en Rhizophora mangle y Avicennia germinans de la ciénega grande de Santa Marta y bahía del Chengue, costa Caribe Colombia. Revista de la Academia Colombiana, 21(79), 73-90. https://doi.org/10.18257/raccefyn.21(79).1997.2957.
- Ley General del Equilibrio Ecológico y Protección al Ambiente [lgeepa]. (2018). Decreto, artículo 3º, xiii bis. Se reforman y adicionan diversas disposiciones de la ley general del equilibrio ecológico y la protección al ambiente. Secretaría de Gobernación.
- Lira-Lerma, G., Escobar-Sánchez, O., y Hurtado-Oliva, M. A. (2023). Metales pesados: ¿Qué son y cuál es su impacto ecológico y en el consumo humano de tiburones y rayas? Ciencia y Mar, Universidad del Mar, 27(81). http://www.cienciaymar.mx/Revista/index.php/cienciaymar/issue/view/83/CYM810300.
- Marín, R. (2009). Efecto de la frecuencia de inundación y adición de nutrientes en la degradación de hidrocarburos en microcosmos de manglares [Tesis de maestría, Universidad Veracruzana]. https://cdigital.uv.mx/bitstream/handle/123456789/42106/MarinMunozJoseLuis.pdf?sequence=2&isAllowed=y.
- Mejías, C. L., Musa, J. C., y Otero, J. (2013). Exploratory evaluation of retranslocation and bioconcentration of heavy metals in three species of mangrove at Las Cucharillas Marsh, Puerto Rico. The Journal of Tropical Life Science, 3(1), 14-22. https://jtrolis.ub.ac.id/index.php/jtrolis/article/view/69.
- Millán, A. O. G., Nettel, H. A., Hurtado, O. M. Á., Dodd, R. S., Flores, C. F., y Manzano, S. M. M. (2019). Landscape metrics and conservation status of five mangrove wetlands in the Eastern Gulf of California Margin. Journal of Coastal Research, 36(1), 94–102. https://doi.org/10.2112/jcoastres-d-18-00060.1.
- Olguín, E. J., Hernández, M. E., y Sánchez-Galván, G. (2007). Contaminación de manglares por hidrocarburos y estrategias de biorremediación, fitorremediación y restauración. Revista Internacional de Contaminación Ambiental, 23(3), 139-154. https://www.revistascca.unam.mx/rica/index.php/rica/article/view/21641.
- Peña, S. E. J., Madera, P. C. A., Sánchez, J. M., y Medina, V. J. (2013). Bioprospección de plantas nativas para su uso en procesos de biorremediación: Caso Helicona psittacorum (Heliconiaceae). Revista de la Academia Colombiana de Ciencias, 37(145), 469-481.
- ramsar. (2022). La Convención de Ramsar: ¿De qué trata? [Ficha informativa]. https://www.ramsar.org/sites/default/files/fs_6_ramsar_convention_sp_0.pdf.
- Reyes, Y. C., Vergara, I., Torres, O. E., Díaz-Lagos, M., y González, E. E. (2016). Contaminación por metales pesados: Implicaciones en salud, ambiente y seguridad alimentaria. Revista Ingeniería Investigación y Desarrollo, 16(2), 66-77. https://doi.org/10.19053/1900771X.v16.n2.2016.5447.
- Rodríguez, H. D. (2017). Intoxicación ocupacional por metales pesados. Revista Médica de Santiago de Cuba, 21, 3372-3385. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1029-30192017001200012.
- Taboada, L. N. (2017). El zinc y el cobre: Micronutrientes esenciales para la salud humana. Acta Médica del Centro, 11, 79-89. https://www.medigraphic.com/pdfs/medicadelcentro/mec-2017/mec172n.pdf.
- VectorMine. (2023). Fitorremediación como enfoque basado en plantas para el diagrama de esquema de biorremediación.
- Vidal, D. J. V., Marrugo, N. J. L., Jaramillo, C. B., y Pérez, C. L. M. (2010). Remediación de suelos contaminados con mercurio utilizando guarumo (Cecropia peltata). Ingeniería y Desarrollo, 27, 113-129. https://rcientificas.uninorte.edu.co/index.php/ingenieria/article/view/870.
Recepción: 20/6/2023. Aprobación: 19/03/2024.


