Vol. 23, núm. 2 marzo-abril 2022
De ciudades, conservación y roedores: San Cristóbal de las Casas
Gloria Tapia-Ramírez, Consuelo Lorenzo, Óscar Retana y Arturo Carrillo-Reyes CitaResumen
La mitad de la población humana vive en alguna de las muchas ciudades del mundo. La tendencia apunta a que cada vez habrá más gente que habite en alguna ciudad ya existente, o en proceso de transformación. Se pronostica que para 2030, seis de cada diez mexicanos vivirán en una ciudad, lo que traerá diversas implicaciones en la fauna, los ecosistemas y la salud humana. Esta investigación describe el caso de San Cristóbal de Las Casas, en Chiapas, una ciudad mediana que ha pasado en poco tiempo de la ruralidad a la urbanización de manera acelerada. Nuestro objetivo fue evaluar la respuesta de la comunidad de roedores a la urbanización, desde la perspectiva de la ecología del paisaje. De manera paralela, buscamos entender el papel de los paisajes naturales y conservados que rodean el área urbana, en el mantenimiento de altas diversidades de roedores. Encontramos que, si bien los paisajes mejor conservados no son los más diversos, sí poseen especies que no se encuentran en paisajes intermedios o urbanos, aún cuando están sometidos a una alta presión antropogénica.
Palabras clave: ecología, paisajes, roedores, urbanización, zoonosis.
Of cities, conservation and rodents: San Cristóbal de las Casas
Abstract
Currently, more than half-worldwide population is living in a city. This present tendency is increasing. In this way, in a few years, even more people will inhabit in an exist or developing city. Predictions are that in 2030 six of ten Mexicans will live in a city, which will have consequences to the fauna, ecosystems, and human health. This research project is about a medium-sized city in Chiapas, named San Cristobal de las Casas, that has experienced an accelerated urbanization process in a short period. The overall goal was to evaluate the rodent’s response to the urbanization, from the landscape ecology approach. At the same time, we have investigated the role of natural and preserved landscapes in maintaining high diversities of rodent species. We found that preserved areas are not the most diverse areas; nevertheless, they maintain high abundance of rodent species that have not been found in other landscapes in San Cristobal de las Casas. In conclusion, these landscapes are under big anthropogenic pressure.
Keywords: ecology, landscapes, rodents, urbanization, zoonosis.
Las ciudades en el mundo y sus efectos sobre la biodiversidad
Actualmente, en el mundo hay más de 7.8 mil millones de personas. Más de la mitad vive en alguna de las 500 grandes ciudades del planeta (onu-Habitat, 2021). Se espera que para 2035, 62.5% de la población viva en alguna ciudad. En México, se pronostica que para el 2030, seis de cada diez mexicanos vivirán en una ciudad (Almejo et al., 2014).
Las ciudades representan un sueño de bonanza y estabilidad de las poblaciones rurales, pues ofrecen infraestructura inmobiliaria, servicios públicos como transporte, hospitales, comercio y acceso a la cultura, beneficios que muchas veces no tienen las localidades rurales. Sin embargo, el establecimiento de estas urbes trae consigo la modificación, en algunos casos irreversible, de bosques, selvas, u otro ecosistema donde se asienten. A veces, esta modificación conduce a la extirpación de flora y fauna nativas (McKinney, 2006) o favorece la presencia e incremento de poblaciones de especies de fauna silvestre no nativas, es decir, no originarias del sitio en cuestión, que se adaptan fácilmente a las condiciones urbanas.
Con condiciones urbanas nos referimos a la forma en la que las ciudades están organizadas o configuradas espacialmente. Una configuración ideal es aquella que cuenta con diferentes secciones destinadas a la vivienda, a la industria, a las áreas verdes y a la conservación, y donde éstas no se mezclan. Sin embargo, una configuración ideal depende de las regulaciones existentes, que deberían ordenar el crecimiento de las ciudades, y garantizar el bienestar humano y la permanencia de los ecosistemas naturales que las rodean.
¿Por qué es necesario preservar los ecosistemas que rodean a las ciudades?
Los ecosistemas conservados, dígase bosques o selvas, por mencionar algunos, no sólo preservan a las plantas que los constituyen, sino también a los animales que viven ahí. Estos ecosistemas conservados prestan servicios a la población humana cercana, como lo son la provisión de agua, la polinización y la oportunidad de tener espacios bellos para la contemplación.
Algunos investigadores han establecido que los ecosistemas en buen estado podrían ayudar a preservar la salud humana, pues contribuyen a que los patógenos zoonóticos (microorganismos como bacterias, virus u hongos que podrían ocasionar enfermedades en seres humanos, sí pasaran de animales al hombre) se queden circulando entre los animales silvestres y no entren en contacto con las poblaciones humanas. De esta manera, se podría evitar un futuro brote epidemiológico debido a una enfermedad infecciosa, como la covid-19, ocasionada por el sars-CoV2, que ahora aqueja a la humanidad.
¿Y qué pasa si no conservamos? En este caso, las ciudades van extendiéndose (proceso de urbanización) hasta abarcar grandes áreas donde sólo hay cemento y casas. Los animales responderán a esta ausencia de vegetación, desapareciendo o aprovechando las nuevas ventajas que aporta la presencia humana. En este sentido, uno de los grupos de animales donde se ha estudiado la respuesta a la urbanización es en los roedores. Se sabe que algunas especies responden desapareciendo de los ecosistemas, y otras, llegando a nuestras ciudades e instalándose en ellas para siempre.
¿Qué buscamos en este proyecto?
El objetivo general de este estudio fue evaluar la respuesta de la comunidad de roedores a la urbanización en San Cristóbal de las Casas (sclc), desde la perspectiva de la ecología del paisaje, disciplina de la ecología que estudia las interacciones de los seres vivos con el espacio (el paisaje) que habitan y los procesos ecológicos que los definen. Elegimos sclc porque es un buen ejemplo de cómo una ciudad crece sobre los ecosistemas que la rodean. Además, en el momento actual, tiene un tamaño tal que facilita los desplazamientos de un extremo a otro sin mayores contratiempos o tráfico vehicular, ideal para realizar los muestreos de este proyecto en unas cuantas horas.
Con la perspectiva de la ecología del paisaje, buscamos entender el papel de los paisajes naturales y conservados que rodean a sclc, en el mantenimiento de la diversidad de roedores. Primero, se analizó cómo la configuración espacial de la ciudad moldea la comunidad de roedores. Para ello, se caracterizaron los distintos tipos de cobertura vegetal de la ciudad y sus alrededores. Finalmente, se registraron las especies de roedores presentes por tipo de paisaje.
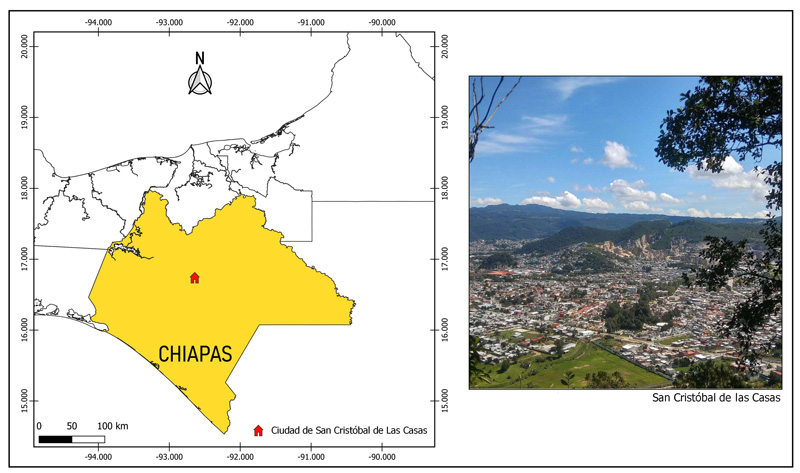
Figura 1. Ubicación del área de estudio en el estado de Chiapas, y vista panorámica de la ciudad.
Créditos: G. Tapia-Ramírez.
La ciudad de San Cristóbal de las Casas
sclc se ubica en el centro norte de Chiapas (ver figura 1), en la región conocida como Los Altos de Chiapas. A pesar de que muchos consideran a sclc un pueblo y, de hecho, ha sido designado pueblo mágico por la Secretaría de Turismo de México, es una ciudad de más de 200,000 habitantes; según el inegi (2021), una ciudad mediana. Se fundó en 1528 (Markman, 1963), por lo que es casi tan antigua como la Ciudad de México (fundada en 1521). sclc se ubica en un área con importantes ecosistemas, como humedales de montaña, bosques de coníferas y bosques mesófilos de montaña (ver figura 2). El asentamiento original era sólo de 18 cuadras y 12 calles; no obstante, lentamente, la ciudad se extendió sobre los ecosistemas que bordeaban a la traza original, y pasó de 30,000 habitantes en la década de 1970 a 190,000 en 2010, hasta alcanzar en 2021 la cifra de 202,459 (inegi, 2010).

Figura 2. Tipos de ecosistemas y asentamientos humanos en San Cristóbal de las Casas.
Créditos: G. Tapia-Ramírez.
De acuerdo con Camacho-Valdez et al., (2019), entre 2001 y 2018, el área urbana en San Cristóbal se incrementó en 12.5% y uno de los ecosistemas que más ha disminuido su área es el humedal de montaña, con una reducción de 7.4% en el mismo período. Otro aspecto por considerar es que las áreas naturales han reducido su tamaño y, actualmente, los fragmentos que persisten están embebidos en la ciudad, y sólo algunos están destinados a la conservación.
¿Qué y cómo lo hicimos?
El estudio se realizó en un área de 15,143 hectáreas, con un radio de 6 km, a la que denominamos área de estudio. Ésta incluye a la ciudad de sclc y áreas conurbadas. El trabajo se dividió en dos fases: gabinete y campo (ver figuras 3a y b). En la primera, llevamos a cabo un análisis de percepción remota, con imágenes del satélite Sentinel 2. Éste permite obtener una vista panorámica del sitio de interés, en el que se identifican los elementos que configuran el paisaje. Con las imágenes de satélite se caracterizó al área de estudio en cuatro tipos de coberturas: urbanas, agrícolas, humedales y bosques (ver figura 3a).
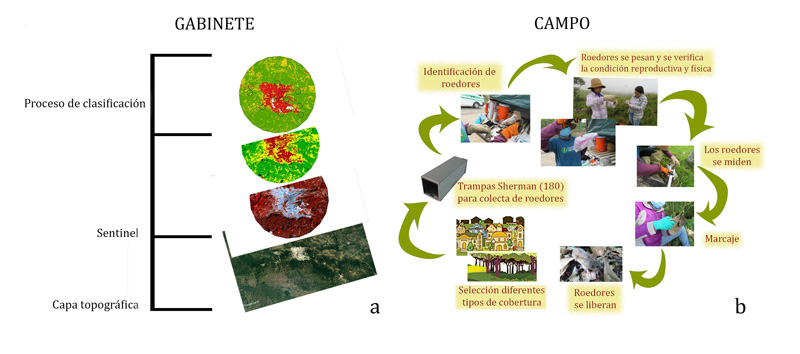
Figura 3. Métodos llevados a cabo en este estudio. a) Clasificación de los tipos de vegetación en San Cristóbal de las Casas. b) Muestreo de roedores.
Créditos: G. Tapia-Ramírez.
En la fase de campo, muestreamos roedores sobre gradientes de urbanización de 6 km (líneas establecidas de lo más urbanizado a 0 km, a lo menos urbanizado, 6 km), donde ubicamos sitios de muestreo, con radios de 500 m. Cuando se trabaja con ratones en campo, es importante poder identificarlos, y así conocer a qué especie pertenecen (en México hay unas 244). Por este motivo, pusimos trampas de las llamadas Sherman (ver figura 3b), que atrapan a los ratones sin causarles daño. Cada ratón así capturado fue identificado, pesado y medido. Posteriormente los ratones fueron liberados en el mismo sitio de su captura. Los sitios donde registramos roedores se categorizaron por el tipo de paisaje (ver figura 4), por el tipo de cobertura y por su configuración espacial.
Hallazgos
La ciudad de sclc está en proceso de urbanización, por lo que la configuración actual del paisaje es un mosaico de parcelas agrícolas, áreas boscosas y humedales de montaña, embebidas en el área urbana, y donde aún existen relictos (o porciones pequeñas de cierto tipo de vegetación) de bosque en las zonas más alejadas del centro de nuestra área de estudio (6 km). Encontramos que hay cuatro tipos de paisajes que incorporan las coberturas arriba mencionadas: urbanos, de tipo mosaico, en transición y conservados (ver figura 4). Estos tipos de paisaje están esparcidos en el área de estudio: los de mayor cobertura urbana se concentran en los primeros 1.5 km, y aquellos con mayor cobertura boscosa están hacia los 6 km (ver figura 4).
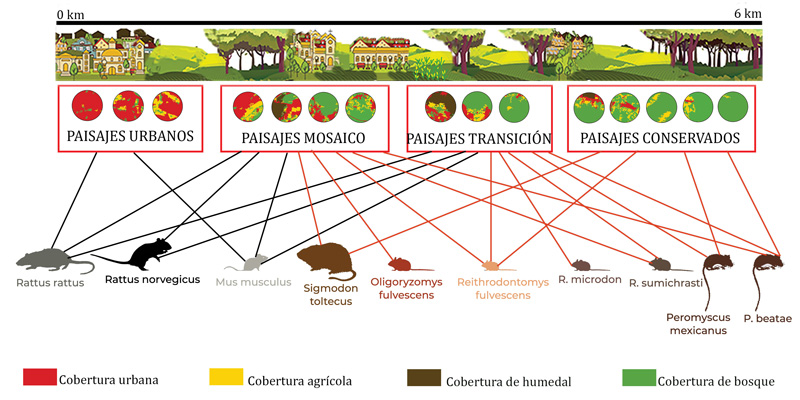
Figura 4. Esquema de los tipos de paisajes presentes en el área de estudio en San Cristóbal de las Casas, y de las especies de roedores que habitan cada una de ellas.
Se encontró que la comunidad de roedores está compuesta por 10 especies correspondientes a las familias: Cricetidae y Muridae; con siete y tres especies, respectivamente. Encontramos que hay especies estrechamente ligadas a los paisajes urbanos, aquellos con casas, avenidas y, en general, estructuras con cemento. Estas especies son Rattus rattus y Mus musculus, pertenecientes a la familia Muridae, especies no nativas y consideradas nocivas. Éstas son especies que esperábamos encontrar, pues son comunes de ver en todos los contextos urbanos del mundo. Cabe resaltar, que éstas, acompañadas de Rattus norvegicus, también fueron encontradas en paisajes donde confluyen casas habitación, parcelas agrícolas, humedales y bosques (ver figura 4, líneas negras). Estas especies no nativas se encuentran en todos los tipos de paisajes, excepto en los conservados, aunque son más abundantes en los urbanos (ver figura 4).
Otro dato interesante es que las especies de la familia Cricetidae (nativas de este continente) no se encuentran en los paisajes urbanos (ver figura 4, líneas cafés). Éstas son especies con requerimientos particulares para establecerse, razón por la cual no aparecen en todo el gradiente. Por ejemplo, Sigmodon toltecus (ver figura 5) requiere de pastos, por lo que se encontró en paisajes donde ese tipo de cobertura abunda (mosaico y conservados). Finalmente, como se esperaba, los paisajes conservados sólo presentan especies nativas. Y si bien, las especies de Peromyscus también fueron reportadas en otros tipos de paisaje, es en estos últimos paisajes donde son más abundantes.
¿Esto qué significa?
Los resultados de este estudio muestran que, contrario a lo que se esperaba, los paisajes conservados en sclc no son los más diversos. Poseen la mitad de especies (n=4) que los paisajes que se ubican en la porción media del gradiente (de mosaico y de transición; 8 especies cada uno; ver figura 4). Estas diferencias en el número de especies se explican por la heterogeneidad ambiental, es decir, los paisajes intermedios de este gradiente poseen más de un tipo de cobertura (en promedio tienen dos), pero hay unidades de paisaje hasta con cuatro. Esta heterogeneidad ambiental propicia un mayor número de hábitats disponibles, lo que favorece un mayor número de especies.
Es importante destacar que si bien es relevante conocer el número de especies que posee un paisaje, también es necesario considerar la identidad de cada una. Por ejemplo, los paisajes conservados tienen cuatro especies, pero todas son nativas y poseen la mayor abundancia de especies de Peromyscus mexicanus (ver figura 5) y P. beatae. En cambio, los paisajes intermedios tienen a las tres especies de roedores considerados nocivos y, además, en mayor abundancia que las especies nativas.

Figura 5. Especies de roedores que habitan los distintos paisajes en San Cristóbal de las Casas.
Entonces… ¿Seguimos haciendo ciudades?
Nuestros resultados ponen de manifiesto que una ciudad mediana, como lo es sclc, aún puede sostener a un número importante de roedores. Sin embargo, también apuntan a que el crecimiento acelerado y no regulado, pone en riesgo la existencia de paisajes que conserven ecosistemas que sostengan a un mayor número de especies de roedores. Con los resultados de este estudio se pudo identificar la importancia de las áreas de conservación en la preservación de especies de roedores nativos, poco abundantes e incluso no presentes en paisajes con coberturas urbanas. Los autores estamos conscientes de la imposibilidad de detener el crecimiento de las ciudades, pero sí consideramos necesario preservar los paisajes que sostienen ecosistemas que contribuyen al bienestar humano en más de un sentido.
¿Qué sigue?
Basados en nuestros resultados, los autores proponemos:
- Establecer muestreos a largo plazo que permitan verificar la salud de los ecosistemas y sus cambios a través del tiempo en San Cristóbal de las Casas.
- Analizar el estado de conservación de los ecosistemas desde la perspectiva de otras especies de mamíferos, menos carismáticos, pero no por eso, menos importantes.
- Establecer vigilancia epidemiológica con la población humana que está en contacto más estrecho con las poblaciones de roedores no nativos en la ciudad de San Cristóbal de las Casas y área conurbada.
- Involucrar a la población en acciones de concientización de la importancia de preservar espacios naturales.
Referencias
- Almejo Hernández, R., García Galeana, J., y Benítez Villegas, I. (2014). La urbanización en México 2010-2030: un esbozo de los retos y oportunidades asociados al crecimiento urbano y regional oportunidad. La situación demográfica de México 2014 (pp. 139-163). Consejo Nacional de Población. https://cutt.ly/EAEKjhd.
- Camacho-Valdez, V., Tello-Alcaide, E. M., Wootton, A., y Valencia-Barrera, E. (2019). Land Use Change and Urban Ecosystem Services: a case study of urban wetlands in a rapidly sprawling city in the Highlands of Chiapas, Mexico. Journal of Management and Sustainability, 9(1), 67-81. https://doi.org/10.5539/jms.v9n1p67.
- inegi. (2015). Conteo Intercensal de Población y Vivienda, Instituto Nacional de Estadística y Geografía, Aguascalientes.
- inegi. (2021). Chiapas. Número de habitantes. Información de México para niños. http://www.cuentame.inegi.org.mx/monografias/informacion/chis/poblacion/.
- Markman, D. S. (1963). San Cristóbal de Las Casas. Escuela de Estudios Hispano Americanos.
- McKinney, M. L. (2006). Urbanization as a major cause of biotic homogenization. Biological Conservation, 127(3), 247-260. https://doi.org/10.1016/j.biocon.2005.09.005.
- onu-Habitat. (2021). Tendencias del desarrollo urbano en México. Programa de Las Naciones Unidas Para Los Asentamientos Humanos. https://onuhabitat.org.mx/index.php/tendencias-del-desarrollo-urbano-en-mexico.
Recepción: 09/12/2021. Aprobación: 23/02/2022.