

Revista Digital Universitaria ISSN: 1607 - 6079 | Publicación mensual
1 de diciembre de 2014 vol.15, No.12
• TEMA DEL MES •
Enzimas: aceleradores de reacciones químicas en las células y en la industria
Introducción
Las enzimas son proteínas especializadas capaces de acelerar la velocidad de una reacción química, promoviendo así la transformación de diferentes moléculas en productos específicos. La alta especificidad con la que se llevan a cabo dichas transformaciones, el volumen reducido de desechos que generan dichos procesos y las condiciones poco agresivas en las que se operan, han permitido que estos biocatalizadores se posicionen como elementos preponderantes en diversos sectores industriales. En efecto, se considera que en aquellos sectores industriales en donde está involucrada al menos una reacción química, existe la posibilidad de integrar una enzima al proceso de transformación. | Las enzimas son proteínas especializadas capaces de acelerar la velocidad de una reacción química, promoviendo así la transformación de diferentes moléculas en productos específicos. | |
 | ||
No obstante que las enzimas se han utilizado desde hace varios siglos en industrias como la cervecera, láctea, de panificación o peletera, es hasta finales del siglo XIX y principios del XX que se establece su naturaleza o mecanismo de acción. De hecho, aun cuando la compañía Röhm (Alemania) utilizó por primera vez en 1914 la enzima tripsina en la industria de detergentes, la naturaleza proteica de las enzimas fue probada hasta 1926 por Sumner. Más aún, se considera que su producción por fermentación a gran escala la inició formalmente la compañía Novo Industri (actualmente Novozymes) en la primera parte de los años sesenta, al producir una glucoamilasa útil en la transformación de almidón en glucosa.
Es indiscutible el interés que ha despertado durante las últimas décadas el uso de estos exquisitos catalizadores en diferentes procesos industriales. En gran medida, gracias a los grandes avances que ha tenido la biotecnología en áreas como la microbiología industrial, la biología molecular, la ingeniería de proteínas y la ingeniería enzimática. Estas técnicas han centrado su atención en la producción eficiente de biocatalizadores que al mismo tiempo que conserven su alta quimio-, regio- y estereoselectividad, mejoren su estabilidad, puedan ser reutilizadas y sean compatibles con tecnologías sustentables y procesos ambientalmente más limpios.
En este sentido, es apartir de los años ochenta que se desarrollan nuevas herramientas fermentativas para la producción y comercialización de enzimas a gran escala, dando lugar a una industria de las enzimas con valores netos de comercialización en el orden de los miles de millones de dólares (POLANA y MACCABE, 2007). Al mismo tiempo, mediante las técnicas del ADN recombinante, se establecen las estrategias necesarias para expresar de manera heteróloga enzimas de diferentes orígenes (animal, vegetal o microbiano) en organismos huéspedes y aumentar de manera significativa las concentraciones de enzima en los cultivos (AEHLE, 2007). Actualmente, con el desarrollo de áreas como la genómica y la proteómica y de herramientas útiles para el análisis y la manipulación de la estructura de proteínas, es posible no solamente tener acceso a un extenso universo de nuevas actividades enzimáticas de diferente origen, sino también manipular, diseñar y mejorar las actividades enzimáticas nuevas y tradicionales.
Las enzimas en solución generalmente son utilizadas una sola vez debido a la dificultad que representa su recuperación al término de una reacción. Esta limitante las convierte a las enzimas en un gasto fijo e impacta directamente el costo total del proceso. Ante este panorama, una de las grandes preguntas planteadas a lo largo del desarrollo de la enzimología industrial ha sido ¿Las enzimas se pueden reutilizar eficientemente? Es claro que un biocatalizador no soluble que sea fácil de recuperar, no pierda su efectividad, se pueda reutilizar y/o permita su operación en procesos continuos a escala industrial impactará de manera positiva la economía de un proceso.
En este sentido, un gran avance en la consolidación del uso de enzimas a escala industrial se debe en gran medida al desarrollo de métodos eficientes de inmovilización de enzimas, es decir, enzimas unidas física- o químicamente a un soporte inerte lo cual permite su fácil recuperación y reutilización (Figura 1).
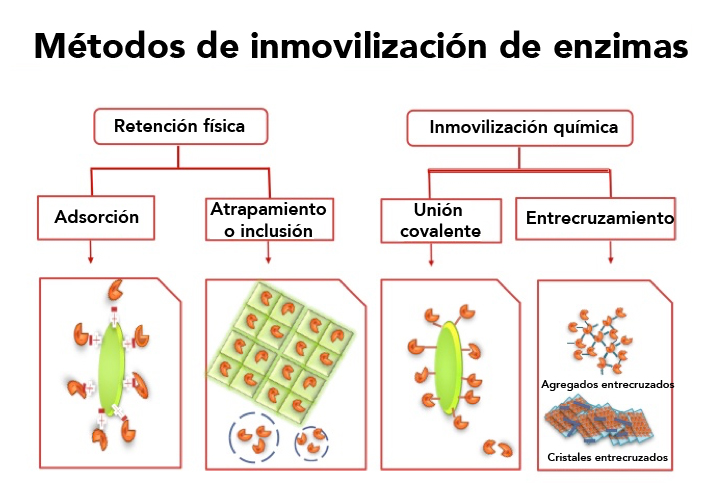
Figura 1. Métodos generales de inmovilización de enzimas.
Si bien desde principios del siglo XX se realizaron esfuerzos para el desarrollo de métodos que permitieran la reutilización de los biocatalizadores, no es sino hasta los años sesenta que los primeros procesos con enzimas inmovilizadas fueron escalados a nivel industrial, permitiendo su reutilización en diferentes ciclos de proceso. Así, en 1969 la compañía japonesa Tanabe-Seiyaku reportó la producción industrial de L-aminoácidos mediante el uso de un reactor enzimático con L-aminoacilasa inmovilizada, y las compañías Bayer AG (Alemania) y Beecham Pharmaceuticals (Inglaterra) reportan el uso de la enzima penicilino G acilasa inmovilizada para la producción de precursores de penicilinas semisintéticas (POULSEN, 2003). Es importante mencionar que desde principios de los años setenta, el proceso para la obtención de jarabes de alta fructosa a partir de almidón de maíz se coloca entre los procesos enzimáticos con los mas altos volúmenes de producción, y que la viabilidad económica de este proceso se debe en gran medida al uso de la enzima glucosa isomerasa inmovilizada (Figura 2) (POULSEN, 2003).
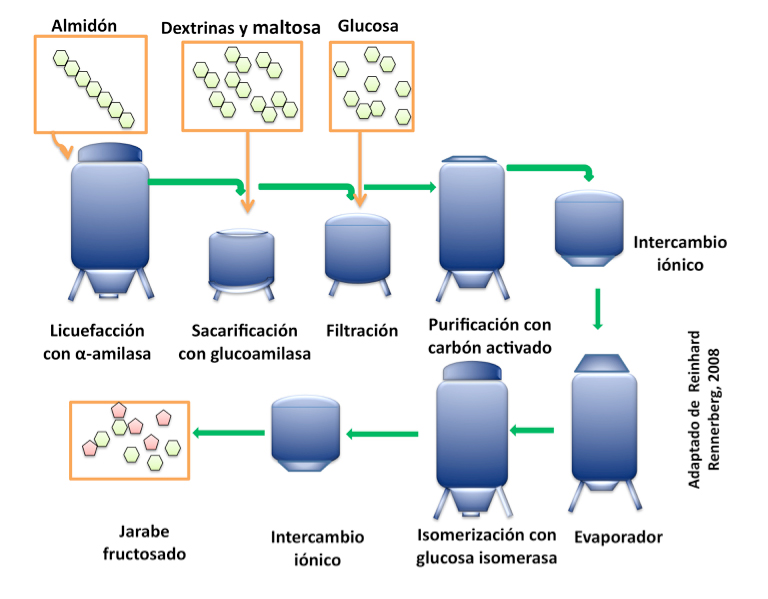
Figura 2. Proceso para la obtención de jarabes de alta fructosa a partir de almidón de maíz utilizando glucosa isomerasa inmovilizada como catalizador. Adaptado de Renneberg R. (2008).
El desarrollo de procesos industriales utilizando enzimas inmovilizadas se ha incrementado de manera sustancial en las últimas décadas. Esto se debe a que no sólo se ha comprobado que la inmovilización de las enzimas permite reciclar el catalizador, sino que, además, la inmovilización contribuye de manera importante a incrementar la estabilidad operacional biocatalizador, permite un diseño más racional del reactor y en algunos casos, a mejorar incluso su eficiencia catalítica.
La alta selectividad con la que las enzimas participan en diferentes procesos de transformación química y las condiciones suaves de reacción en las que se operan dichos procesos industriales, traen en consecuencia un ahorro energético y económico. En los últimos años, el uso de las enzimas a nivel industrial ha impactado en sectores estratégicos tales como el de la química fina o el de los biocarburantes. De hecho, esta participación industrial ha contribuido al desarrollo de nuevas áreas de investigación en biotecnología tales como el de la biotecnología verde y el de la biotecnología blanca.
 | La alta selectividad con la que las enzimas participan en diferentes procesos de transformación química y las condiciones suaves de reacción en las que se operan dichos procesos industriales, traen en consecuencia un ahorro energético y económico. | |
 | ||
Desde un punto de vista del mercado y de la disponibilidad de enzimas industriales, las compañías Novozymes (Dinamarca) y DuPont (USA), a través de sus filiales Danisco/Genencor, dominan el mercado de las enzimas con casi el 75% de las ventas globales. Con volúmenes de ventas menores, pero con una participación importante en el sector se encuentran las compañías alemanas BASF y Henkel, la holandesa DSM, así como las japonesas Amano y Ajinomoto. En la actualidad (2013), se calcula que el mercado global de las enzimas es de alrededor de 4.5 billones de dólares y se espera que crezca para el 2020 a un ritmo del 8.3% y alcance cifras de más de 7.5 billones de dólares (GRAND VIEW RESEARCH, 2014). Dentro de este mercado se estima que las enzimas destinadas al procesamiento de alimentos y bebidas captan alrededor de 40% del mercado global y que dentro de este sector al menos 45% están destinadas a la modificación de carbohidratos, particularmente, aquellas destinadas a la transformación de almidones. En segundo lugar, se calcula que la industria de los detergentes capta alrededor del 30% del mercado, la industria textil y la industria del papel entre del 12 y el 10% del mercado respectivamente y el resto del mercado se divide en aplicaciones diversas para industria química, farmacéutica y biológica.
Aplicaciones industriales relevantes
La comunidad académica e industrial reconoce a la biocatálisis como una herramienta estratégica para el desarrollo de tecnologías sustentables aplicada al procesamiento y transformación de compuestos químicos, farmacéuticos, agroquímicos e ingredientes para alimentos (SCHOEMAKER et al., 2003). Estas tecnologías, en especial aquellas utilizadas en síntesis de productos farmacéuticos, históricamente han involucrado procedimientos largos y complejos que frecuentemente ocupan y generan cantidades importantes de compuestos peligrosos y altamente contaminantes. A fin de contrarrestar estos inconvenientes, las aplicaciones industriales de las enzimas se han establecido considerando 4 principales actividades enzimáticas de alta especificidad y selectividad: la transformación de moléculas, la ruptura de enlace, la unión de moléculas y la transferencia de grupos (Figura 3). Basadas en estas actividades, numerosas aplicaciones industriales que utilizan enzimas se han establecido exitosamente.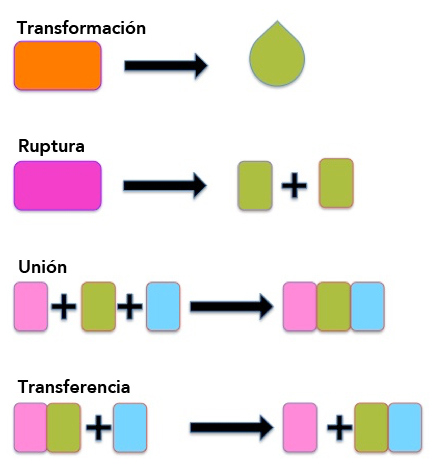
Figura 3. Principales actividades enzimáticas: transformación de moléculas, ruptura de enlace, unión de moléculas y transferencia de grupos.
Esencialmente, además del interés económico que despierta el uso de enzimas a nivel industrial, desde los primeros procesos con biocatalizadores a gran escala, los aspectos de sustentabilidad han sido considerados de manera primordial. Se tiene por ejemplo, el caso de la compañía farmacéutica Merck, la cual producía hormonas esteroidales de manera tradicional empleando un proceso químico de al menos 31 etapas, con la generación consecuente de desechos asociada a un proceso tan complejo. Con el objetivo de hacer más eficiente el proceso, en los años cincuenta del siglo XX, la empresa UpJohn implementó una estrategia biocatalítica de tan sólo 10 pasos, en donde la hidroxilacion de la progesterona en la posición 11 catalizada por un Citocromo P450, resultó ser la reacción clave para la economía del proceso (DUNN, 2012). De hecho, esta reducción del proceso permitió no sólo la disminución del precio de la cortisona de un valor de 200 USD/g hasta un precio de 6 USD/g (SINISTERRA), sino que además permitió la implementación de un proceso mas amigable con el medio ambiente.
Otro proceso enzimático industrial, considerado de gran relevancia en la industria farmacéutica, es la producción de antibióticos β-lactámicos. El acido 7-aminocefalosporánico (7-ACA) es un intermediario en la síntesis de cefalosporinas semisintéticas, antibióticos β-lactámicos ampliamente utilizados en el tratamiento de infecciones bacterianas. Actualmente la producción de 7-ACA es de alrededor de 6,000 toneladas métricas por año, con un mercado valuado en 400 millones de USD (HENDERSON, et al., 2008). Existen dos procesos industriales para obtener el 7-ACA a partir de cefalosporina C (la cual es producida por un proceso fermentativo maduro): el método químico y el método enzimático mostrados en la Figura 4.
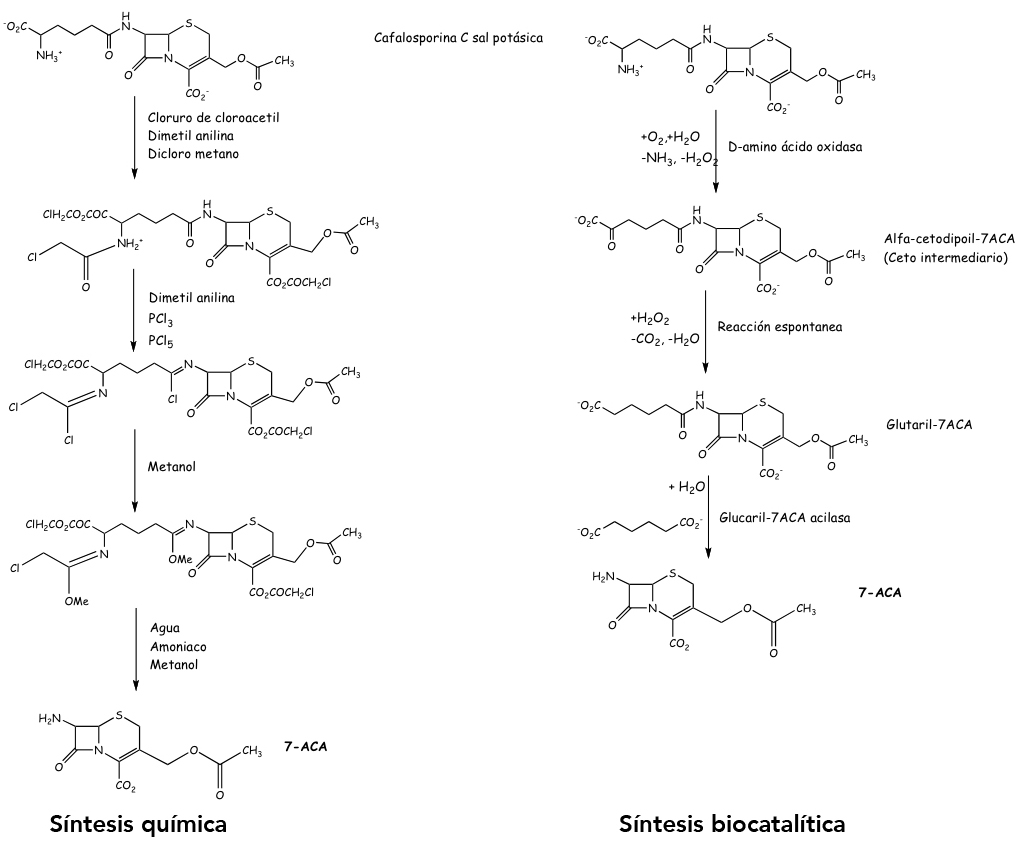
Figura 4. Síntesis química y biocatalítica del acido 7-aminocefalosporánico (7-ACA).
En un comparativo entre la síntesis química y enzimática del 7-ACA, realizado recientemente por Henderson y colaboradores (HENDERSON, et al., 2008), se muestra la gran ventaja el uso de una estrategia biocatalítica. En efecto, si bien el proceso químico presenta mayores rendimientos, éste utiliza una mayor cantidad de reactivos peligrosos y solventes, requiere 60% más energía, cerca del 16% más de masa de reactivos (excluyendo el agua), genera el doble de gases de invernadero, 30 % más de ozono fotoquímico y mayor impacto de acidificación que el proceso enzimático.
Por otra parte, uno de los procesos con mayor impacto económico en el sector de los alimentos y bebidas es la preparación de jarabes con alto contenido de fructosa a partir de almidón de maíz (HFCS por sus siglas en inglés). Más de cuarenta años han transcurrido desde que el primer lote de producción de HFCS salió al mercado. Si bien este proceso se planteó por primera vez en 1950, no fue sino hasta dos décadas después que se volvió económicamente viable. Por un lado, gracias al descubrimiento de una actividad glucosa isomerasa, presente en una preparación de xilosa isomerasa (YAMANAKA, 1966), y por otro lado, a la posibilidad de reutilizar a esta enzima mediante el uso de glucosa isomerasa inmovilizada. No se debe olvidar que para tener un suministro adecuado de glucosa para la reacción con la glucosa isomerasa, el proceso a partir de almidón es catalizado por dos enzimas: una α-amilasa capaz de transformar el almidón (licuefacción) en cadenas cortas de glucosa (10-20), y una glucoamilasa capaz de cortar estas cadenas (sacarificación) en unidades individuales de glucosa (Figura 2).
Un sector en pleno crecimiento y que se posiciona rápidamente en los primeros lugares del mercado global de las enzimas es el de insumos para la industria de la alimentación animal.
 | Un sector en pleno crecimiento y que se posiciona rápidamente en los primeros lugares del mercado global de las enzimas es el de insumos para la industria de la alimentación animal. | |
 | ||
Es claro que en la actualidad, el número de ejemplos de procesos industriales exitosos puede ser tema de un texto completo, en el cual no podrían dejar de mencionarse aplicaciones como la síntesis de acrilamida mediante la hidratación del acrilonitrilo catalizado por la enzima nitrilohidratasa. Las concentraciones de producto de este proceso están en el orden de los 600 g/L, y son comparables a las concentraciones alcanzadas en procesos químicos de alto rendimiento, lo que lleva a producciones de acrilamida del orden de las 30 000 toneladas por año.
En términos de los procesos enzimáticos que en la década reciente han tenido un impacto importante a nivel industrial, están aquellos aplicados a la química fina. De manera sobresaliente podemos mencionar a los procesos para la síntesis directa de enantiómeros puros o a través de la resolución de mezclas racémicas. En efecto, la alta quimio, regio y enantioselectividad de las enzimas ha permitido la aplicación de éstas en procesos en los que la selectividad juega un papel determinante. En este contexto se puede mencionar el uso de la enzima termolisina para la síntesis del edulcorante aspartame en la escala de los miles de toneladas por año (DMS, Holanda) o el uso a gran escala de lipasas y nitrilasas por la empresa BASF (Alemania) para la resolución de diferentes mezclas racémicas. De manera particular, esta compañía ha implementado procesos de acilación enzimática para la resolución de mezclas racémicas de alcoholes y amidas a escala de miles de toneladas. Adicionalmente, reporta la producción industrial de (R)-Acido mandélico a partir de mandelonitrilo mediante el uso de nitrilasas (SCHMID, 2001). No cabe duda que el impacto de las enzimas en procesos industriales es ya una realidad y continúa en amplio crecimiento y que este avance estará determinado en los próximos años por diversos factores en los cuales la interacción academia-industria deberá jugar un papel determinante.
Perspectivas
Las perspectivas de la enzimología industrial a corto y mediano plazo deberán estar influenciadas por el avance acelerado que está teniendo la biotecnología en este siglo. Estos avances deberán permitir por un lado el desarrollo de biocatalizadores hechos a la medida de las necesidades específicas de la industria, y por otro el otro, mejorar la disponibilidad en volumen y en variedad de dichos catalizadores, por supuesto, todo esto a costos cada vez más competitivos. Es importante mencionar que en términos de la disponibilidad de catalizadores con nuevas o mejoradas actividades, las posibilidades son prometedoras, en efecto, se sabe que en la actualidad menos del 3% de los microorganismos presentes sobre la Tierra han sido utilizados como fuentes de enzimas (FARIHA, 2006). Los objetivos para la enzimología industrial para las próximas dos décadas son claros y van de la mano con los objetivos asociados a la industria química tradicional: reducir el uso de materias primas, agua y energía, así como la disminución sustancial de emisiones contaminantes. De manera específica los objetivos inmediatos para los biocatalizadores se presentan en la Tabla 1.
Tabla 1. Objetivos para la enzimología industrial para las próximas dos décadas.
Conclusiones
En la actualidad el uso de enzimas a escala industrial es una realidad y considerando la velocidad del el avance científico y tecnológico en el área de la biotecnología, en este siglo, es de esperarse que el número de procesos biocatalíticos se incremente de manera acelerada en las próximas décadas. Aparentemente, el gran obstáculo que representa la aceptación por la sociedad de cualquier nueva tecnología está superado en el caso de las enzimas. En efecto, contrario a lo que se pensaba hace un par de décadas, hoy en día se observa un interés general en la industria para el desarrollo e implementación de nuevos procesos, tecnologías e infraestructura utilizando enzimas como biocatalizadores. Así, la tendencia para los próximos años deberá ser el desarrollo y aplicación cada vez más frecuente de procesos enzimáticos que permitan integrarse a diferentes etapas de procesos de la química tradicional e incluso sustituirlos en su totalidad. En un mundo con un rápido crecimiento de la población y la consecuente demanda de recursos naturales, la biocatálisis puede convertirse en una herramienta estratégica para diferentes industrias y así enfrentar de mejor manera los retos que esto representa.Bibliografía
AEHLE, Wolfgang. Enzymes in Industry: Production and Applications, Ed. 3rd, Germany: WILEY-VCH Verlag GmbH & Co. 2007.
DASILVA, E. “The Colours of Biotechnology: Science, Development and Humankind”. Electronic Journal of Biotechnology, 2004, 7 (3): http://www.ejbiotechnology.info/index.php/ejbiotechnology/article/view/1114/1496.
DUNN, P. J. “The importance of green chemistry in process research and development” Chemical Society Reviews, 2012, 41 (4), pp. 1452–1461. FARIHA, H., Aamer Al. S. and Abdul H.“Industrial applications of microbial lipases”, Enzyme and Microbial Technology, 2006, 39, (2), 26, pp. 235–251.
Grand View Research-Market Research & Consulting. “Enzymes Market Analysis By Product (Carbohydrase, Proteases, Lipases, Polymerases & Nucleases) And Segment Forecasts To 2020” [en línea]: http://www.grandviewresearch.com/industry-analysis/enzymes-industry
HENDERSON, R.K., et al. EHS and LCA assessment for 7-ACA synthesis: A case study for comparing biocatalytic and chemical synthesis Industrial Biotechnology, 2008, 4 (2) pp. 180-192.
POLAINA Julio and Andrew P. MacCabe. Industrial Enzymes in the 21st Century, in Industrial Enzymes: Structure, Function and Applications, The Netherlands: Springer, 2007.
POULSEN, P.B. and Buchholz, K. (2003) History of Enzymology with Emphasis on Food Production in Handbook of Food Enzymology John R. Whitaker, Alphons G. J. Voragen and Dominic W.S. Wong, N.Y.: Marcel Dekker, Inc.
RENNEBERG R. (2008) Biotechnology for Beginners. Germany: Elsevier GmbH.
SCHMID, A., et al. “Industrial biocatalysis today and tomorrow” Nature, 2001, 409, pp. 258-268.
SCHOEMAKER, H. E. D. Mink, and M. G. Wubbolts “Dispelling the myths--biocatalysis in industrial synthesis” Science, 2003, 299 (5613), pp. 1694–1697.
SINISTERRA, J.V., “Aplicación de las células enteras como biocatalizadores a la síntesis de productos farmacéuticos”, en: Monografías de la Real Academia Nacional de Farmacia, Monografía XXXV: Biocatálisis aplicada a la obtención de fármacos y productos de alto valor añadido. España: Real Academia Nacional de Farmacia.
YAMANAKA, K. “[104] D-Xylose isomerase”. Methods in Enzymology, 1966, 9: 588–593.
COMENTARIOS
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
2013 Esta obra está bajo una licencia de Creative Commons 














