Revista Digital Universitaria ISSN: 1607 - 6079 | Publicación mensual
1 de diciembre de 2014 vol.15, No.12
• TEMA DEL MES •
Enzimas: aceleradores de reacciones químicas en las células y en la industria
Introducción
Durante el desarrollo histórico de la química, ésta ha echado mano de las materias primas y las tecnologías disponibles. El auge de la industria química en la era del petróleo hizo posible la disponibilidad de los bienes de consumo y los desarrollos tecnológicos modernos. Sin embargo, en su etapa temprana, la sustentabilidad no fue considerada importante y así se permitió la generación de subproductos y materiales de desecho que no sólo no se podían reutilizar, sino que eran corrosivos y tóxicos. La utilización eficiente de materiales y el cuidado del ambiente tuvieron que esperar hasta que los efectos adversos de la industrialización fueron tan evidentes que no pudieron ser ignorados. Esto dio paso el desarrollo de principios básicos que deberían ser considerados en los procesos químicos para que tuvieran el menor impacto posible en el ambiente. A esto se le denominó "química verde".La química verde tiene como objetivo mantener y mejorar el ambiente para beneficio de la sociedad. La idea fundamental detrás de este objetivo, aplicada a los procesos químicos que nos permiten generar bienes de consumo, es no generar sustancias peligrosas y transformar las que ya se generan en compuestos menos peligrosos.
 | La química verde tiene como objetivo mantener y mejorar el ambiente para beneficio de la sociedad. | |
 | ||
Uno de los principios de la química verde es el empleo de catalizadores en lugar de usar reacciones estequiométricas. Los catalizadores son agentes químicos que disminuyen la energía necesaria para que un proceso ocurra, permitiendo que éste se lleve a cabo en una escala de tiempo menor, es decir, aceleran las reacciones. Además, un catalizador se emplea en concentraciones subestequiométricas y no se consume en el proceso. En los procesos químicos se utilizan muchos catalizadores de diversas naturalezas. En los sistemas biológicos los catalizadores son proteínas, a las que les llamamos enzimas. En algunos casos estas proteínas hacen uso de iones metálicos incluidos en su estructura para funcionar como catalizadores, aunque no es una regla.
Las enzimas son los catalizadores biológicos naturales que permiten que los procesos químicos que hacen posible la vida, ocurran a la velocidad necesaria. Estas proteínas catalíticas evolucionaron para desarrollar su función en un medio compatible con la vida, como agua y membranas lipídicas. Estos catalizadores también se pueden utilizar para acelerar reacciones químicas fuera de su ámbito biológico. De hecho, ya participan en varios procesos químicos en los que sus propiedades son deseadas, ya que presentan actividad en medios no acuosos, como disolventes orgánicos o fluidos supercríticos.

Green Chemistry. Tomado de http://www2.epa.gov/green-chemistry Estas propiedades se alcanzan al estar en condiciones de presión y temperatura altas, en las que los gases se comportan como fluidos y no existen fases gaseosa o líquida distinguible. Uno de los fluidos supercríticos más usados como disolventes es el CO2. El CO2 supercrítico tiene una excelente capacidad de disolver y transportar moléculas hidrofóbicas. Se le considera un disolvente "verde" ya que es inerte, no tóxico, no inflamable, barato, de fácil acceso y sus parámetros críticos se alcanzan muy fácilmente (72.9 bar y 31.3 ºC).
En el esfuerzo permanente por desarrollar procesos que no perjudiquen al ambiente, las enzimas se han introducido en procesos químicos que lo han demandado. La pertinencia de su uso en estos procesos no obedece sólo a la necesidad de realizarlos más limpia y eficientemente. En muchas ocasiones las reacciones químicas tradicionales no tienen una contraparte biológica que se pueda utilizar como punto de partida para el desarrollo de un catalizador biológico. En otras, aunque se tenga a la enzima que realiza la reacción, los sustratos que no son de origen biológico pueden no ser reconocidos y por tanto son usados de manera ineficiente. Es importante recalcar que la investigación permanente para aislar nuevos microorganismos y describir sus enzimas es la mayor fuente de nuevos prospectos de enzimas para uso industrial. Existen otros métodos para adaptarlas a nuevos sustratos y condiciones de reacción no fisiológicas, como la evolución dirigida y el diseño e ingeniería de proteínas. Una combinación de estos métodos suele dar resultados favorables en la selección de nuevas enzimas, aunque esto no implica dejar de hacer prospección en fuentes naturales.
Las enzimas pueden ser sensibles a condiciones de acidez o temperatura extremas. Es posible facilitar la aplicación de estos catalizadores si las estabilizamos por métodos que permitan mantenerlas en su forma activa. Estos procesos generalmente consisten en su atrapamiento en la superficie o el interior de materiales que reducen su sensibilidad a las condiciones adversas del medio de reacción. Estos soportes pueden ser de origen sintético o natural.
 | Un procedimiento común para la aplicación de enzimas sin necesidad de purificarlas ni inmovilizarlas, es el uso de las mismas células que la producen. Estas células, a su vez, pueden o no estar inmovilizadas en algún otro tipo de polímero que garantice su viabilidad. | |
 | ||
Dentro del marco de la química verde, las enzimas pueden apoyar a mejorar los procesos industriales, ya que algunas de sus propiedades las hacen no sólo adecuadas, sino deseables para dicha función.
1 Para investigar más sobre estos principios, puedes consultar la página de la Agencia de Protección Ambiental (EPA, por sus siglas en inglés) (http://www2.epa.gov/green-chemistry). Aquí encontrarás también un separador, para tener siempre presente los principios de la Química Verde (http://www2.epa.gov/sites/production/files/documents/green-chemistry-bookmark_1.pdf).
Propiedades verdes de las enzimas
- Las enzimas son, de forma natural, un recurso renovable. Se pueden producir en distintos organismos y esta producción, a su vez, requiere únicamente materiales renovables.
- Presentan una alta especificidad por sus sustratos. Esto les permite no sólo seleccionar a la molécula correcta entre otras de distinta naturaleza, sino también entre moléculas de idéntica naturaleza, como son los enantiómeros.
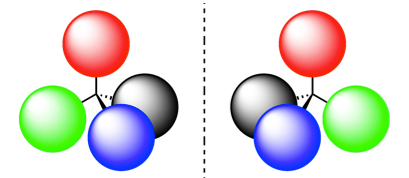
Figura 1. Enantiómeros. Los enantiómeros son moléculas de igual composición y propiedades físicas y químicas que son imágenes especulares una de la otra y no son superponibles. Si cada uno de los átomos representados en distintos colores es distinto entre sí, al rotar cualquiera de los enantiómeros 180º de manera vertical, observamos que sólo las esferas verde y roja se superponen, mientras que la azul y la negra quedan en posiciones invertidas. Las enzimas son capaces de diferenciar estas moléculas, mientras que la mayoría de los métodos químicos no lo hacen. Estos son sustancias con idénticas composiciones y estructuras, pero que se comportan como imágenes especulares que no se pueden superponer (Figura 1). El empleo de catalizadores selectivos permite la separación y reutilización de materiales, distintos al sustrato de la reacción, incluidos en las materias primas.- Las enzimas se pueden usar durante varios ciclos de un proceso, siempre que se cuente con los métodos adecuados para recuperarlas. Estos procesos generalmente requieren la inmovilización de la enzima en un soporte sólido de fácil separación. Por supuesto, el soporte también puede ser reutilizado cuando la enzima se inactive.
- La alta selectividad y la sensibilidad de los métodos enzimáticos permite el empleo de estas moléculas en la fabricación de biosensores que facilitan el monitoreo de los procesos químicos en tiempo real.
- La naturaleza proteica de las enzimas las hace de fácil biodegradación al final de su vida útil, reduciendo así la generación de desechos recalcitrantes.
- El disolvente natural de las enzimas es el agua, por lo que su utilización no implica el uso de disolventes orgánicos. Sin embargo, en caso de ser necesario, las enzimas también pueden trabajar en presencia de estos disolventes.
- La enzimas funcionan a temperaturas y presiones moderadas, ambientales en muchos casos, reduciendo así el impacto económico asociado a la necesidad de energía para cambiar dichas variables, y el impacto ambiental que genera el combustible usado para generar dicha energía.
- Su aplicación en procesos de síntesis orgánica puede reducir de manera significativa el número de operaciones necesarias para obtener un producto.
- Salvo muy pocas excepciones, las enzimas no son tóxicas. Aunque, como con otros compuestos en polvo, se deben tomar las medidas de seguridad pertinentes para proteger las vías respiratorias.
Ejemplos del uso de enzimas
Existen muchos ejemplos del uso de enzimas en procesos industriales. Aquí presentamos unos pocos en los que, además de poder ser introducidas como catalizadores, las enzimas ayudaron a reducir la generación de desechos industriales y a mejorar significativamente la eficiencia en el uso de la materia prima.Un ejemplo de cómo la inclusión de enzimas en procesos químicos promueve la disminución de uso de sustratos, disolventes y pasos, es la síntesis comercial del ingrediente activo de la pregabalina, un medicamento usado para el tratamiento de la epilepsia, el dolor neuropático y el trastorno de ansiedad generalizada. La pregabalina, o ácido (S)-3-(aminometil)-5-metilhexanoico, fue sintetizada originalmente a través de un proceso que incluía una separación de isómeros por medio de recristalizaciones. La selección de isómeros, por otra parte, es una de las especialidades de las enzimas. Así pues, se decidió investigar el potencial de diversas enzimas para hacer la separación de isómeros en una etapa temprana de la síntesis. El objetivo fue usar el compuesto 1 (Figura 2) para convertirlo en el compuesto 2 sin modificar el compuesto 3 y así poder continuar la síntesis química con el compuesto 2.
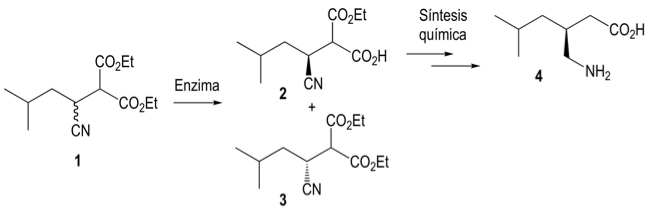
Figura 2. Hidrólisis enantioselectiva catalizada por la enzima Lipolasa (Novozymes) dentro del proceso de síntesis de la pregabalina (compuesto 4). La conversión del compuesto 1 al compuesto 2 sin modificar el compuesto 3 permite la separación de estos últimos, haciendo posible continuar con la síntesis química usando sólo al compuesto 2.
Se probaron diversas enzimas, lipasas, esterasas y proteasas. Aunque varias de ellas generaron el compuesto 2, se seleccionó la Lipolasa (Novozymes) por su alta selectividad y buen rendimiento. Tras varios estudios de optimización, se logró un rendimiento cercano de 48% del compuesto 2, lo cual es muy alto considerando que el máximo alcanzable es 50% por provenir de una mezcla de isómeros. El compuesto 3 se puede convertir nuevamente en el compuesto 1 y así no se pierde materia prima. De este modo, la incorporación de un paso catalizado por una enzima ayudó a la disminución de varias etapas en la síntesis de la pregabalina, además de mejorar la eficiencia en el uso de la materia prima y disminuir el uso de disolventes y la generación de subproductos.
La manufactura del ácido 6-aminopenicilánico (6-APA) es otra muestra de los beneficios generados por el reemplazo de operaciones químicas convencionales por operaciones catalizadas por enzimas. El 6-APA es un precursor para la síntesis de otros antibióticos, como penicilinas semisintéticas y cefalosporinas. La síntesis de 6-APA partía de penicilina G, la cual era transformada mediante la adición de reactivos químicos tóxicos, corrosivos y agresivos con el ambiente, como el diclorometano o el pentacloruro de fósforo. Este proceso se realizaba a -40 ºC, lo cual implicaba un enorme gasto energético. En conjunto, se requerían aproximadamente 20 Kg de materias primas para obtener 1 Kg de 6-APA. En cambio, mediante un procedimiento catalizado por la enzima penicilina acilasa, es posible convertir a la penicilina G en 6-APA, en agua, y solamente requiere de 0.9 Kg de amoniaco, para ajustar la acidez del medio de reacción, para obtener el mismo Kg de producto.
Las nitrilasas son otra prueba de las mejoras sustanciales en procesos químicos provocadas por el uso de enzimas como catalizadores. Estas enzimas convierten a los nitrilos en amidas (nitrilo hidratasas) o en el ácido correspondiente y ion amonio. La nitrilo hidratasa ha sido empleada para la producción de acrilamida a partir de acrilonitrilo (Figura 3). Este compuesto tiene muchas aplicaciones industriales, entre las que destacan su uso para la formación de polímeros que se pueden emplear en una amplia gama de productos y procesos industriales. La acrilamida fue producida originalmente por la compañía American Cyanamid en 1954, utilizando un proceso basado en la mezcla de cantidades iguales (en moles) de ácido sulfúrico, acrilonitrilo y agua a temperatura entre 60 y 80 ºC.
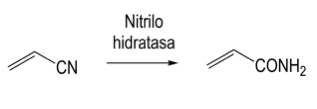 Figura 3. Conversión de acrilonitrilo en acrilamida catalizada por la enzima nitrilo hidratasa.
Esta mezcla se neutralizaba con hidróxido de amonio generando una enorme cantidad de sulfato de amonio. La acrilamida formada, con rendimiento bajo, se recristalizaba con benceno, el cual por sí mismo es tóxico. Con el tiempo este proceso fue sustituido por uno que utilizaba un catalizador de cobre. Sin embargo este proceso se realizaba a 120 ºC y el producto contenía trazas de cobre y ácido acrílico, lo que complicaba su posterior purificación. Este proceso igualmente presentaba un rendimiento bajo, con conversiones cercanas al 50% de acrilonitrilo. Esto obligaba a reciclar una enorme cantidad del acrilonitrilo que se encontraba como contaminante de la acrilamida. Finalmente la enzima nitrilo hidratasa entró en escena después de ser descubierta en distintas bacterias del suelo. La bacteria Rhodococcus sp. J1 produce una nitrilo hidratasa que transforma acrilonitrilo en acrilamida, con un 99% de selectividad y con rendimientos mayores al 99%. Paulatinamente, este procedimiento ha ido reemplazando los procedimientos basados en catalizador de cobre dadas sus evidentes ventajas. El proceso que utiliza a la nitrilasa de Rhodococcus sp. J1 se realiza a baja temperatura, a pH neutro, y el producto se obtiene con una pureza tal que no requiere otras operaciones de purificación distintas del secado. Esto lo convierte en un proceso amigable con el ambiente en el que la mayor parte del sustrato se convierte en producto, sin uso de disolventes orgánicos, sin empleo masivo de ácidos o bases, y sin grandes gastos de energía para elevar la temperatura.
Figura 3. Conversión de acrilonitrilo en acrilamida catalizada por la enzima nitrilo hidratasa.
Esta mezcla se neutralizaba con hidróxido de amonio generando una enorme cantidad de sulfato de amonio. La acrilamida formada, con rendimiento bajo, se recristalizaba con benceno, el cual por sí mismo es tóxico. Con el tiempo este proceso fue sustituido por uno que utilizaba un catalizador de cobre. Sin embargo este proceso se realizaba a 120 ºC y el producto contenía trazas de cobre y ácido acrílico, lo que complicaba su posterior purificación. Este proceso igualmente presentaba un rendimiento bajo, con conversiones cercanas al 50% de acrilonitrilo. Esto obligaba a reciclar una enorme cantidad del acrilonitrilo que se encontraba como contaminante de la acrilamida. Finalmente la enzima nitrilo hidratasa entró en escena después de ser descubierta en distintas bacterias del suelo. La bacteria Rhodococcus sp. J1 produce una nitrilo hidratasa que transforma acrilonitrilo en acrilamida, con un 99% de selectividad y con rendimientos mayores al 99%. Paulatinamente, este procedimiento ha ido reemplazando los procedimientos basados en catalizador de cobre dadas sus evidentes ventajas. El proceso que utiliza a la nitrilasa de Rhodococcus sp. J1 se realiza a baja temperatura, a pH neutro, y el producto se obtiene con una pureza tal que no requiere otras operaciones de purificación distintas del secado. Esto lo convierte en un proceso amigable con el ambiente en el que la mayor parte del sustrato se convierte en producto, sin uso de disolventes orgánicos, sin empleo masivo de ácidos o bases, y sin grandes gastos de energía para elevar la temperatura.
Un último ejemplo: la vitamina B3 (nicotinamida) se puede producir a partir de 2-metilpentano-1,5-diamida (compuesto 5 en la Figura 4), pasando por un proceso de ciclización y deshidrogenación para producir 3-picolina (compuesto 6), la cual se amoxida para obtener la 3-cianopiridina (compuesto 7), la cual es finalmente convertida a nicotinamida. Este último paso solía hacerse mediante hidrólisis alcalina del grupo ciano, generando grandes cantidades de sales inorgánicas como desecho, y de ácido nicotínico como subproducto. En nuestros días, esta etapa del proceso se ha cambiado por un paso enzimático catalizado también por una nitrilo hidratasa, que ofrece conversiones del 100% y una selectividad mayor al 99%. Nuevamente, este producto requiere poca purificación ya que todo el sustrato es convertido a producto.
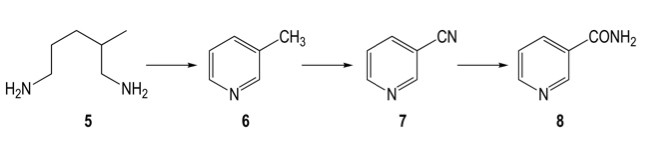
Figura 4. Síntesis quimioenzimática de nicotinamida (Vitamina B3). La 2-metilpentano-1,5-diamida (compuesto 5) se somete a un proceso de ciclización y deshidrogenación por métodos químicos para producir 3-picolina (compuesto 6), que a su vez se amoxida para obtener 3-cianopiridina (compuesto 7). La cianopiridina es hidratada por la enzima nitrilo hidratasa para generar la nicotinamida (compuesto 8).
Estas nitrilo hidratasas también se usan en otros procesos industriales, ofreciendo ventajas similares. Por ejemplo, en la producción de 5-cianovaleramida, un precursor del pesticida azafenidina, y en la producción de levetiracetam, un fármaco para el tratamiento de la epilepsia.
Conclusión
El empleo de enzimas ha facilitado la aplicación de los principios de la química verde a procesos industriales bien establecidos. Las ventajas que éstas ofrecen como biocatalizadores, ya sea libres, inmovilizadas o como células completas, deben ser aplicadas tomando en consideración el proceso químico de forma integral. Es cierto que las enzimas no pueden reemplazar a todos los catalizadores químicos ni participar en todas las reacciones existentes, por lo que son de enorme importancia los esfuerzos permanentes en bioprospección e ingeniería de proteínas para desarrollar los nuevos catalizadores que en el futuro mejorarán los procesos químicos actuales. Los nuevos catalizadores y el análisis detallado de una gran cantidad de procesos químicos, nos llevarán a la implementación del uso enzimas como catalizadores de reacciones químicas que finalmente contribuyan a mejorar la eficiencia y limpieza de estos procesos. El beneficio no es sólo para el productor, al reducir sus costos y aumentar los rendimientos, sino para la humanidad al ayudar a conservar nuestro planeta. Recordemos que el ambiente no tiene fronteras. La contaminación en cualquier lugar del planeta es un problema para todos sus habitantes.Bibliografía
DICOSIMO, R. Biocatalysis in the pharmaceutical and biotechnology industries (ed. Patel, R.N.), CRC Press, 2007, pp. 1–26. KOBAYASHI, M., Nagasawa, T., Yamada, H. “Enzymatic synthesis of acrylamide: a success story not yet over.” Trends Biotechnol, 1992, 10, pp. 402–408. MARTINEZ, C.A., et al. “Development of a chemoenzymatic manufacturing process for pregabalin.” Org. Process Res. Dev. 2008, 12, pp. 392–398. NAGASAWA, T., Shimizu, H., Yamada, H. “The superiority of the third-generation catalyst, Rhodococcus rhodochrous J1 nitrile hydratase for industrial production of acrylamide.” Appl. Microbiol. Biotechnol. 1993, 40, pp. 189–195. SHAPIRO, R., et al. “Discovery and development of a commercial synthesis of azafenidin.” Org. Process Res. Dev. 2001, 5, pp. 593–598. SHAW, N.M., Robins, K.T., Kiener, A. “Lonza: 20 years of biotransformation.” Adv. Synth. Catal. 2003, 345, pp. 425–435. SHELDON, R.A., Arends, I., Hanefeld, U.. Green Chemistry and Catalysis. WILEY-VCH Verlag GmbH & Co. 2007, pp. 1–47. TUCKER, J.L., et al. Chemoenzymatic processes for preparation of levetiracetam. PCT Int. Appl, WO 2009009117 A3, 2009. YAMADA, H., Kobayashi, M. “Nitrile hydratase and its application to industrial production of acrylamide.” Biosci. Biotechnol. Biochem. 1996, 60, pp. 1391–1400. ZHENG, R.-C., Zheng, Y.-G., Shen, Y.-C. “Acrylamide, microbial production by nitrile hydratase.” Encyclopedia of Industrial Biotechnology (ed. Flickinger, M.C.), John Wiley & Sons, 2010, pp. 1–39.
COMENTARIOS
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
2013 Esta obra está bajo una licencia de Creative Commons