Vol. 26, núm. 3 mayo-julio 2025
Cuando la inteligencia artificial escucha a las moléculas
Mildret Guadalupe Martínez Gámez y Hernán Peraza Vázquez CitaResumen
¿Sabías que una computadora puede ayudarte a detectar enfermedades o saber si un alimento es seguro, sólo analizando cómo vibra una molécula? La inteligencia artificial (ia) está cambiando las reglas del juego en la ciencia moderna, especialmente en una técnica llamada espectroscopía ftir. Esta herramienta permite “escuchar” las vibraciones de las moléculas para conocer su estructura, algo que antes requería horas de análisis por parte de especialistas. Ahora, gracias a la ia, este proceso es más rápido, preciso y accesible. Este artículo explora cómo la combinación entre ia y ftir está revolucionando campos como el diagnóstico temprano del cáncer o el control de calidad de los alimentos. ¿Cómo lo logran? Mediante algoritmos capaces de reconocer patrones invisibles al ojo humano, que ayudan a tomar decisiones críticas en cuestión de minutos. Además, conocerás cómo estas tecnologías están siendo aplicadas en el mundo real y qué desafíos aún deben superarse. ¿Puede una red neuronal detectar un tumor? ¿O decirnos si una grasa es saludable? Acompáñanos a descubrir cómo la ciencia y la inteligencia artificial están trabajando juntas para entender mejor lo que no podemos ver… pero que está en todo lo que nos rodea.
Palabras clave: inteligencia artificial, espectroscopía ftir, análisis molecular, tecnología en salud, seguridad alimentaria.
When artificial intelligence listens to molecules
Abstract
Did you know that a computer can help you detect diseases or determine if a food is safe, just by analyzing how a molecule vibrates? Artificial intelligence (ai) is changing the game in modern science, especially in a technique called ftir spectroscopy. This tool allows us to “listen” to the vibrations of molecules to understand their structure, something that once required hours of analysis by experts. Now, thanks to ai, this process is faster, more accurate, and more accessible. This article explores how the combination of ai and ftir is revolutionizing fields like early cancer diagnosis and food quality control. How do they do it? By using algorithms capable of recognizing patterns invisible to the human eye, which help make critical decisions in minutes. You’ll also learn how these technologies are being applied in the real world and the challenges that still need to be overcome. Can a neural network detect a tumor? Or tell us if a fat is healthy? Join us to discover how science and artificial intelligence are working together to better understand what we can’t see… but is in everything around us.
Keywords: artificial intelligence, ftir spectroscopy, molecular analysis, health technology, food safety.
¿Puede la inteligencia artificial ayudarnos a entender mejor la química?
La inteligencia artificial (ia) está transformando muchas áreas de nuestra vida: desde los asistentes virtuales en casa, hasta los avances en medicina, seguridad informática o industria automotriz. En química y bioquímica, su impacto es especialmente notable en la espectroscopía infrarroja por transformada de Fourier (ftir), una técnica que permite analizar las características moleculares a través de las vibraciones de las sustancias. Este tipo de análisis ha sido clave para comprender la estructura de un sinfín de moléculas.
Aunque el ftir es una herramienta fundamental para el análisis espectral, su interpretación puede resultar desafiante, incluso para expertos. En este contexto, la ia ha tenido un impacto positivo al facilitar una tarea que solía ser compleja y extenuante. Gracias a ella, hoy se logran interpretaciones más precisas, eficientes y accesibles, revolucionando el análisis de grandes volúmenes de datos.
Este artículo analiza el impacto de la ia en la interpretación de espectros ftir y explora sus aplicaciones en áreas como la investigación médica y la seguridad alimentaria.
La técnica que capta la voz secreta de las moléculas
La espectroscopía ftir es una técnica analítica clave que permite estudiar las propiedades moleculares mediante la absorción de luz infrarroja. Este proceso revela patrones vibracionales únicos —similares a las huellas dactilares humanas — que brindan información valiosa sobre la estructura y composición de las sustancias (Fontes et al., 2020).
Aunque puede parecer una técnica lejana a nuestra vida cotidiana, su impacto es directo: interviene en la seguridad de los medicamentos que consumimos o en la detección de contaminantes ambientales que afectan la calidad del aire y del agua.
Uno de los puntos clave en el uso de esta técnica es la preparación de las muestras. Cualquier impureza —como agua— puede alterar el espectro y llevar a interpretaciones erróneas. Por eso, esta etapa requiere especial cuidado para evitar interferencias.
El espectrómetro ftir funciona mediante una fuente de luz infrarroja cuya longitud de onda interactúa con la muestra. Las vibraciones moleculares generadas son captadas por un detector y transformadas en datos que se representan como un espectro, lleno de picos y valles (ver figura 1).
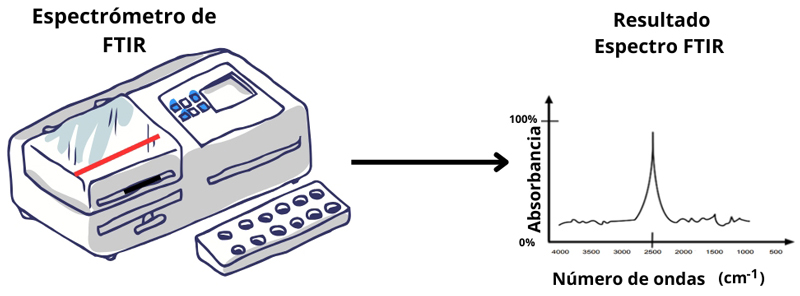
Figura 1. Representación de un espectrómetro ftir típico y el espectro de una sustancia analizada.
Crédito: elaboración propia.
Esos picos reflejan las vibraciones de los enlaces moleculares. Cada enlace tiene una frecuencia de vibración específica, lo que permite a las y los científicos interpretar el espectro y deducir la estructura molecular de la sustancia. Aquí es donde la ia cobra protagonismo: permite identificar patrones espectrales con rapidez y precisión, tarea que antes requería un análisis manual, especializado y lento.
En comparación con otras técnicas, el ftir ofrece ventajas notables: resultados más rápidos, con equipos más económicos. Aunque, claro, también tiene limitaciones, como la dificultad para analizar mezclas complejas o materiales amorfos (sin estructura organizada).
Actualmente, esta técnica evoluciona de la mano de la ia, que mejora la interpretación de espectros complejos. Además, se están desarrollando instrumentos portátiles que podrían revolucionar su uso en campo, facilitando análisis en sitios remotos o en situaciones críticas —como la detección de contaminantes en tiempo real—.
A pesar de sus límites, la espectroscopía ftir sigue siendo esencial para la ciencia. Su integración con tecnologías de inteligencia artificial y aprendizaje automático promete expandir aún más sus aplicaciones en la medicina, la industria alimentaria y la protección ambiental.
¿Cómo sabemos qué dice una molécula?
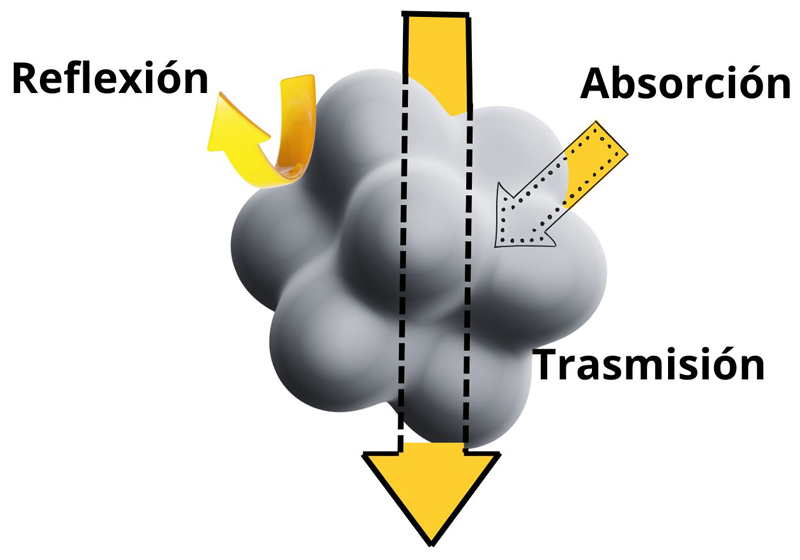
Figura 2. Interacción de la materia con la radiación electromagnética.
Crédito: elaboración propia.
Para entender cómo funciona la espectroscopía ftir y qué nos revela sobre el mundo microscópico de las moléculas, es esencial conocer algunos conceptos clave: absorción, transmitancia y reflexión. Estos procesos son fundamentales para interpretar cómo interactúa la radiación electromagnética con la materia (ver figura 2).
Cuando una molécula absorbe luz infrarroja, los átomos que la componen comienzan a vibrar. Este fenómeno —conocido como absorción— depende de la frecuencia de la luz y de los enlaces químicos presentes en la molécula. Al igual que un instrumento musical que emite sonidos únicos, cada molécula produce vibraciones específicas que pueden capturarse y analizarse, permitiendo su identificación precisa.
Por otro lado, la transmitancia se refiere a la cantidad de luz infrarroja que atraviesa una muestra hasta llegar al detector. Las muestras con alta transmitancia dejan pasar más luz, mientras que aquellas con baja transmitancia absorben una mayor cantidad.
Vibraciones que cuentan historias
El espectro ftir es una representación gráfica que muestra cómo se absorbe o transmite la luz infrarroja según su longitud de onda. Los picos y valles corresponden a las vibraciones de los enlaces químicos presentes en una muestra (ver figura 3; Lahlali et al., 2015; Nandiyanto et al., 2022).
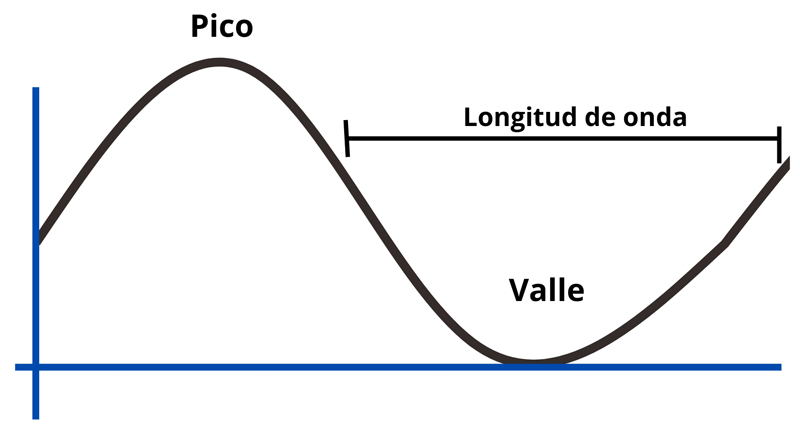
Figura 3. Representación de pico y valle en espectro.
Crédito: elaboración propia.
Cada pico revela una vibración específica de un enlace químico. Esto permite a las y los científicos identificar y medir los compuestos presentes. Así como las notas en una partitura indican diferentes sonidos, los picos en un espectro marcan las frecuencias de vibración características de los enlaces moleculares.
En los espectros de transmitancia por ftir, las zonas más profundas indican las frecuencias donde la muestra absorbe energía. Las zonas planas, por el contrario, reflejan frecuencias que no fueron absorbidas.
Este comportamiento puede entenderse con un ejemplo cotidiano: cuando usas una camiseta clara en un día soleado, refleja más luz y te mantiene fresco. En cambio, una camiseta oscura absorbe más luz y te hace sentir más calor.
¿Para qué sirve ponerle oído a la materia?
Como se muestra en la figura 4, la espectroscopía ftir tiene una amplia gama de aplicaciones.
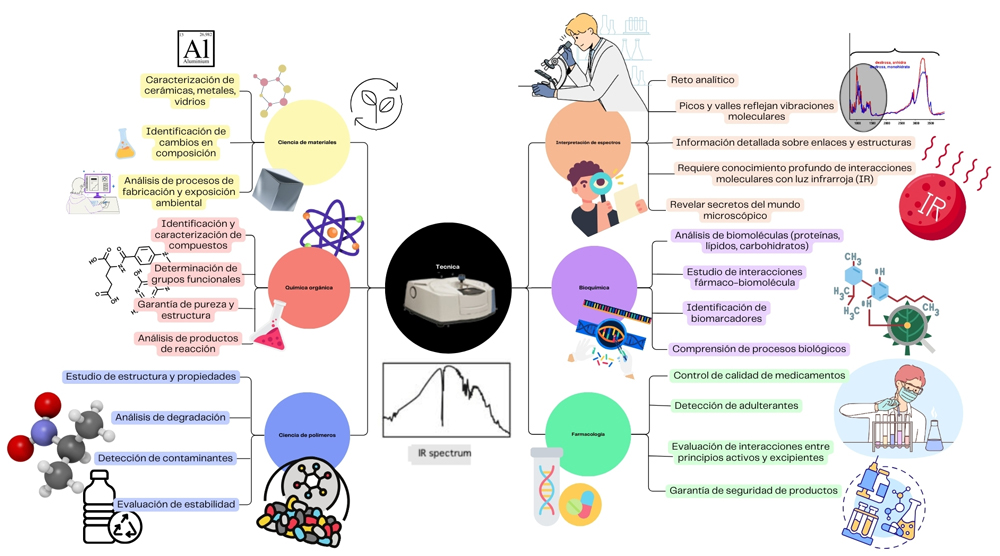
Figura 4. Áreas de aplicación del FTIR.
Crédito: elaboración propia.
- En química orgánica, se utiliza para identificar y caracterizar compuestos, analizar productos de reacción y asegurar su pureza y estructura.
- En la ciencia de los polímeros, permite estudiar la estructura, propiedades y degradación de materiales, así como detectar contaminantes. Esto es clave para evaluar su estabilidad en distintas condiciones de uso.
- En bioquímica, el ftir ayuda a analizar proteínas, grasas y azúcares en el cuerpo. Esto permite identificar indicadores de salud y estudiar cómo interactúan los medicamentos con nuestro organismo.
- En el análisis farmacéutico, se usa para el control de calidad de medicamentos, detectar adulterantes y evaluar cómo se combinan los componentes activos con los excipientes. Esto garantiza la eficacia y seguridad de los productos.
- También en la ciencia de los materiales es una técnica fundamental. Permite caracterizar compuestos como cerámicas, metales o vidrios, y detectar cambios en su composición tras procesos de fabricación o exposición a diferentes ambientes.
A pesar de sus múltiples beneficios, interpretar los espectros ftir puede ser todo un reto. Estos gráficos —llenos de picos y valles— ofrecen información muy detallada sobre enlaces y estructuras, pero analizarlos requiere experiencia y tiempo.
Aquí es donde entra en escena la inteligencia artificial. Gracias a sus capacidades de aprendizaje automático, permite automatizar y agilizar el análisis de espectros, haciendo que esta poderosa herramienta sea más accesible y eficiente para científicos de distintas áreas.
¿Y qué tiene que ver aquí la inteligencia artificial?
La inteligencia artificial (ia) abarca una amplia gama de tecnologías diseñadas para imitar capacidades cognitivas humanas como el aprendizaje, el razonamiento y la resolución autónoma de problemas (Lara Andino et al., 2024). Como se muestra en la figura 5, la ia se basa en varios pilares esenciales que la hacen posible y efectiva.
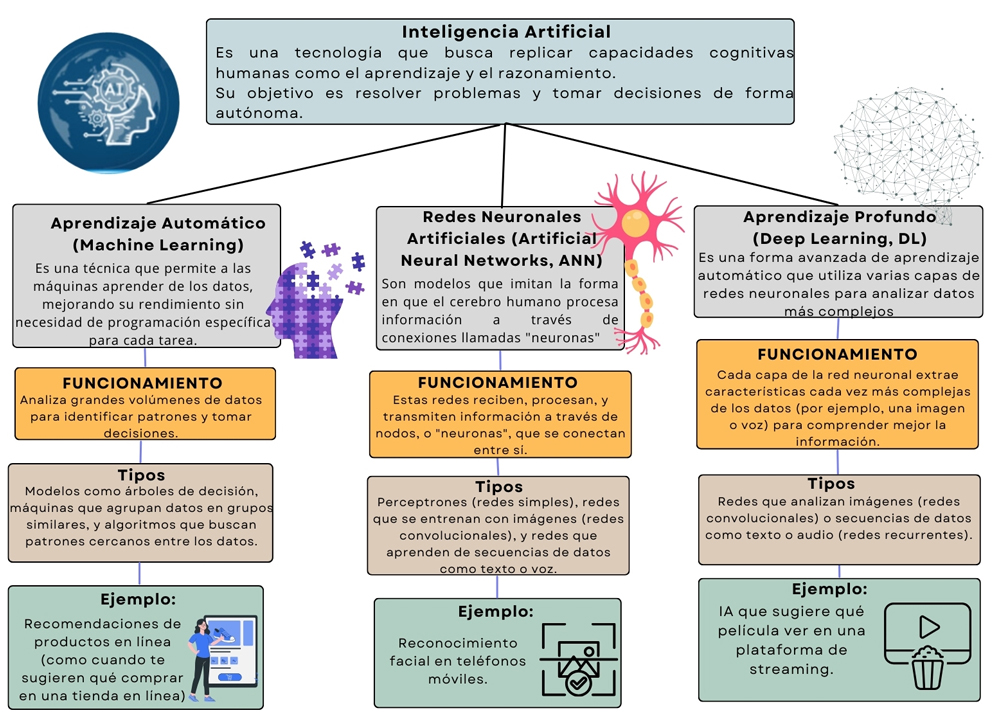
Figura 5. Ramas de la inteligencia artificial.
Crédito: elaboración propia.
Uno de los más importantes es el aprendizaje automático (Machine Learning, ml), que permite a los sistemas mejorar su rendimiento al analizar grandes cantidades de datos. Mediante la modificación de parámetros y modelos de entrenamiento, los algoritmos de ml pueden realizar tareas como clasificación o detección de patrones, sin necesidad de estar programados para cada caso (Gallo et al., 2021).
Otro pilar clave son las redes neuronales artificiales (Artificial Neural Networks, ann), inspiradas en la estructura del cerebro humano. Estas redes procesan la información de manera similar a como lo hacen nuestras neuronas (ver figura 6).
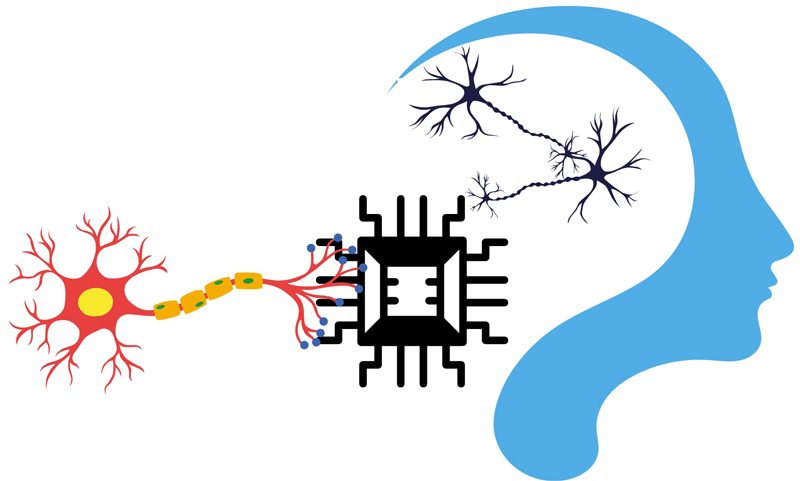
Figura 6. Ejemplificación de redes neuronales artificiales.
Crédito: elaboración propia.
Dentro del campo de la ia, las redes neuronales convolucionales (Convolutional Neural Networks, cnn) han sido especialmente útiles para tareas como el procesamiento de imágenes y el reconocimiento de patrones complejos (Ayeni, 2022).
El aprendizaje profundo (Deep Learning, dl) representa un paso más allá del aprendizaje automático tradicional. Utiliza múltiples capas de redes neuronales interconectadas que permiten una comprensión más profunda de los datos (De Lara-García, 2022). Gracias a esto, las máquinas pueden procesar información compleja —como imágenes, voz o texto— de una manera más parecida al cerebro humano (ver figura 7).
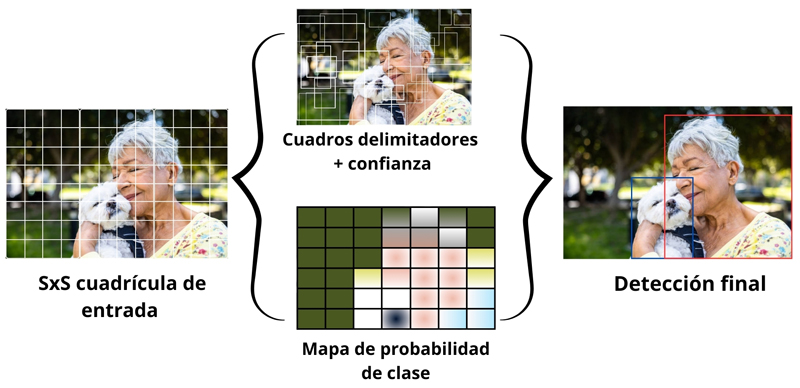
Figura 7. Ejemplificación de Deep Learning.
Crédito: elaboración propia.
Estos avances han revolucionado la interpretación de datos espectrales. Gracias al dl y a las redes neuronales, ahora se pueden identificar patrones complejos con mayor rapidez y precisión, automatizando procesos que antes requerían intervención humana y reduciendo el margen de error (Poggialini et al., 2022).
En campos como la espectroscopía, donde se manejan grandes volúmenes de datos, la ia ha optimizado procesos tradicionalmente manuales. Un buen ejemplo de esto es la espectroscopía ftir, que hoy se beneficia de análisis más veloces, objetivos y eficaces (Liu et al., 2020).
IA + química: una dupla que ya está dando resultados
Hasta hace poco, interpretar espectros ftir era una tarea manual que dependía de la experiencia de personas expertas. Este proceso era lento y podía ser subjetivo, especialmente al tratar espectros complejos o grandes volúmenes de datos.
Actualmente, existen enfoques basados en inteligencia artificial que han transformado este panorama. Por ejemplo, algunos modelos de clasificación pueden identificar espectros según sus características (ver figura 8), lo que permite detectar compuestos conocidos en distintos sectores, como la industria farmacéutica o petroquímica (Acosta-Jiménez et al., 2023).
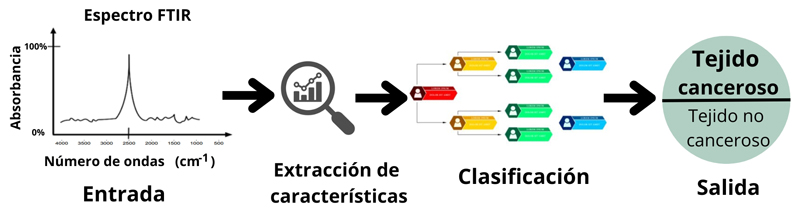
Figura 8. Detección de tejido canceroso con aprendizaje automático.
Crédito: elaboración propia.
Además, las redes neuronales profundas, especialmente las cnn, han demostrado ser herramientas poderosas para la interpretación de espectros ftir. Estas redes procesan los datos por capas, de forma jerárquica (Saleem et al., 2022): empiezan reconociendo patrones simples y, capa tras capa, detectan características cada vez más complejas.
Esto les permite distinguir pequeñas diferencias entre compuestos con espectros similares, como se ilustra en la figura 9.
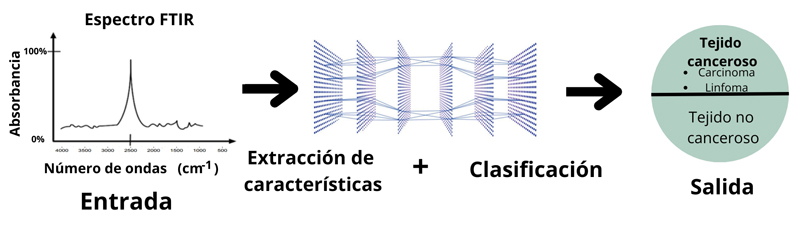
Figura 9. Detección de tejido canceroso con aprendizaje profundo.
Crédito: elaboración propia.
Mientras analizan los datos, las cnn extraen automáticamente información relevante y la asocian con estructuras moleculares, mejorando así la precisión y velocidad del análisis.
Por todas estas razones, las redes neuronales profundas se han convertido en herramientas esenciales para optimizar la interpretación espectral en distintos campos científicos.
Aplicaciones en el mundo real: la IA en acción
La inteligencia artificial (ia) ha logrado avances impresionantes en el análisis espectral mediante espectroscopía ftir, mostrando su enorme potencial en distintas áreas. Uno de los campos más prometedores es el diagnóstico temprano del cáncer, donde la combinación entre ia y ftir se perfila como una herramienta poderosa.
Este método es rápido, no invasivo y ofrece información detallada sobre la composición molecular de los tejidos. Por ejemplo, un estudio de Hannafon (2021) demostró cómo un modelo de ia, entrenado con imágenes médicas, puede identificar características específicas del tejido que rodea los tumores. Esto mejora la precisión y oportunidad en el diagnóstico del cáncer de mama. ¿La ventaja? Una detección más temprana y certera, lo que aumenta las probabilidades de tratamiento exitoso y supervivencia.
Además, la ia ha encontrado aplicaciones valiosas en el control de calidad de los alimentos. Al combinar espectros ftir con algoritmos inteligentes, es posible analizar la composición química de distintos productos y verificar que cumplan con los estándares necesarios.
Un ejemplo de esto lo encontramos en Rohman et al. (2020), donde se muestra cómo la ia puede evaluar la calidad de grasas y aceites, garantizando que sean seguros para el consumo. Por su parte, Feng et al. (2021) demostraron que la ia puede distinguir entre distintos tipos de alimentos y rastrear su origen, una función clave para asegurar su autenticidad y calidad.
Estos casos muestran que la inteligencia artificial no sólo mejora la precisión y velocidad en el análisis de espectros ftir, sino que también protege la salud pública y la seguridad alimentaria. Conforme estas tecnologías evolucionen, se espera que surjan nuevas aplicaciones capaces de mejorar la calidad de vida y monitorear aspectos clave como el medio ambiente.
¿Y ahora qué? Lo que esta tecnología puede cambiar
El avance de la inteligencia artificial y su integración con la espectroscopía ftir ya está transformando sectores clave, extendiendo su alcance a aplicaciones prácticas cada vez más innovadoras.
Esta combinación tecnológica tiene un enorme potencial para acelerar la investigación, mejorar la calidad de los productos y apoyar el desarrollo de nuevos materiales. Con el tiempo, el análisis espectral será más preciso, más rápido y más accesible, lo que revolucionará tanto la ciencia como la industria.
Sin embargo, aún hay retos por superar. Es fundamental contar con datos de alta calidad y entender cómo toma decisiones la ia para garantizar resultados confiables. Además, se necesita un trabajo colaborativo: especialistas en ia deben unir fuerzas con científicos de distintas áreas para lograr aplicaciones verdaderamente útiles y efectivas.
Referencias
- Acosta-Jiménez, S., González-Chávez, S. A., Camarillo-Cisneros, J., Pacheco-Tena, C. F., y Ochoa-Albíztegui, R. E. (2023). Aplicaciones de la inteligencia artificial en la medicina y la imagenología médica. Revista Anales de Radiología México, 22(2). https://doi.org/10.24875/ARM.21000093.
- Ayeni, J. A. (2022). Convolutional Neural Network (cnn): The architecture and applications. Applied Journal of Physical Science, 4(4), 42–50. https://doi.org/10.31248/AJPS2022.085.
- De Lara-Garcia, J. (2022). Inteligencia Artificial y Justicia. DIVULGARE Boletín Científico de La Escuela Superior de Actopan, 9(17), 41–46. https://doi.org/10.29057/esa.v9i17.8093.
- Feng, L., Wu, B., Zhu, S., He, Y., y Zhang, C. (2021). Application of Visible/Infrared Spectroscopy and Hyperspectral Imaging with Machine Learning Techniques for Identifying Food Varieties and Geographical Origins. Frontiers in Nutrition, 8. https://doi.org/10.3389/fnut.2021.680357.
- Fontes, V., Cubas Pereira, D., Pupin, B., y Sakane, K. K. (2020). Aplicação de espectroscopia no infravermelho: Como ferramenta para análise quantitativa de orégano. Revista Univap, 26(51), 15. https://doi.org/10.18066/revistaunivap.v26i51.2451.
- Gallo, A., Pérez, F., y Salinas, D. (2021). Minería de datos y proyección a corto plazo de la demanda de potencia en el sistema eléctrico ecuatoriano. Revista Técnica “Energía,” 18(1), 72–85. https://doi.org/10.37116/revistaenergia.v18.n1.2021.461.
- Hannafon, B. N. (2021). Involvement of the Tumor Microenvironment in the Pathogenesis of Breast Cancer. The American Journal of Pathology, 191(8), 1328–1329. https://doi.org/10.1016/j.ajpath.2021.05.012.
- Lahlali, R., Karunakaran, C., Wang, L., Willick, I., Schmidt, M., Liu, X., Borondics, F., Forseille, L., Fobert, P. R., Tanino, K., Peng, G., y Hallin, E. (2015). Synchrotron based phase contrast X-ray imaging combined with ftir spectroscopy reveals structural and biomolecular differences in spikelets play a significant role in resistance to Fusarium in wheat. BMC Plant Biology, 15(1), 24. https://doi.org/10.1186/s12870-014-0357-5.
- Lara Andino, A. R., Sacatoro Toaquiza, J. I., León Vinueza, A. G., Jarrín Trujillo, G. M., y Simancas Malla, F. M. (2024). La evaluación, la inteligencia artificial y otras tecnologías de vanguardia en Educación General Básica Superior. Prometeo Conocimiento Científico, 4(1), e85. https://doi.org/10.55204/pcc.v4i1.e85.
- Liu, S., Thung, K.-H., Lin, W., Yap, P.-T., y Shen, D. (2020). Real-Time Quality Assessment of Pediatric MRI via Semi-Supervised Deep Nonlocal Residual Neural Networks. ieee Transactions on Image Processing, 29, 7697–7706. https://doi.org/10.1109/TIP.2020.2992079.
- Nandiyanto, A. B. D., Ragadhita, R., y Fiandini, M. (2022). Interpretation of Fourier Transform Infrared Spectra (ftir): A Practical Approach in the Polymer/Plastic Thermal Decomposition. Indonesian Journal of Science and Technology, 8(1), 113–126. https://doi.org/10.17509/ijost.v8i1.53297.
- Poggialini, F., Campanella, B., Legnaioli, S., Raneri, S., y Palleschi, V. (2022). Comparison of Convolutional and Conventional Artificial Neural Networks for Laser-Induced Breakdown Spectroscopy Quantitative Analysis. Applied Spectroscopy, 76(8), 959–966. https://doi.org/10.1177/00037028221091300.
- Rohman, A., Ghazali, M. A. B., Windarsih, A., Irnawati, I., Riyanto, S., Yusof, F. M., y Mustafa, S. (2020). Comprehensive Review on Application of ftir Spectroscopy Coupled with Chemometrics for Authentication Analysis of Fats and Oils in the Food Products. Molecules, 25(22), 5485. https://doi.org/10.3390/molecules25225485.
- Saleem, M. A., Senan, N., Wahid, F., Aamir, M., Samad, A., y Khan, M. (2022). Comparative Analysis of Recent Architecture of Convolutional Neural Network. Mathematical Problems in Engineering, 2022, 1–9. https://doi.org/10.1155/2022/7313612.
- Webb-Linares, L. J., Reynoso-Zeballos, G. E., y Lagravere-Vich, M. (2014). Evaluación de la microdureza superficial de una resina compuesta según fuente de luz, su opacidad y tiempo de exposición. Revista Estomatológica Herediana, 19(2), 96. https://doi.org/10.20453/reh.v19i2.1828.
Recepción: 2023/11/16. Aceptación: 2025/01/15. Publicación: 2025/05/09.