Vol. 24, núm. 4 julio-agosto 2023
¡No lo tires, aprovéchalo, es bioeconomía!
Elena Pérez-Urria Carril, Beatriz Pintos López, Rafael Urrialde de Andrés y Arancha Gómez Garay CitaResumen
La humanidad tiene por delante grandes retos, entre ellos producir alimentos y energía para una población mundial de casi 8 mil millones de personas. Esta producción debe ser compatible con el mantenimiento y mejora, si cabe, de los medios y entornos naturales o agrícolas. De no ser así, esos medios se agotarán, se destruirán y no habrá posibilidad de producir nada, materias primas —alimentos, materiales o energía— que sostienen nuestras sociedades. Por otra parte, el sector agroalimentario genera multitud de residuos que pueden ser aprovechados para obtener una variedad de productos de alto valor que pueden ser utilizados en agricultura, alimentación o como materia para generar energía. De aquí nace la necesidad de aprovechar los residuos biológicos, los residuos de la agricultura y la alimentación, y contribuir a mejorar los sistemas de producción. La bioeconomía se presenta como una estrategia para alcanzar esa meta.
Palabras clave: bioeconomía, recursos, residuos, alimentos, energía.
Don’t throw it away, make use of it, it’s bioeconomy!
Abstract
Humanity faces great challenges, including producing food and energy for a world population of almost 8 billion people. This production must be compatible with the maintenance and improvement, if possible, of the natural or agricultural means and environments. Otherwise, those means will run out, they will be destroyed and there will be no possibility of producing anything, raw materials —food, materials or energy— that sustain our societies. On the other hand, the agri-food sector generates a multitude of residues that can be used to obtain a variety of high-value products that can be used in agriculture, food or as a material to generate energy. From here arises the need to take advantage of biological waste, agricultural and food waste, and contribute to improving production systems. The bioeconomy is presented as a strategy to achieve this goal.
Keywords: bioeconomy, resources, waste, food, energy.
Bioeconomía
Qué sostiene nuestras sociedades en cualquier rincón del mundo?, la respuesta es: la economía. Pero hay más, porque hoy se habla de economía, economía circular, bioeconomía y bioeconomía circular. ¿Qué es todo esto?
Economía hace referencia a los sistemas de producción, distribución, comercio y consumo de bienes y servicios de una sociedad o de un país. En ella se ubican los alimentos y la energía, por ejemplo.
¿Y si implementamos la economía circular? Este concepto se basa en mantener el valor de los productos, materiales y recursos durante el mayor tiempo posible, al mismo tiempo que se minimiza la generación de residuos (Comisión Europea, 2020). Implica el uso eficiente de los recursos, lo que nos lleva a un punto crucial: los residuos son en realidad recursos. Algunos ejemplos de esto son el caucho de los neumáticos desechados, que puede ser utilizado para producir un material sustituto del neopreno; los residuos plásticos que pueden ser reutilizados para fabricar ropa; y las pantallas, metales y baterías de los teléfonos móviles que también pueden ser reutilizados.
La bioeconomía implica “utilizar recursos biológicos renovables de la tierra y el mar, como cultivos, bosques, peces, animales y microorganismos para producir alimentos, materiales y energía” (Comisión Europea, 2018). Un ejemplo de esto son los residuos vegetales, como hojas, tallos, cáscaras o pieles, que pueden ser procesados para obtener biocombustibles (bioetanol, biodiésel), biomateriales (sorbentes, fertilizantes biológicos), alimentos para la ganadería, o para extraer compuestos químicos valiosos en industrias como la alimentaria, farmacéutica o textil. Las instalaciones industriales que llevan a cabo este procesamiento de biomasa residual se conocen como ‘biorrefinerías’.
Muchos aspectos de la bioeconomía van más allá de los objetivos de la economía circular, ya que involucran nuevas funcionalidades de productos y servicios, lo que implica mucho más que simplemente mantener el valor de las cosas durante el mayor tiempo posible (Carus y Dammer, 2018). Sin embargo, la bioeconomía también puede ser circular, ya que convierte los residuos en recursos (productos) de alto valor para diversas industrias. La bioeconomía circular tiene tres aspectos y perspectivas fundamentales: económica, social y ambiental, al hacer, rehacer, utilizar, reutilizar y reciclar los recursos biológicos, incluyendo los recursos vegetales.
Recursos y residuos vegetales
Los recursos vegetales —biomasa “verde”—, se generan con base en la capacidad fotosintética de las plantas y algas, esto significa que pueden absorber la luz y transformar esa energía en otra forma de energía, la química, como sacarosa y almidón. La agricultura o la silvicultura producen biomasa que se procesa para obtener alimentos, piensos, energía, biocombustibles, compuestos fitoquímicos1, materiales, en general productos de base biológica. Este procesamiento genera residuos y subproductos que pueden y deben volver a utilizarse, estableciéndose así un círculo de actuaciones y una cadena de valor que maximiza el aprovechamiento de los recursos vegetales, así como de los residuos que se producen revalorizándolos (Ubandoa et al., 2020).
La bioeconomía basada en recursos vegetales produce y procesa biomasa vegetal y presenta un aspecto fundamental característico que la distingue de la economía circular: la innovación, y esta puede dividirse en a) compuestos fitoquímicos y productos con menor toxicidad, nuevas propiedades y funcionalidades, nuevas aplicaciones y más sostenibles, b) alimentación humana y animal, mejora de la calidad alimentaria, nuevos ingredientes alimentarios, alimentos funcionales, c) procesos y procesados más inteligentes, más eficientes, con menor coste energético y menor toxicidad, d) agricultura y silvicultura, incorporación de herramientas y procesos inteligentes que aumentan la eficiencia reduciendo el impacto ambiental negativo, e) energía, bioenergía y biocombustibles.
Por todo lo anterior, se observa que existe una generación de nuevas oportunidades de negocio, de inversión y de empleo fomentando el desarrollo a todos los niveles. La industria agroalimentaria, indica que produce anualmente millones de toneladas de residuos no comestibles derivados del cultivo y de su procesamiento (fao, 2019). Estos residuos, que pueden ser líquidos, sólidos o gaseosos, pueden considerarse los recursos renovables más abundantes y baratos. Son materia prima para ser procesada y convertida en combustibles, energía, materiales, y para extraer compuestos fitoquímicos de alto valor en la industria alimentaria, farmacéutica, cosmética y química (figura 1).
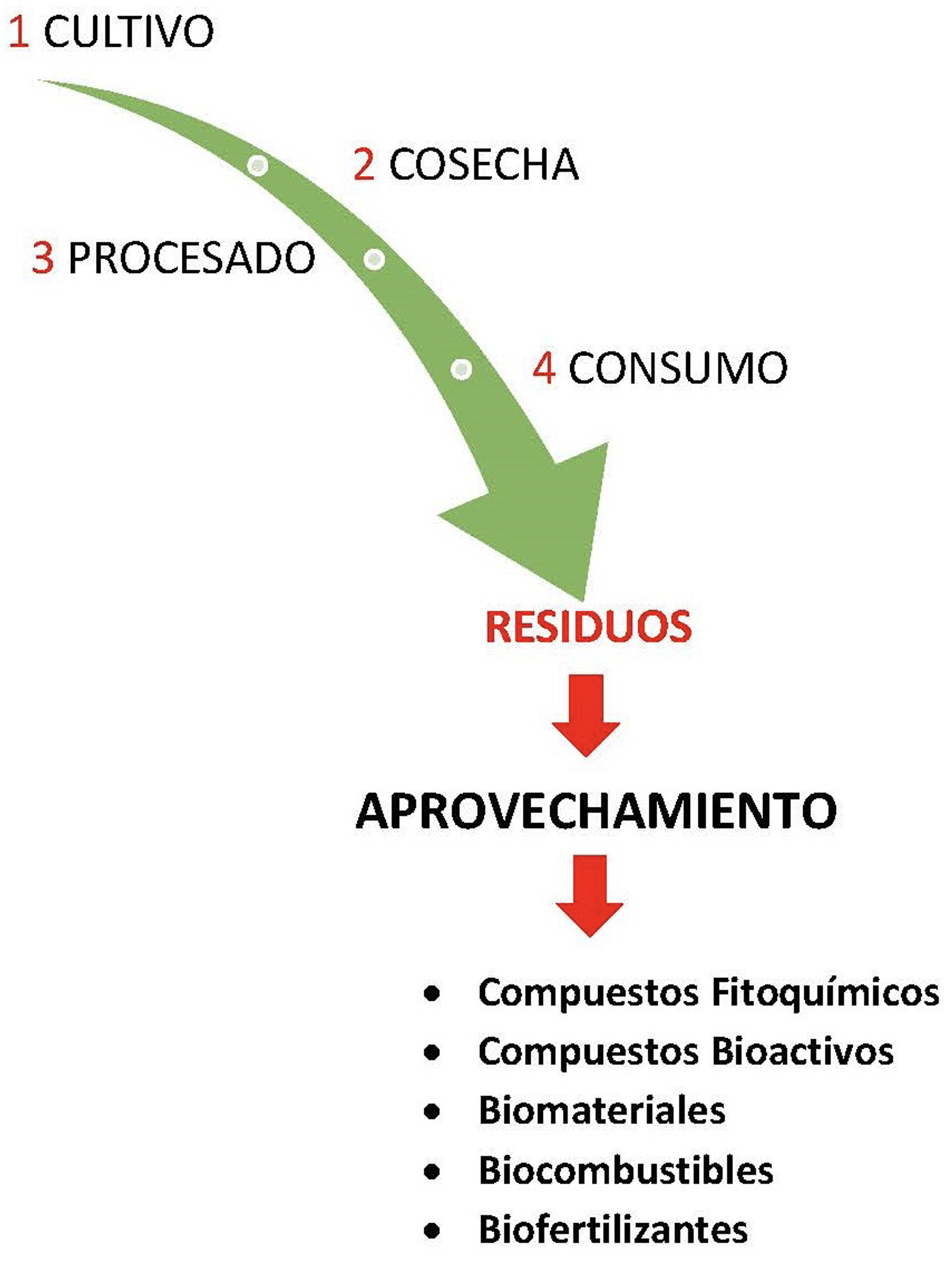
Figura 1. Esquema de la cadena productiva agroalimentaria. Las etapas de cosecha, procesado y consumo generan residuos que se pueden aprovechar para obtener productos de alto valor. Crédito: elaboración propia.
Unos residuos derivan directamente de los cultivos, son residuos primarios o biomasa primaria como paja, rastrojo, tallos, hojas, raíces, ramas, recortes y podas, que proceden del cultivo de plantas alimentarias y de cultivos para energía. Otros residuos, que pueden denominarse agroindustriales, proceden del procesamiento de los anteriores y serían despojos secundarios o biomasa secundaria. Las cáscaras, el orujo, pieles o todos los desechos de frutos que se exprimen para obtener jugos son residuos agroindustriales.
Lo importante de todo esto es que los desechos, primarios o secundarios, tanto a nivel doméstico como a escala industrial, presentan una composición fitoquímica de extraordinario valor e importancia industrial: son la materia prima para nuevos productos.
Buen ejemplo de ello es la conversión de restos agroalimentarios en bioplásticos producidos a partir de las fibras o polímeros naturales presentes en residuos de frutos como manzana, banana, yuca, cítricos, cacao o maní (Acquavia et al., 2021). Materias como las anteriores también puede contener grandes cantidades de fitonutrientes o compuestos bioactivos2 de valor nutracéutico que presentan una amplia gama de bioactividades. Los compuestos bioactivos aislados de residuos o subproductos de frutas y verduras incluyen principalmente polifenoles, taninos, flavonoides, flavanoles, vitaminas (A y E), minerales esenciales, ácidos grasos, volátiles, antocianinas o pigmentos.
La revalorización de estos desechos y subproductos contribuye además a minimizar la generación de los mismos y a cumplir con el concepto “residuos cero”. Por otra parte, el concepto de biorrefinería se refiere a esta cadena de procesos que utilizando residuos rinde compuestos y productos de interés en los campos de la alimentación y la energía, aditivos, complementos alimentarios, bioetanol o bioplásticos, por citar algunos ejemplos (Ben-Othman et al., 2020) (ver figura 1).
La producción y la demanda de alimentos, el cambio de fuentes de energía fósiles por energías renovables, la bioenergía, la recuperación del medio ambiente, la fertilidad de los suelos y la pérdida de biodiversidad son cuestiones que deben tenerse en cuenta en un nuevo contexto: el de la bioeconomía. Esta se entiende como una necesidad y una oportunidad, ya que se aprovechan todos los componentes de la biomasa vegetal para generar una amplia gama de bioproductos. Este mercado —que ya está conformado y en constante expansión—, abarca industrias como la alimentaria, farmacéutica, química y energética. Para alimentar los procesos productivos de estas empresas, es necesario establecer sinergias y asociaciones entre diferentes sectores industriales, utilizando los residuos como materia prima.
De esta manera, se establecen sinergias entre el sector agrícola o la industria alimentaria y las biorrefinerías mencionadas anteriormente. Los residuos agrícolas o los residuos de la industria alimentaria, como las pieles de cítricos o las cáscaras de frutos secos, por ejemplo, se convierten en materia prima para las plataformas industriales que los procesan para producir bioenergía, biomateriales y para extraer compuestos fitoquímicos y bioactivos..
Como se mencionó anteriormente, las actividades en el seno de la bioeconomía tienen tres aspectos fundamentales: ambiental, social y económico, y por ello constituye una estrategia a seguir en respuesta a los retos que la humanidad debe enfrentar para construir un futuro “habitable”. La figura 2 muestra un cuadro en el que se justifican de manera resumida estos aspectos.

Figura 2. Justificación de los aspectos económico, ambiental y social de la bioeconomía. Crédito: elaboración propia.
También constituye una oportunidad para el emprendimiento que busca y persigue oportunidades más allá de los recursos limitados, porque afronta los retos en la medida en que responde a necesidades de tipo ambiental, social y económica, respuestas basadas en el conocimiento, en la ciencia y en la tecnología, respuestas que deben ser realmente innovadoras (figura 3).
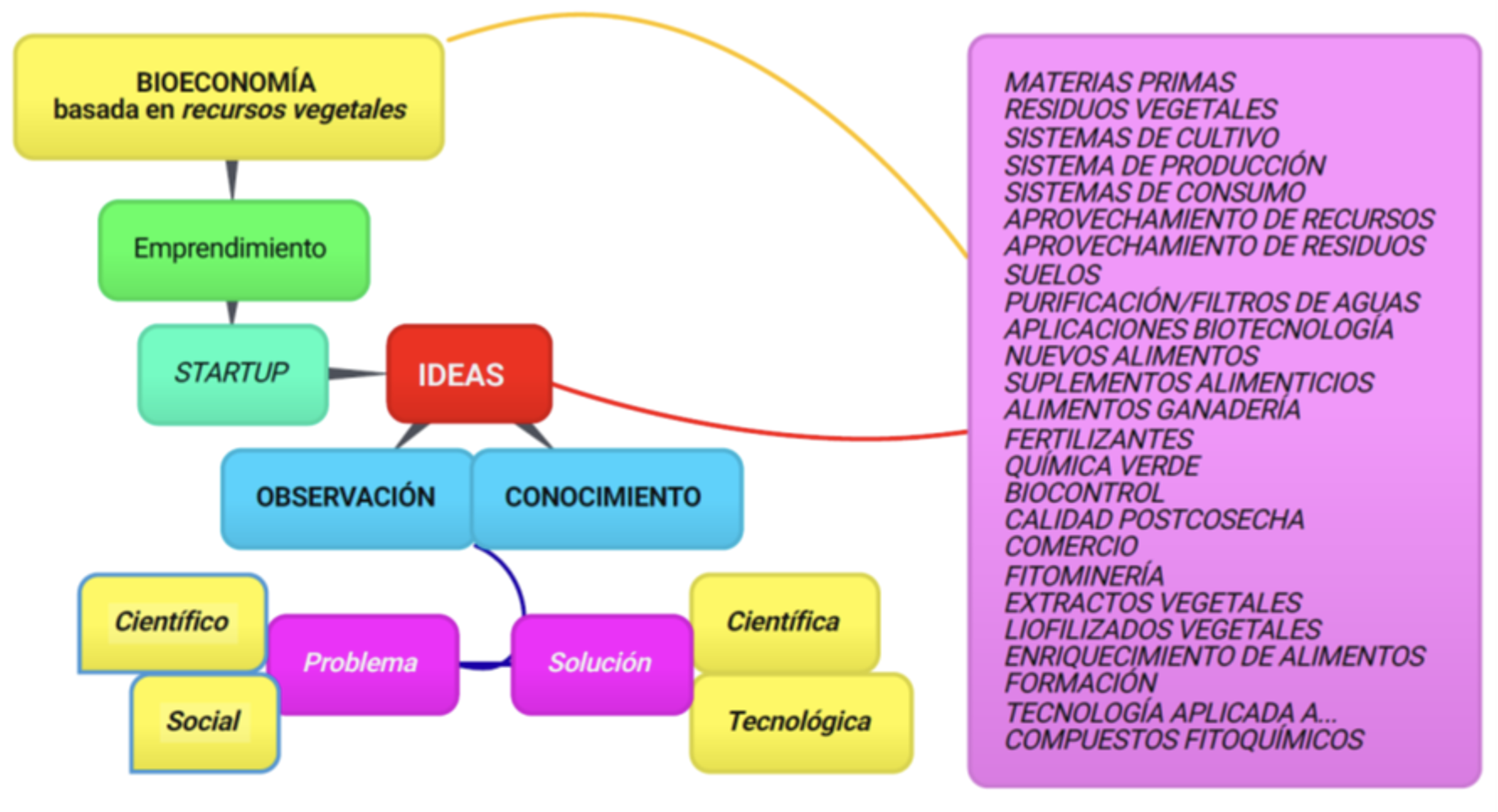
Figura 3. La bioeconomía como oportunidad de negocio con indicación de algunos campos de actuación. Crédito: elaboración propia.
En el mundo de los negocios y las empresas, especialmente en el ámbito de la innovación y la tecnología, se forman sociedades donde jóvenes con recursos limitados logran obtener resultados en el mercado y avanzar al siguiente nivel. Estas empresas, conocidas como startups, se refieren a emprendimientos recién creados con potencial de crecimiento en el campo de la biotecnología, generalmente vinculadas a tecnologías de la información. Su actividad se basa en la aplicación de descubrimientos científicos y tecnológicos para generar nuevos productos, procesos o servicios. Por lo general, tienen un alto grado de innovación, que no necesariamente está relacionado con la complejidad, y surgen de los resultados de investigaciones científicas y tecnológicas. Algunos ejemplos de estas empresas en el ámbito de la bioeconomía son: Bio Lutions, Blu Wrap, Ch4 Global, Bionatural Solutions, Biofase, Cellucomp, Full Circle Textiles, Lignopure, Bioon, Kriya Labs, Biofiltro: Cantábrica Agricultura Urbana y Jardines del Aire.
Conclusión
El trabajo colaborativo es importante en todos los niveles: local, regional y nacional, y tiene beneficios a nivel global para hacer frente a los desafíos ambientales, sociales y económicos que surgen de la producción y consumo de alimentos, así como de la generación continua de residuos agroalimentarios. Estas dos acciones pueden y deben llevarse a cabo desde la perspectiva de la bioeconomía. Para abordar los desafíos del mundo actual y futuro, es necesario promover la educación y la formación, divulgar la ciencia, fomentar la colaboración entre los sectores público y privado, así como la cooperación internacional, con el fin de impulsar la investigación, el desarrollo y la implementación de soluciones basadas en la bioeconomía.
Además, el desarrollo de comunidades y países debe ser compatible con acciones que mitiguen el cambio climático en áreas como la industria, la energía, el transporte, la agricultura y los ecosistemas. Solo de esta manera se logrará transformar y mejorar las sociedades, la vida de las personas y el mundo en el que vivimos.
Referencias
- Acquavia, M.A., Pascale, R., Martelli, G, Bondoni, M., y Bianco, G. (2021). Natural Polymeric Materials: A Solution to Plastic Pollution from the Agro-Food Sector. Polymers, 13, 158. https://doi.org/10.3390/polym13010158
- Ben-Othman, S., Jõudu, I., y Bhat, R. (2020). Bioactives from Agri-Food Wastes: Present Insights and Future Challenges. Molecules, 25, 510 http://dx.doi.org/10.3390/molecules25030510
- Carus, M., y Dammer, L. (2018). The “Circular Bioeconomy” – Concepts, Opportunities and Limitations [Nova paper #9 on bio-based economy 2018-01]. https://renewable-carbon.eu/publications/product/nova-paper-9-the-circular-bioeconomy-concepts-opportunities-and-limitations-%E2%88%92-full-version/
- Comisión Europea. (2018). Bioeconomía. https://n9.cl/5m6so
- Comisión Europea. (2020). Nuevo Plan de acción para la economía circular. https://ec.europa.eu/commission/presscorner/detail/es/ip_20_420
- fao. (2019). The state of Food and agriculture. https://www.fao.org/3/ca6030en/ca6030en.pdf
- fao. (2022). Sistemas Alimentarios. https://www.fao.org/food-systems/es/
- Ubandoa, A. T, Felix, C. B., y Chena, W. H. (2020). Biorefineries in circular bioeconomy: A comprehensive review. Bioresource Technology, 299, 122585. https://doi.org/10.1016/j.biortech.2019.122585
Recepción: 26/07/2022. Aceptación: 16/05/2023.