Vol. 23, núm. 2 marzo-abril 2022
Bosques vemos, diversidad de frutos no sabemos: fotografías que delatan
José Miguel Romero-Saritama CitaResumen
Con el avance de la ciencia y la tecnología, la fotografía digital es una herramienta indispensable en las labores de campo y laboratorio en las ciencias naturales. La fotografía nos permite documentar, evidenciar y validar información. Asimismo, ayuda a acercarnos visualmente a realidades y a estructuras vegetales escondidas en los bosques tropicales. Por esta razón, en este trabajo mostramos a la fotografía como un instrumento práctico para explorar de forma rápida la diversidad morfológica de frutos de especies leñosas en un bosque montano del sur del Ecuador, ecosistema altamente biodiverso y poco conocido a nivel mundial. A través de registros fotográficos, se identificó, midió y catalogó la variedad de formas, colores y tamaños de los frutos en el bosque. Estos resultados nos permiten valorar, desde un enfoque más ilustrativo, la diversidad de estructuras vegetales presente en los ecosistemas montanos.
Palabras clave: bosques tropicales, diversidad de frutos, fotografía digital, frutos forestales, rasgos morfológicos.
Forests we see, diversity of fruits we do not know: photographs that reveal
Abstract
With the advancement of science and technology, digital photography is an indispensable tool in field and laboratory work in Natural Sciences. Photography allows us to document, evidence, and validate information. Likewise, it helps us approach realities and plant structures, hidden in tropical forests, in a visual manner. For this reason, in this work, we show photography as a practical instrument to quickly explore the morphological diversity of fruits of woody species in a montane forest in southern Ecuador, a highly biodiverse ecosystem, little known worldwide. Using photography, it was possible to identify, measure and catalog the variety of shapes, colors, and sizes of the fruits in the forest. These results allow us to assess with a more illustrative approach the diversity of plant structures present in montane ecosystems.
Keywords: tropical forest, fruits diversity, digital photography, forest fruits, morphological traits.
Introducción
Desde su invención, en 1839, la fotografía ha ido adquiriendo una importancia cada vez mayor en todos los ámbitos de la sociedad y de la ciencia (Grilli et al., 2014). Actualmente, la fotografía digital, por su alta disponibilidad y accesibilidad mediante un celular inteligente o una cámara fotográfica, se ha convertido en un recurso utilizado prácticamente a diario en todos los campos del saber.
Gracias a las imágenes fotográficas, hoy en día sabemos de realidades que muchas veces son desconocidas, han pasado inadvertidas o, lamentablemente, ya no existen en el mundo natural. A medida que se perfeccionan los procedimientos fotoquímicos para captar y fijar imágenes, la fotografía se convierte en una herramienta insustituible de la investigación y la divulgación científica (Galvez, 2017).
En las ciencias biológicas, los que hemos realizado trabajo de campo, recolectado y analizado muestras botánicas, podemos dar fe de la importancia de contar con una cámara fotográfica, ya que ésta nos permite desde documentar el trabajo realizado y registrar en una imagen diversas estructuras vegetales (que posteriormente sirven para generar nueva información), hasta congelar en un momento la belleza escénica que nos presenta la madre naturaleza. No obstante, para aquellas personas con intereses distintos al quehacer científico, una cámara fotográfica puede significar el medio para captar sólo lo que sus ojos les permiten ver, dejando de lado la diversidad de componentes vegetales que encontramos en los bosques. Esto último es comprensible porque muchas de las estructuras vegetales están alejadas de la vista humana o no representan gran interés fotográfico debido al desconocimiento sobre su diversidad e importancia ecológica.
Ante lo mencionado, el objetivo del presente trabajo es denotar la importancia de la fotografía como una herramienta para captar estructuras vegetales que pasan desapercibidas para la vista humana, como son los frutos de especies leñosas dentro de un bosque húmedo tropical. Asimismo, la idea es mostrar cómo las imágenes captadas por una cámara fotográfica nos permiten conocer y medir aspectos morfológicos de los frutos, al tomar como referencia aquellas especies que encontramos en un bosque montano en el sur del Ecuador. Por lo tanto, para empezar este recorrido de información sobre la fotografía y los frutos, primeramente, es menester hacer referencia a lo que son los bosques.
Los bosques, más que lindas plantas
Cuando pensamos en un bosque, o si nos preguntan ¿qué es un bosque?, inmediatamente se nos vienen a la mente muchos árboles de distintas formas y tamaño, de color verde, colocados en una montaña (ver figura 1a), o al menos eso nos hacían pensar en la escuela, aunque ese pequeño concepto no está tan alejado de la realidad. En un sentido más técnico, podemos mencionar que un bosque es todo un ecosistema natural; es decir, un lugar donde predominan árboles y arbustos, que conviven en toda una red de interacciones entre plantas, animales y muchos otros organismos (ver figura 1b). Por lo tanto, un bosque es, en realidad, mucho más de los que nuestros ojos ven.
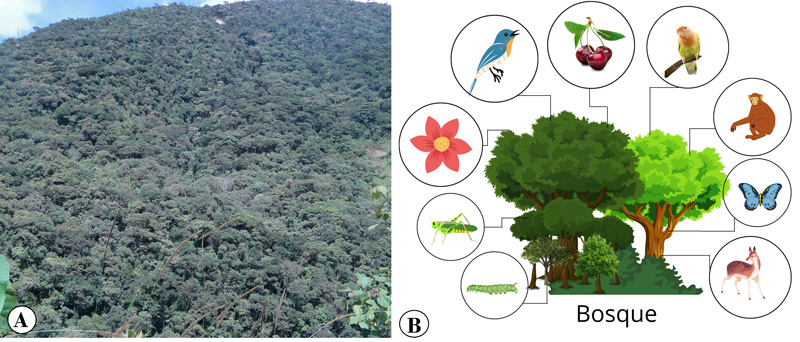
Figura 1. Vista de lo que vemos de bosque versus lo que existe en realidad. A) Fotografía de un bosque natural. B) Representación de la diversidad de organismos y componentes en un bosque.
A nivel mundial podemos encontrar diferentes tipos de bosque, que se clasifican según su ubicación en nuestro planeta y en función de las condiciones ambientales que predominan en ellos. En forma muy general, podemos encontrar los bosques tropicales y bosques subtropicales, muy familiares para quienes habitamos en Sudamérica y Centroamérica, y los bosques templados y el bosque boreal en el norte del planeta. Si bien los bosques del mundo poseen sus propias características que los diferencian entre sí, comparten un común denominador muy desafortunado y terrorífico: todos están bajo amenaza, pues pierden un área aproximada a 27 campos de futbol por minuto, sobre todo en la zona tropical (wwf, 2019).
Acabar con nuestros bosques no sólo supone atentar contra la vida de los animales y plantas, como muchas de las veces nos hacen pensar, sino también poner en riesgo nuestra propia existencia. Los bosques, como ya se comentó, son una red de interacciones de las cuales dependen miles de organismos que habitan dentro o fuera de él. Además, nos ayudan a regular el clima mundial, son un cúmulo de servicios ambientales y una fascinante farmacia natural.
Pero volviendo a nuestro tema principal, la gala de diversidad de especies que presentan nuestros bosques también está expresada en la variedad morfológica de cada uno de los componentes que constituyen a las plantas. Entre dichos componentes están sus frutos.
Frutos de especies forestales
Si pensamos en los árboles y arbustos que dominan los bosques, es fácil imaginar cómo están compuestos. Basta recordar las enseñanzas de los profesores de ciencias naturales en la escuela: —La raíz, tallo, hojas, flores y frutos son las partes de las plantas —nos decían. Pero, en realidad, ¿qué tan fácil es observar todas esas estructuras en un bosque? En especial cuando los árboles pueden llegar a medir entre 20 y 30 metros de altura y se interconectan entre ellos. Si recorremos un bosque nos daremos cuenta de lo fácil que es para nosotros observar los tallos, hojas e incluso las flores, pero es difícil percatarse claramente de los frutos, debido al frondoso follaje de los árboles; sin embargo, para las aves o mamíferos frugívoros, los frutos en su fase madura sin duda alguna no pasan desapercibidos.
Desde un punto de vista botánico, los frutos son órganos de las plantas que se desarrollan posterior a la fecundación de las flores, donde, luego de varios procesos metabólicos, las paredes del ovario se transforman en el fruto. Estas estructuras cumplen un rol fundamental en los ecosistemas: son alimento para animales, contienen y protegen a las semillas, y en muchos de los casos son el vehículo que facilitan la dispersión de las semillas en el tiempo y el espacio. No obstante, para el ser humano generalmente, los frutos en el bosque permanecen en el anonimato.
La fotografía y su importancia en las ciencias forestales
La fotografía es una herramienta multidisciplinaria que nos ha permitido conocer detalles de estructuras o fenómenos que antes desconocíamos, y que, además, puede transformar en verdaderas obras de arte estructuras atómicas o galaxias (inecol, 2021). Es así como las imágenes captadas por una cámara se convierten en un documento autentificador de primera magnitud, dotado de un alto valor testimonial (Pantoja Chaves et al., 2016), y con funciones tales como respaldar, obtener y apoyar información existente, para presentar resultados en una investigación (De las Heras, 2015; Grilli et al., 2015).
En el campo de las Ciencias Forestales, estoy seguro de que aquel que haya visitado un bosque siempre tendrá un recuerdo de una planta o parte de ella, grabado en una imagen captada por una cámara fotográfica o de celular. Para los que estamos involucrados en el quehacer científico o de divulgación, la fotografía es una herramienta indispensable que nos permite observar el entorno más allá del alcance de nuestros ojos. Asimismo, sobre las imágenes captadas podemos medir diferentes elementos como el crecimiento de hojas, tamaños y formas de semillas, cálculos de áreas, análisis de cobertura vegetal, entre otras estructuras (Rincón et al., 2012; Romero-Saritama y Draper, 2017). Es por ello que las imágenes fotográficas han acompañado a muchos escritos científicos de botánica en general (Grilli et al., 2014), y han contribuido a la divulgación de la ciencia en diferentes documentos técnicos (inecol, 2021).
Por otro lado, la fotografía puede convertirse es un recurso didáctico funcional para la enseñanza de las ciencias botánicas, ya que los estudiantes, mediante fotografías tomadas por ellos mismos o por los docentes, pueden explorar, describir y medir todos los elementos captados en la imagen. Así lo demuestran Cabrera, Armijos y Romero-Saritama (2019), quienes dentro de una asignatura utilizaron imágenes fotográficas de frutos de dos especies de un páramo ecuatoriano para identificar y medir diferentes rasgos morfológicos.
¿Cómo la fotografía puede ayudar a conocer la diversidad de frutos?
Para muestra basta un botón, dice un refrán muy popular. En tal sentido, en esta sección, para ejemplificar a la fotografía como una herramienta para conocer la diversidad de frutos de especies leñosas, tomaremos como ejemplo el trabajo realizado por Valarezo y Romero-Saritama (2021). Éste inició como una tesis de pregrado y posteriormente se convirtió en un libro publicado en físico por la Universidad Técnica Particular de Loja (utpl).
El trabajo mencionado se ofertó dentro de la carrera en Gestión Ambiental de la utpl con el tema Guía fotográfica de frutos y semillas de especies leñosas de un bosque montano al sur del Ecuador. Parte de la materia consistió en tomar fotografías de esas dos estructuras (frutos y semillas) de diferentes especies de árboles y arbustos, distribuidos en un bosque montano o también denominado bosque nublado, que forman parte de la zona tropical, presentan altos grados de humedad y pasan el mayor tiempo escondidos bajo la neblina, de allí su nombre. A los bosques montanos también los podemos encontrar en Venezuela, Colombia, Perú y Bolivia, a 1500 metros sobre el nivel del mar (Bruijnzeel et al., 2011).
El objetivo del trabajo fue identificar la variedad de frutos y semillas presentes en el bosque, que hasta ese momento no se había identificado mediante registros fotográficos. El desarrollo fue como sigue: se programaron salidas de campo en función de la fructificación de las especies. Luego, usando una cámara Nikon D5200 se tomaron diferentes fotografías de los frutos. Una muestra de las imágenes se presenta en la figura 2, donde ya se puede apreciar la diversidad de los frutos en el bosque mediante registros fotográficos. Aquí es importante mencionar que en los bosques montanos existe un reto de investigación, desde el punto de vista de la observación y recolección de muestras botánicas, debido a la altura de las plantas, y a la estructura y composición del bosque. Ante esta situación, la fotografía se convierte en una herramienta para acercarnos visualmente a las estructuras vegetales sin necesidad de colectarlas.

Figura 2. Diversidad de frutos en un bosque montano del sur del Ecuador, captados mediante fotografías. A) Vismia tormentosa. B) Miconia sp. C) Ocotea oblonga. D) Miconia quadripora. E) Cedrela montana. F) Heliocarpus americanus. G) Orepanax microflorous. H) Solanum sp. I) Palicourea calycina. J) Lycianthes sp. K) Spirotheca rosea. L) Clethra fagifolia. M) Tournefortia hirsutissima. N) Palicourea stenosepala. O) Varios tipos frutos del bosque montano. Créditos: Valarezo y Romero-Saritama (2020).
Posteriormente, con las imágenes captadas se generó una base digital (fototeca) y se seleccionaron las mejores fotografías de cada especie, que fueron utilizadas para identificar el color, forma y tipo de fruto, y se usaron para medir el largo, ancho y grosor. La secuencia del proceso realizado se muestra en la figura 3. La herramienta para medir los frutos en las imágenes fue el programa de acceso libre ImageJ, muy utilizado en diferentes estudios morfológicos vegetales.
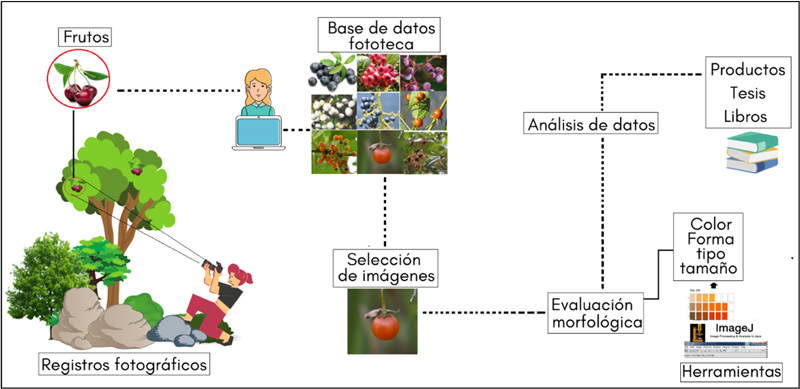
Figura 3. Representación del proceso metodológico para identificar la diversidad de frutos mediante la fotografía digital.
Con las imágenes de los frutos y mediciones realizadas, se logró evidenciar la diversidad de frutos del bosque en estudio. Este trabajo conllevó a la escritura del libro titulado Frutos y semillas de bosque montano del Sur del Ecuador, donde se refleja por primera vez la diversidad de los frutos del bosque montano, mediante registros fotográficos.
A manera de conclusión
En ecosistemas tropicales, donde puede resultar un reto la recolección directa de frutos para fines de investigación, la fotografía digital nos permite hacer una aproximación rápida de la diversidad de esas estructuras vegetales, sin tener la necesidad de bajarlas de las plantas, una actividad que puede conllevar mucho tiempo. Además, la fotografía nos ayuda a mantener fijos los elementos que caracterizan a los frutos, lo que permite medirlos y evaluarlos en cualquier momento y lugar, sin temor a que se pierdan por daño en su morfología, lo que sí podría ocurrir cuando se trabaja sobre frutos recolectados. Finalmente, la fotografía es una herramienta práctica que se puede utilizar como estrategia para divulgar información científica desconocida de nuestros bosques tropicales.
Referencias
- Bruijnzeel, L., Scatena, F., y Hamilton, L. (2011). Tropical montane coud forests: Science for conservation and management. Cornell University.
- Cabrera, A. P., Armijos, N., y Romero-Saritama, J. M. (2019). Rasgos Morfológicos de frutos y su incidencia en la conservación ex situ de dos especies de páramo en el Sur del Ecuador. Investiga utpl, 393-397.
- De las Heras, B. (2015). Testimoniando con imágenes. La fotografía en el estudio de la historia. Fotocinema. Revista científica de cine y fotografía, 10, 27-55. https://doi.org/10.24310/Fotocinema.2015.v0i10.5978.
- Gálvez Díaz, V. (2017). La fotografía científica. Historia y vínculo con la divulgación. Revista Digital Universitaria, 18(5), 1-17. http://www.revista.unam.mx/vol.18/num5/art36/index.html.
- Grilli, J., Laxague, M., y Barboza, L. (2014). Dibujo, fotografía y Biología. Construir ciencia con y a partir de la imagen. Revista Eureka sobre Enseñanza y Divulgación de las Ciencias, 12(1), 91-108. https://revistas.uca.es/index.php/eureka/article/view/2904.
- inecol. (2021, 2 de diciembre). La fotografía científica: el arte de la comunicación. https://cutt.ly/ZAYmePZ.
- Pantoja Chaves, A., Soto Vázquez, J., y Galea, E. (2016). La fotografía escolar como fuente para la investigación educativa. La Fototeca Digital Escolar de Extremadura. Educació i Història: Revista d’història de l’educació, 28, 229–254. https://dialnet.unirioja.es/servlet/articulo?codigo=5644535.
- Rincón Guerrero, N., Olarte Quintero, M. A., y Pérez Naranjo, J. C. (2012). Determinación del área foliar en fotografías tomadas con una cámara web, un teléfono celular o una cámara semiprofesional. Revista Facultad Nacional de Agronomía-Medellín, 65(1), 6399-64050. https://doi.org/10.15446/rfnam.
- Romero-Saritama, J .M., y Draper, D. (2017). Almacenamiento y morfología de semillas; especies distribuidas en el Sur del Ecuador. Ediloja Cía. Ltda. Universidad Técnica Particular de Loja.
- Valarezo, T., y Romero-Saritama, J. M. (2020). Frutos y semillas de bosque montano Sur del Ecuador. Ediloja Cía. Ltda. Universidad Técnica Particular de Loja.
- World Wildlife Fund (wwf). (2019, 1 de diciembre). Cuatro tipos de bosques: conoce las diferencias. https://cutt.ly/FAYmLMC.
Recepción: 14/12/2021. Aprobación: 23/02/2022.