Vol. 22, núm. 2 marzo-abril 2021
Transición de la educación media superior a la educación superior: estudio en la UNAM
Melchor Sánchez Mendiola, Careli Johana Herrera Penilla, Enrique Ricardo Buzo Casanova, Manuel García Minjares, Marypaola Janett Maya López y Adrián Martínez González CitaResumen
La Universidad Nacional Autónoma de México (unam) posee una matrícula diversa y vasta. En el contexto de una institución de Educación Media Superior (ems) y Educación Superior (es), el seguimiento de las trayectorias escolares de sus estudiantes, al considerar la transición entre estos niveles educativos, es una valiosa herramienta que permite identificar de manera precisa y adecuada, las necesidades de acompañamiento que se requieren a fin de abatir el abandono y el rezago escolar. En este estudio se explora el desempeño escolar y la eficiencia terminal de los estudiantes de la generación 2009 del bachillerato de la unam (enp y cch), durante su paso por dicho nivel educativo, así como su interrelación con el desempeño escolar y la regularidad durante el primer año de la licenciatura.
De un total de 34 070 estudiantes, el análisis de sus trayectorias escolares durante la ems presentó abandono y rezago considerables, además de una baja eficiencia terminal (56.6%). Asimismo, se observa que uno de cada cuatro estudiantes que ingresa al bachillerato de la unam y lo concluye, es regular al término del primer año de la es. Derivado de estos resultados se hace evidente la importancia de seguir realizando este tipo de estudios, a fin de identificar de manera precisa las necesidades existentes dentro de estos niveles educativos en la unam, así como la inminente necesidad de desarrollar e impulsar estrategias institucionales que permitan amortiguar el impacto que genera la transición de la ems a la es en los estudiantes.
Palabras clave: trayectoria escolar, desempeño académico, rezago escolar, eficiencia terminal, abandono escolar, educación media superior, educación superior.
Transition from secondary to higher education: a study at UNAM
Abstract
The National Autonomous University of Mexico (unam) has a diverse and substantial student body. In the context of an institution of Upper Secondary Education and Higher Education, the monitoring of the school trajectories of its students, considering the transition between these educational levels, is a valuable tool that allows to accurately and adequately identify the support needs that students require in order to reduce school dropout and lag. This study explores the school performance and terminal efficiency of students from the 2009 generation of the unam baccalaureate (enp and cch), during their passage through these educational levels, as well as their correlation with school performance and regularity during the first year of Higher Education.
Of a total of 34 070 students, the analysis of their school trajectories during Upper Secondary Education showed considerable dropout and lag, in addition to a low terminal efficiency (56.6%). Likewise, one in four students, who entered the unam baccalaureate and completed it, were regular at the end of the first year of Higher Education. These results highlight the importance of carrying out this type of studies, in order to accurately identify the needs in these educational levels at unam, as well as the imminent need to develop and promote institutional strategies that allow to reduce the impact of the transition from Upper Secondary Education to Higher Education.
Keywords: educational trajectory, academic performance, educational delay, terminal efficiency, dropout, upper secondary education, higher education.
Introducción
La transición escolar como tema de investigación surgió entre las décadas de los años 60 y 70 del siglo pasado, debido a las altas tasas de abandono y rezago que se presentaban en la población estudiantil y a las exigencias sociales de contar con una formación de calidad (Álvarez, Figuera y Torrado, 2011). Al inicio, cuando se hablaba de abandono y rezago, se pusieron a consideración factores de índole personal y social, como el entorno familiar, las características personales, el nivel de compromiso con los estudios y el manejo de relaciones con las personas del medio, además de los factores institucionales. Como estrategias remediales para disminuir y abatir estos fenómenos, se crearon programas vinculados con orientación académica y personal para los estudiantes: tutorías, grupos de apoyo, talleres y seminarios para fomentar y fortalecer estrategias de aprendizaje y técnicas de estudio, platicas inductivas para los estudiantes que pasaban de un nivel a otro, entre otras. También comenzaron a surgir áreas de atención específicas para grupos de estudiantes que requerían un seguimiento más continuo y personalizado, sobre todo en las instituciones de nivel superior.
Sin embargo, según Tinto (1989), dichos programas no tuvieron el impacto esperado debido a la falta de mejora en las prácticas de enseñanza y evaluación del profesorado, dentro de las aulas. Aunque al inicio de la década de los 80 ya se habían puesto en marcha investigaciones sobre el seguimiento de los estudiantes —con claridad en los conceptos y variables significativas que inciden en el éxito o fracaso académico—, se hizo imperativo contar con datos de índole cuantitativo más objetivos y precisos, que pudieran ampliar el panorama acerca de la ruta de los estudiantes y de la incidencia de otro tipo de factores en su desempeño escolar. Con esto surgió la necesidad de realizar estudios sistemáticos y longitudinales a largo plazo, a partir del estudio de cohortes reales, que pudieran arrojar datos estadísticos que evidenciaran de forma objetiva la vinculación entre los factores de índole socioeconómico y académico.
Aunado a lo anterior se comenzaron a realizar estudios de este tipo, pero para observar la transición de los estudiantes entre el nivel medio superior y superior, desde diversas perspectivas, pues en ella inciden factores económicos, familiares, culturales, sociales, institucionales, entre otros. Diversos estudios apuntan a que este proceso es complejo, amplio y dinámico, debido a los cambios inherentes, que requieren de diversos esfuerzos para lograr una pronta adaptación a los nuevos espacios, docentes, pares, gestiones administrativas, administración del tiempo, contenidos, entre otras cuestiones (Pérez et al., 2011).
En México los estudios de este tipo en las instituciones de educación media superior y superior, actualmente son una parte fundamental de los procesos de evaluación, acreditación y certificación de planes de estudio y programas, pues es a través de ellos que las instituciones realizan un análisis de los resultados de diversas modificaciones a dichos documentos, con la finalidad de resaltar aciertos y áreas de oportunidad.
De manera casi personalizada, dichos estudios permiten identificar y construir perfiles de estudiantes que requieren cierta atención en particular, así como incentivar a aquellos que cursan de manera óptima el nivel educativo en el que se encuentran inscritos. También, a partir de la necesidad de realizar estos análisis, se ha fomentado y fortalecido una cultura de la obtención, almacenamiento, organización y manejo de grandes cantidades de datos acerca de los estudiantes, lo que ha permitido realizar una planeación escolar más certera y una adecuada administración de los recursos educativos. A su vez la necesidad de contar con datos más objetivos acerca de los estudiantes ha estimulado la necesidad de generar instrumentos como exámenes estandarizados, cuestionarios de ingreso, encuestas de opinión, portafolios de evidencias, entre otros.
Entre las ventajas que este tipo de análisis ofrece están identificar el desempeño escolar de los estudiantes; recabar y generar información institucional, que sirva de base para otras investigaciones y para la rendición de cuentas; comparar el progreso escolar de manera interna en instituciones de educación superior (es), entre escuelas y facultades, o bien de manera externa entre universidades y diferentes planes de estudio, e identificar perfiles de estudiantes para encauzar los recursos adecuados y necesarios para la resolución de sus problemáticas.
La Universidad Nacional Autónoma de México (unam) realiza desde hace ya varios años este tipo de análisis y cuenta con dos subsistemas de Educación Media Superior (ems). Por ello, tiene la posibilidad de revisar de manera más minuciosa la transición de sus estudiantes, ya que la información escolar y de registro se concentra en un solo historial académico y es posible realizar un seguimiento de la trayectoria de manera independiente, así como del proceso de transición entre un nivel y otro dentro de la institución.
Los dos subsistemas de ems con los que cuenta la unam son la Escuela Nacional Preparatoria (enp) y el Colegio de Ciencias y Humanidades (cch). La primera fue creada en el año de 1867 (Loyo, 2010) y su objetivo es impartir una formación cultural, un desarrollo integral y sobre todo una capacitación para continuar con estudios profesionales (unam, 2014). El segundo fue creado en el año de 1971 y tiene por objetivo brindar una formación más encaminada hacia la compaginación de los estudios académicos con una capacitación práctica, que dote al bachiller de los conocimientos y las habilidades necesarias para que al término de este ciclo formativo, además de continuar con sus estudios superiores, pueda insertase en el ámbito laboral y desempeñe actividades en la producción de bienes y servicios necesarios para la sociedad mexicana (unam, 2014). Aunque cada plan de estudios cuenta con sus particularidades, el objetivo fundamental de la unam, a través de estos dos subsistemas, es que los estudiantes al término de la ems cuenten con las capacidades y conocimientos necesarios para ingresar, permanecer y concluir de manera óptima una carrera universitaria.
Actualmente la unam recibe, año con año, dentro de todas sus escuelas y facultades, a estudiantes egresados de estos dos subsistemas de bachillerato para que realicen estudios de nivel licenciatura. En este sentido, el último año de ems es determinante, pues para cursarlo los estudiantes deben elegir el área de conocimiento en la cual se encuentra la licenciatura de su preferencia.
Para fines del presente trabajo, la transición entre la ems y la es se entiende como el conjunto de fases que viven los estudiantes en un determinado espacio de tiempo, que da inicio en el momento de culminación de la ems y hasta finalizar el primer año de los estudios de la es (Pérez et al., 2011). El indicador que da cuenta de este proceso de transición es el desempeño escolar, y algunos de los indicadores de éste pueden ser el promedio general de calificaciones al concluir el primer semestre o año, el promedio de una asignatura en específico, la permanencia dentro del programa académico, los resultados en exámenes o pruebas estandarizadas, entre otros. Aquí el desempeño escolar será entendido según Cascón (2000), como la obtención y acumulación de créditos por parte del estudiante al concluir determinado ciclo formativo. En el caso de la ems al término de lo estipulado dentro de sus respectivos planes de estudio, y en el de la es, hasta el término del primer año. Autores como Tinto, Camarena, Martínez, Cornejo, Liberio y Hernández (Fernández, Peña y Vera, 2006) son algunos de los pioneros en utilizar este indicador para analizar la transición entre ambos niveles.
Para medir el desempeño escolar, se consideraron el tiempo curricular, el abandono, los rezagos y la eficiencia terminal. El tiempo curricular se definió como el tiempo que debe utilizar el estudiante para concluir su ciclo formativo y que está establecido dentro del plan de estudios vigente en el que está inscrito (Chain Revuelta y Ramírez Muro, 1997). En este caso, para la ems se establecen en ambos subsistemas tres años y para la es únicamente se consideró hasta la conclusión del primer año.
El abandono, según Tinto (1989), implica dejar de asistir y de cumplir con los requisitos y obligaciones de todos los cursos en los que los estudiantes se encuentran inscritos. Otros autores (Castro y Rivas, 2006) consideran que el abandono consiste en el resultado final de un proceso educativo individual o grupal que implica que los aprendizajes esperados no fueron alcanzados.
El rezago se refiere al hecho de que los estudiantes no logren avanzar hacia el siguiente año, semestre, nivel o curso consecutivo del que se encuentran inscritos, lo cual representa un retraso respecto a los estudiantes que sí lo logran (Gutiérrez, Granados y Landeros, 2011).
La eficiencia terminal es el número de estudiantes que consiguen el egreso comparado con la cantidad que ingresan a determinado nivel educativo (Rodríguez y Hernández, 2008). Es importante señalar que en el caso de la ems se consideró la eficiencia terminal, mientras que para la es lo que se utiliza es regularidad, en el sentido de que únicamente se toma en cuenta la conclusión del primer año de licenciatura y no la conclusión de la totalidad del nivel superior.
El objetivo principal de este trabajo fue identificar, en la cohorte de estudiantes 2009, el nivel de desempeño escolar y eficiencia terminal al concluir la ems y su interrelación con el desempeño escolar y la regularidad al término del primer año de la es en la unam. Los objetivos específicos fueron:
- Identificar el nivel de desempeño escolar a tiempo curricular que presentan los estudiantes de la generación 2009 de la unam al término del nivel medio superior.
- Comparar el nivel de desempeño escolar a tiempo curricular que presentan los estudiantes de la generación 2009 del nivel medio superior de la unam.
- Comparar el desempeño escolar a tiempo curricular, al término del primer año de la licenciatura y por área de conocimiento de los estudiantes de la generación 2012, según el bachillerato de procedencia de la unam.
Métodos
El estudio se realizó en la Dirección de Evaluación Educativa, perteneciente a la Coordinación de Universidad Abierta, Innovación Educativa y Educación a Distancia (cuaieed) de la unam, en la Ciudad de México. Esta dependencia tiene dentro de sus funciones el recabar y analizar la información de evaluación educativa generada en los diversos niveles educativos de la Universidad.
El análisis en la primera parte de este estudio se realizó en una cohorte integrada por estudiantes que ingresaron por primera vez a alguno de los dos subsistemas de ems de la unam y que pertenecían a la generación 2009. El número de estudiantes de esta cohorte fue de 34 070 (ver tabla 1).
Tabla 1. Ingreso a la Educación Media Superior de la generación 2009, según el subsistema de bachillerato unam.
| Subsistema | n | % |
|---|---|---|
| ENP | 16 039 | 47 |
| CCH | 18 031 | 53 |
| Total 100% | 34 070 |
Fuente: Coordinación de Universidad Abierta, Innovación Educativa y Educación a Distancia (CUAIEED), Dirección de Evaluación Educativa, UNAM.
Se realizó el seguimiento del desempeño escolar de esta cohorte a tiempo curricular, a lo largo de los tres años de bachillerato. Para el subsistema de ems de la enp el plan de estudios es anual (tres años), mientras que para el cch es semestral (seis semestres). El análisis de la información se realizó con el mismo método para ambos.
La información para el análisis del desempeño escolar de los estudiantes se obtuvo de las historias académicas que proporcionó la Dirección General de Administración Escolar (dgae) de la unam. Esta documentación contiene las asignaturas, calificaciones y créditos acumulados por los estudiantes durante su tránsito por el bachillerato. Posteriormente, se clasificó la población en seis categorías de acuerdo con sus porcentajes de avance en créditos: abandono (0%), rezago extremo (1-25%), rezago alto (26-50%), rezago intermedio (51-75%), rezago recuperable (76-99%) y eficiencia terminal (100%), de acuerdo con la metodología usada en la Dirección de Evaluación Educativa de la unam (Valle, Rojas y Villa, 2001; ver tabla 2). Las trayectorias escolares se han utilizado como un instrumento que permite la clasificación de los estudiantes, de acuerdo con su avance en créditos, reflejando las problemáticas educativas más frecuentes dentro del Sistema Educativo Mexicano, tales como el abandono escolar, rezago estudiantil y bajos índices de eficiencia terminal.
Tabla 2. Clasificación de los estudiantes en intervalos según el desempeño escolar.
| Créditos acumulados | Desempeño escolar |
|---|---|
| 0% | Abandono |
| 1-25% | Rezago extremo |
| 26-50% | Rezago alto |
| 51-75% | Rezago intermedio |
| 76-99% | Rezago recuperable |
| 100% | Regularidad o egreso |
Fuente: Coordinación de Universidad Abierta, Innovación Educativa y Educación a Distancia, Dirección de Evaluación Educativa, UNAM.
Finalmente, de acuerdo con estas categorías, se analizó a la población durante el primer, segundo y tercer año del bachillerato. El propósito fue el de identificar el nivel de desempeño escolar desde el inicio del bachillerato hasta el término del tiempo curricular; es decir, el egreso o eficiencia terminal.
De los 34 070 alumnos de la generación 2009, que conformó la cohorte de los alumnos de bachillerato, únicamente se inscribieron en el nivel de Educación Superior 18 341 estudiantes, lo que representa 54% de la población inicial del estudio de la generación 2012. Es importante señalar que sólo se consideraron alumnos inscritos por primera vez al nivel superior y en la modalidad escolarizada, excluyéndose 67 casos, debido a que se inscribieron en el Sistema Abierto y Educación a Distancia (suayed) de la unam.
La metodología para medir el nivel de desempeño escolar de los estudiantes del nivel superior fue la misma que en el caso de bachillerato, por categorías de avance escolar. También se incluyó el área de conocimiento a la cual corresponde la licenciatura en que se encontraban inscritos al momento de realizar el cálculo. Las áreas de conocimiento en la unam son: Área i, Ciencias Físico-Matemáticas y de las Ingenierías (cfmi); Área ii, Ciencias Biológicas Químicas y de la Salud (cbqs); Área iii, Ciencias Sociales (cs) y Área iv, Humanidades y Artes (ha). El cálculo para la es se realizó hasta la conclusión del primer año de la licenciatura, por lo que no se habla de egreso como tal, sino de estudiantes regulares, es decir, estudiantes que concluyeron el primer año en tiempo y forma de acuerdo con lo que se estipula dentro del plan de estudios vigente en el que se encuentran inscritos.
Finalmente, se realizó una comparación porcentual del nivel de desempeño escolar de los estudiantes de la generación 2009 durante su tránsito por la ems, respecto a su nivel de desempeño escolar al finalizar el primer año de la es, en cada una de las áreas de conocimiento a la que corresponden las licenciaturas en las que se encontraban inscritos.
Resultados
Desempeño durante la Educación Media Superior
Al concluir el primer año de la ems, prácticamente la mitad (49.4%) de los estudiantes del Bachillerato de la unam (bunam) alcanzó la totalidad de los créditos establecidos en el plan de estudio vigente. El resto se distribuyó de la siguiente manera: 24.3% en rezago recuperable; 12.9% en rezago intermedio y 13.4% en las categorías de avance de porcentaje en créditos menores. A tiempo curricular se registró una eficiencia terminal de 56.6%, la enp mostró mayores porcentajes de alumnos regulares al término del primer año, y el cch registró mayor porcentaje de eficiencia terminal a tiempo curricular (ver tabla 3).
Tabla 3. Porcentaje de alumnos por desempeño escolar al final del primer año y tiempo curricular del bachillerato (bunam).
| ENP | CCH | BUNAM | ||||
|---|---|---|---|---|---|---|
| N=16 039 | N=18 031 | N=34 070 | ||||
| Desempeño escolar | PA | TC | PA | TC | PA | TC |
| AB | 3.5 | 2.4 | 2.6 | 1.7 | 3.0 | 2.0 |
| RE | 4.1 | 6.6 | 4.0 | 8.0 | 4.1 | 7.3 |
| RA | 5.1 | 8.3 | 7.4 | 9.2 | 6.3 | 8.8 |
| RI | 11.8 | 13.7 | 14.0 | 11.3 | 12.9 | 12.4 |
| RR | 21.9 | 13.5 | 26.4 | 12.3 | 24.3 | 12.9 |
| RG/EG | 53.6 | 55.5 | 45.7 | 57.5 | 49.4 | 56.6 |
Fuente: Coordinación de Universidad Abierta, Innovación Educativa y Educación a Distancia (CUAIEED), Dirección de Evaluación Educativa, UNAM.
AB=abandono; RE=rezago extremo; RA=rezago alto; RI=rezago intermedio; RR=rezago recuperable; RG/EG=regularidad/egreso; PA=primer año; TC=tiempo curricular; BUNAM=bachillerato UNAM.
Los alumnos que al finalizar el primer año presentaron condiciones de rezago alto, rezago extremo o abandono, tienen remotas probabilidades de concluir sus estudios de bachillerato, pues presentan valores de cero o cercanos. En el caso de los estudiantes que se encuentran en rezago intermedio, se puede advertir que tienen posibilidades considerables de concluir a tiempo curricular, bajo la condición de que al terminar el segundo año consigan situarse en una categoría mayor de desempeño escolar.
En cuanto a las categorías de rezago recuperable y regularidad, en la primera se observó que al terminar el primer año y mantenerse en esta categoría durante el segundo año, los estudiantes incrementan ligeramente sus posibilidades de alcanzar la eficiencia terminal. En el caso de la segunda categoría, los alumnos presentan mayor posibilidad de eficiencia terminal. Al término de tercer año, la eficiencia terminal fue de 56%.
Tabla 4. Probabilidad de que un alumno concluya el bachillerato en tiempo curricular, de acuerdo con su desempeño escolar al final del primer y segundo año.
| ENP | CCH | BUNAM | ||||
|---|---|---|---|---|---|---|
| Desempeño escolar | Año 1 | Año 2 | Año 1 | Año 2 | Año 1 | Año 2 |
| AB | 0.0000 | 0.0000 | 0.0011 | 0.0000 | 0.0006 | 0.0000 |
| RE | 0.0000 | 0.0000 | 0.0124 | 0.0000 | 0.0053 | 0.0000 |
| RA | 0.0058 | 0.0000 | 0.0666 | 0.0083 | 0.0372 | 0.0040 |
| RI | 0.1707 | 0.0239 | 0.2769 | 0.1338 | 0.2324 | 0.0931 |
| RR | 0.4500 | 0.4732 | 0.5874 | 0.6616 | 0.5305 | 0.5840 |
| RG | 0.8189 | 0.9448 | 0.8186 | 0.9513 | 0.8210 | 0.9478 |
Fuente: Coordinación de Universidad Abierta, Innovación Educativa y Educación a Distancia (CUAIEED), Dirección de Evaluación Educativa, UNAM.
AB=abandono; RE=rezago extremo; RA=rezago alto; RI=rezago intermedio; RR=rezago recuperable; RG; BUNAM=bachillerato UNAM.
Desempeño durante el primer año de la Educación Superior
Al concluir la ems, únicamente ingresaron a las licenciaturas de la unam 18 341 (54%) estudiantes. Éstos se distribuyeron de la siguiente manera en las cuatro áreas de conocimiento: 4 227 (23%) en cfmi; 6 527 (35%) en cbqs; 5 601 (31%) en cs y 1 986 (11%) en ha. Al concluir el primer año de la es se observó que 44.4% de los alumnos alcanzaron 100% de créditos fijados por los planes de estudios de sus licenciaturas, mientras que 23.2% se encontraron en rezago recuperable; 12.4% en rezago intermedio y 20% en rezagos mayores.
La regularidad por área de conocimiento es mayor en ha, pues presenta 54.5%; en segundo lugar, se encuentra cs con 53%, y finalmente están cbqs con 45% y cfmi con 27.4%. Esta última es la que registra el menor porcentaje de regularidad al término del primer año del nivel superior. Las categorías que representan los mayores niveles de rezago (extremo y alto), así como abandono, suman 21% en cfmi; 24% en cbqs; 9% en cs y 15% en ha. En todas las áreas de conocimiento son mayores los porcentajes de regularidad de los alumnos que provienen de la enp (ver tabla 5).
Tabla 5. Desempeño escolar al término de primer año de estudios superiores según área de conocimiento y bachillerato de procedencia.1
| AB | RE | RA | RI | RR | RG | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Área | Subsistema | Ingreso | n | % | n | % | n | % | n | % | n | % | n | % |
| CFMI | ENP | 2,096 | 74 | 3.5 | 137 | 6.5 | 249 | 11.9 | 402 | 19.2 | 466 | 22.2 | 768 | 36.6 |
| CCH | 2,131 | 136 | 6.4 | 292 | 13.7 | 425 | 19.9 | 449 | 21.1 | 439 | 20.6 | 390 | 18.3 | |
| BUNAM | 4,227 | 210 | 5.0 | 429 | 10.1 | 674 | 15.9 | 851 | 20.1 | 905 | 21.4 | 1,158 | 27.4 | |
| CBQS | ENP | 2,690 | 113 | 4.2 | 97 | 3.6 | 313 | 11.6 | 257 | 9.6 | 484 | 18.0 | 1,426 | 53.0 |
| CCH | 3,837 | 195 | 5.1 | 225 | 5.9 | 598 | 15.6 | 525 | 13.7 | 780 | 20.3 | 1,514 | 39.5 | |
| BUNAM | 6,527 | 308 | 4.7 | 322 | 4.9 | 911 | 14.0 | 782 | 12.0 | 1,264 | 19.4 | 2,940 | 45.0 | |
| CS | ENP | 2,653 | 46 | 1.7 | 48 | 1.8 | 129 | 4.9 | 176 | 6.6 | 658 | 24.8 | 1,596 | 60.2 |
| CCH | 2,948 | 57 | 1.9 | 54 | 1.8 | 168 | 5.7 | 330 | 11.2 | 964 | 32.7 | 1,375 | 46.6 | |
| BUNAM | 5,601 | 103 | 1.8 | 102 | 1.8 | 297 | 5.3 | 506 | 9.0 | 1,622 | 29.0 | 2,971 | 53.0 | |
| HA | ENP | 947 | 49 | 5.2 | 25 | 2.6 | 59 | 6.2 | 59 | 6.2 | 197 | 20.8 | 558 | 58.9 |
| CCH | 1,039 | 54 | 5.2 | 41 | 3.9 | 68 | 6.5 | 77 | 7.4 | 274 | 26.4 | 525 | 50.5 | |
| BUNAM | 1,986 | 103 | 5.2 | 66 | 3.3 | 127 | 6.4 | 136 | 6.8 | 471 | 23.7 | 1,083 | 54.5 | |
| Global | ENP | 8,386 | 282 | 3.4 | 307 | 3.7 | 750 | 8.9 | 894 | 10.7 | 1,805 | 21.5 | 4,348 | 51.8 |
| CCH | 9,955 | 442 | 4.4 | 612 | 6.1 | 1,259 | 12.6 | 1,381 | 13.9 | 2,457 | 24.7 | 3,804 | 38.2 | |
| BUNAM | 18,341 | 724 | 3.9 | 919 | 5.0 | 2,009 | 11.0 | 2,275 | 12.4 | 4,262 | 23.2 | 8,152 | 44.4 | |
Fuente: Coordinación de Universidad Abierta, Innovación Educativa y Educación a Distancia (CUAIEED), Dirección de Evaluación Educativa, UNAM.
AB=abandono; RE=rezago extremo; RA=rezago alto; RI=rezago intermedio; RR=rezago recuperable; RG=regularidad.
Desempeño escolar durante la transición de la EMS a la ES
Al comparar el desempeño escolar de estos alumnos durante la transición y término de la ems, así como la conclusión del primer año de licenciatura, se puede apreciar un decremento en su desempeño escolar, sobre todo de los que cursaron licenciaturas correspondientes al área cfmi (ver tabla 6).
Tabla 6. Desempeño escolar de los alumnos desde el bachillerato y primer año de licenciatura según área de conocimiento.
| Desempeño | CFMI | CBQS | CS | HA | Global | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n=4,227 | n=6,527 | n=5,601 | n=1,986 | n=18,341 | |||||||||||
| EMS | ES | EMS | ES | EMS | ES | EMS | ES | EMS | ES | ||||||
| Años | Año | Años | Año | Años | Año | Años | Año | Años | Año | ||||||
| 1 | 2 | 1 | 1 | 2 | 1 | 1 | 2 | 1 | 1 | 2 | 1 | 1 | 2 | 1 | |
| AB | 0.0 | 0.0 | 5.0 | 0.0 | 0.0 | 4.7 | 0.0 | 0.0 | 1.8 | 0.0 | 0.0 | 5.2 | 0.0 | 0.0 | 3.9 |
| RE | 0.0 | 0.0 | 10.1 | 0.0 | 0.0 | 4.9 | 0.1 | 0.0 | 1.8 | 0.1 | 0.0 | 3.3 | 0.0 | 0.0 | 5.0 |
| RA | 0.4 | 0.1 | 15.9 | 0.2 | 0.0 | 14.0 | 0.6 | 0.1 | 5.3 | 0.8 | 0.1 | 6.4 | 0.4 | 0.1 | 11.0 |
| RI | 4.0 | 1.4 | 20.1 | 3.3 | 1.1 | 12.0 | 4.7 | 2.3 | 9.0 | 5.2 | 2.4 | 6.8 | 4.1 | 1.7 | 12.4 |
| RR | 20.5 | 29.4 | 21.4 | 19.3 | 29.1 | 19.4 | 23.9 | 38.4 | 29.0 | 25.0 | 41.3 | 23.7 | 21.6 | 33.3 | 23.2 |
| RG | 75.1 | 69.1 | 27.4 | 77.1 | 69.7 | 45.0 | 70.8 | 59.2 | 53.0 | 68.9 | 56.2 | 54.5 | 73.8 | 64.9 | 44.4 |
Fuente: Coordinación de Universidad Abierta, Innovación Educativa y Educación a Distancia (CUAIEED), Dirección de Evaluación Educativa, UNAM.
AB=abandono; RE=rezago extremo; RA=rezago alto; RI=rezago intermedio; RR=rezago recuperable; RG=regularidad.
Al analizar la trayectoria escolar de la generación 2009 de la ems, y hasta el primer año de la generación 2012 de es, se puede inferir que la probabilidad de que un alumno que ingresa al bachillerato termine ese nivel y sea regular hasta la conclusión del primer año de licenciatura es de 0.24. O sea, es de esperarse que uno de cada cuatro alumnos que ingresan al bachillerato lo termine y sea regular hasta el término del primer año de sus estudios superiores (ver tabla 7).
Tabla 7. Probabilidad de que un alumno de bachillerato termine y sea regular al primer año de licenciatura
| Procedencia | Probabilidad |
|---|---|
| ENP | 0.2689 |
| CCH | 0.2087 |
| BUNAM | 0.2370 |
Fuente: Coordinación de Universidad Abierta, Innovación Educativa y Educación a Distancia (CUAIEED, Dirección de Evaluación Educativa, UNAM.
En cuanto a las probabilidades por subsistema, se registran mayores probabilidades de eficiencia terminal y regularidad en los estudiantes que cursaron el bachillerato dentro de alguno de los planteles de la enp, hasta el término del primer año de la es.
Figura: Seguimiento del desempeño escolar de la cohorte 2009 del bachillerato de la unam al término del primer año de licenciatura.
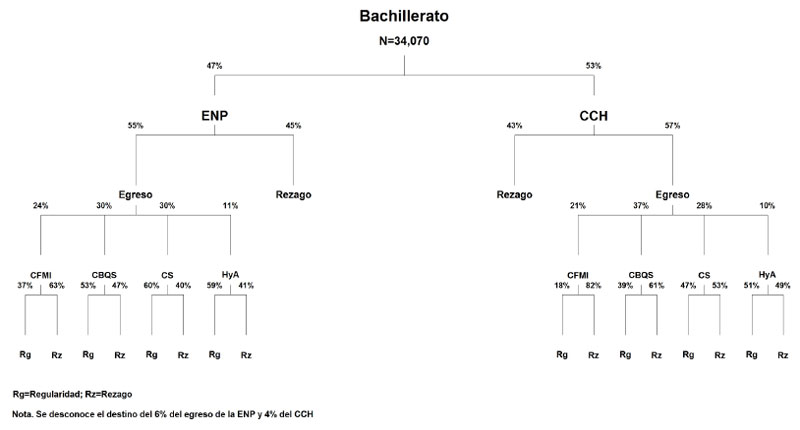
Fuente: Coordinación de Universidad Abierta, Innovación Educativa y Educación a Distancia (CUAIEED), Dirección de Evaluación Educativa, UNAM.
Discusión y conclusiones
La transición de la Educación Media Superior a la Superior es un período difícil, ya que esta última demanda un alto compromiso y exigencia en el proceso educativo. La adecuada articulación entre ambas puede redundar en beneficio de los estudiantes, al facilitar su integración y desempeño escolar (Pérez et al., 2011). Según Cu (2005), algunos estudiantes reconocen que las problemáticas durante la es —reprobación, rezago o abandono— se deben a la carencia de orientación educativa, promoción y difusión de las licenciaturas existentes dentro del nivel superior, durante su tránsito por la ems. Esto genera que el plan de estudios que cursan no cumpla con las expectativas que habían considerado antes de ingresar. En este sentido, Ezcurra (2005) menciona que otros factores de retraso entre los estudiantes dentro de la es son las deficiencias dentro de la formación preuniversitaria, elementos tales como la docencia, la planeación institucional, el perfil esperado acerca de la población de ingreso al nivel superior, la frecuencia de apertura para cursar las asignaturas, su seriación, entre otros.
En relación con el abandono, este fenómeno ha sido continuamente objeto de estudio debido a las repercusiones negativas que implica, pues, aunque se presenta en el sector educativo, afecta el desarrollo social y económico de las naciones e influye en la capacidad del individuo para acceder a “un trabajo, un hogar y un estilo de vida digno” (González, 2006). De acuerdo con el Banco Mundial (anuies, 2014), si bien el índice de abandono escolar en México es considerablemente elevado, no resulta un problema particular del país, sino que se trata de un fenómeno que ocurre a nivel internacional.
Rodríguez et al. (2005) realizaron un estudio sobre el abandono escolar en la Universidad Autónoma Metropolitana-Unidad Iztapalapa (uam-i). Sus principales hallazgos expusieron que a pesar de que la condición económica familiar es un factor asociado al abandono en la mayoría de los trabajos de investigación, en los alumnos de la uam-i éste no resulta ser determinante. En cambio, el rendimiento académico previo constituyó un factor importante, pues se logró establecer que los promedios bajos y el rezago definen el abandono escolar. Asimismo, Rodríguez et al. (2005) establecieron una relación entre la decisión de abandono y la presencia de factores organizacionales, administrativos e institucionales —como la actividad docente desde el punto de vista de la atención y la asesoría hacia los estudiantes—.
De la misma forma, Buentello y Valenzuela (2013) desarrollaron un estudio en la Facultad de Contaduría y Administración de la Universidad Autónoma de Sinaloa, y encontraron que 38% de alumnos de formación básica encuestados consideró que la carga académica era la principal causa de abandono. La percepción de la dificultad en el programa educativo generalmente se asocia al desempeño académico previo del estudiante universitario, pues si dicho desempeño no es satisfactorio, el alumno carece de las habilidades y competencias necesarias para afrontar con éxito los retos que implica pertenecer al nivel superior.
En los resultados del presente estudio, el análisis reveló que el desempeño escolar de los estudiantes del bachillerato presentó porcentajes de abandono y rezago considerables con respecto a la población que ingresó a cualquiera de los dos subsistemas, lo que genera en consecuencia una eficiencia terminal de 56% de la población, únicamente con dos puntos porcentuales de diferencia entre la enp y el cch. En general, el abandono y el rezago aumentaron al término del primer año de licenciatura, en comparación con el bachillerato.
El abandono escolar, además de generar problemas como el desempleo, la delincuencia y la mala calidad de vida, afecta de manera negativa la relación entre la institución de educación superior y el Estado, puesto que implica un incumplimiento en los objetivos establecidos desde la política nacional, y esto propicia que las metas contempladas en el Plan Nacional de Desarrollo no sean alcanzadas (Vásquez et al., 2009). Las instituciones de educación superior tienen un compromiso no sólo con el alumnado, sino con la comunidad, ya que son el medio para que los jóvenes adquieran habilidades, conocimientos, destrezas y competencias, que les permitan integrarse al campo laboral y, de esta manera, contribuir al desarrollo económico y social de su país. Por ello, las estrategias para fomentar la permanencia de los estudiantes deberían ser un tema prioritario en la agenda de las autoridades universitarias.
De acuerdo con cifras de la anuies (2014), la eficiencia terminal de estudiantes universitarios en México fue sólo de 67.8% durante el período escolar 2003-2004. Al respecto, la Secretaría de Educación Pública (sep, 2016) indica que, según cifras de la Dirección General de Planeación, Programación y Estadística Educativa, los porcentajes de eficiencia terminal en el nivel superior en los últimos cuatro ciclos escolares fueron: 2012-2013, 73.7%; 2013-2014, 71.3%; 2014-2015, 71.9%, y 2015-2016, 70.6%. Como puede observarse, en el último ciclo escolar, el porcentaje de eficiencia terminal a nivel superior ha aumentado únicamente 3% en relación con el ciclo 2003-2004.
En este sentido, Romo et al. (2007) afirman que el abandono estudiantil representa un factor problemático característico de las instituciones de educación superior en México. A nivel mundial, uno de los indicadores que se utilizan para evaluar la eficiencia interna de las instituciones de educación superior es el índice de graduación de un programa académico. Éste, según la Organización para la Cooperación y Desarrollo Económicos (ocde, 2016), se define como la proporción de estudiantes que ingresan al nivel superior y se gradúan; se calcula considerando el número de estudiantes que obtienen el grado en relación con el número de los que ingresan al nivel n años antes, donde n es igual al número de años de estudio de tiempo completo requerido para terminarlo. En México, el índice de graduación es de 8.2%, lo que implica un enorme reto para nuestro país en comparación con otros.
Este tipo de estudios pretende —además de arrojar datos relevantes para comenzar a detectar áreas de oportunidad y fortalezas, no sólo a nivel local sino también institucional— contribuir al afianzamiento de la evaluación como un proceso que permite, cuando está correctamente planificado, diseñado e implementado, dar cuenta de los factores más relevantes dentro del proceso de enseñanza-aprendizaje. En este sentido, una fortaleza de este estudio es el seguimiento a una población de 34 070 estudiantes, que conforman una cohorte durante su paso por el nivel medio superior y hasta el primer año de licenciatura, y la identificación de la transición entre estos niveles educativos de acuerdo con el avance en créditos como indicador del desempeño escolar.
Los resultados de este trabajo muestran la existencia de una discrepancia entre la preparación de los egresados del bunam, con los requerimientos de las licenciaturas de la misma institución, especialmente en el área de cfmi. Por subsistema se observa mayor área de oportunidad en los estudiantes del cch, lo cual resalta la importancia de encauzar los recursos necesarios y pertinentes, en primer lugar, para la búsqueda, por medio de este tipo de trabajos, de datos que nos arrojen mayores evidencias de las necesidades específicas de este entorno educativo y, en segundo lugar, de estrategias que respondan de manera puntual y óptima a la solución de las problemáticas encontradas.
Este tipo de trabajos confirma las aportaciones realizadas por otros previos. Por ejemplo, el que se llevó acabo en la Universidad de Barcelona, en el cual Álvarez, Figuera y Torrado (2011) señalan que de un total de 1 368 estudiantes provenientes del bachillerato, únicamente 510 (37%) concluyen el segundo año de la Educación Superior, lo cual confirma que la problemática de la transición del bachillerato a la universidad es un proceso complejo, que comporta cambios personales, académicos y sociales en el estudiante, los cuales implican no sólo al sujeto que transita, sino a los profesores y a las instituciones.
También son relevantes los trabajos que destacan otros factores asociados con el paso entre la ems y la es. Por ejemplo, el de Santiviago et al. (2015), quienes dentro del contexto de la ems en Uruguay señalan que, con respecto a las habilidades necesarias para facilitar la transición, resulta llamativo el hecho de que un importante porcentaje de los estudiantes considere que las ha desarrollado poco o nada, al tiempo que los aprendizajes promovidos desde los centros educativos no han jerarquizado adecuadamente aprendizajes importantes, como el trabajo autónomo, la planificación del tiempo y el empleo de técnicas y estrategias para el estudio.
De esta manera, los resultados que aquí se exponen, así como los presentados en estudios previos relacionados con esta temática, denotan la importancia de abrir varias líneas de investigación acerca de la vinculación entre ambos niveles educativos. Asimismo, resaltan la importancia de realizar iniciativas planteadas desde varios frentes y enfoques para aminorar el abandono y rezago, y aumentar la eficiencia terminal.
Para tomar decisiones fundamentadas en el proceso educativo, se requiere detectar casos de estudiantes que se encuentran en riesgo de abandono en cualquiera de los dos niveles, así como estudiantes que requieren apoyo para continuar avanzando de manera regular. Con esta información es posible plantear e instrumentar estrategias de intervención pedagógica, que permitan una adecuada articulación entre ambos niveles educativos, con la finalidad de optimizar una formación universitaria adecuada, que dote a los egresados de los conocimientos y habilidades que demanda el desempeño de las diversas profesiones para responder a las necesidades de inserción al ámbito laboral.
Referencias
- Álvarez González, M., Figuera Gazo, P. y Torrado Fonseca, M. (2011), La problemática de la transición bachillerato – universidad en la Universidad de Barcelona. Revista Española de Orientación y Psicopedagogía, 22(1), 15-27. https://www.redalyc.org/articulo.oa?id=3382/338230787003.
- Asociación Nacional de Universidades e Instituciones de Educación Superior (anuies) (2014, 4 de febrero). Preocupante deserción escolar en México y el mundo: Banco Mundia. http://www.anuies.mx/noticias/preocupante-desercion-escolar-en-mexico-y-el-mundo-banco-mundia.
- Buentello Martínez, C. P., Valenzuela Salazar, N. L. y Juárez Ibarra, D. P. (2013). Deserción escolar, factores que determinan el abandono de la carrera profesional. Estrategias y condiciones para el desarrollo del estudiante [ponencia presentada en el xvi Congreso Internacional sobre Innovaciones en Docencia e Investigación en Ciencias Económico Administrativas, Mazatlán, Sinaloa, México]. http://www.fca.uach.mx/apcam/2014/04/04/Ponencia%2069-UACoah-Piedras%20Negras.pdf.
- Cascón, I. V. (2000). Análisis de las calificaciones escolares como criterio de rendimiento académico. http://campus.usal.es/~inico/investigacion/jornadas/jornada2/comun/c17.html.
- Castro Ramírez, B. y Rivas Palma, G. (2006). Estudio sobre el fenómeno de la deserción y retención escolar en localidades de alto riesgo. Sociedad Hoy, (11), 35-72. https://www.redalyc.org/articulo.oa?id=90201103.
- Chain Revuelta, R. y Ramírez Muro, C. (1997). Trayectoria escolar: la eficiencia terminal en la Universidad Veracruzana. Revista de la Educación Superior, 26(102). http://publicaciones.anuies.mx/revista/102/2/2/es/trayectoria-escolar-un-estudio-sobre-la-eficiencia-terminal-en-la-uv.
- Cu Balán, G. (2005). El impacto de la escuela de procedencia del nivel medio superior en el desempeño de los alumnos en el nivel universitario. Revista Electrónica Iberoamericana sobre Calidad, Eficacia y Cambio en Educación, 3(1), 764-769. https://www.redalyc.org/articulo.oa?id=551/55130171.
- De Vries, W., León Arenas, P., Romero Muñoz, J. F. y Hernández Saldaña, I. (2011). ¿Desertores o decepcionados? Distintas causas para abandonar los estudios universitarios. Revista de la Educación Superior, xl(4)(160), 29-49. https://www.redalyc.org/articulo.oa?id=604/60422569002.
- Ezcurra, A. M. (2005). Diagnóstico preliminar de las dificultades de los alumnos de primer ingreso a la educación superior. Perfiles Educativos, 27(107), 128-133. https://cutt.ly/RkrrnWB.
- Fernández Pérez, J., Peña Chumacero, A. y Vera Rodríguez, F. (2006). Los estudios de trayectoria escolar. Su aplicación en la educación media superior. Graffylia(6), 24-29. https://filosofia.buap.mx/sites/default/files/Graffylia/6/24.pdf.
- González González, M. T. (2006). Absentismo y abandono escolar: Una situación singular de la exclusión educativa. Revista Iberoamericana sobre Calidad, Eficacia y Cambio en Educación, 4(1), 1-15. http://www.rinace.net/arts/vol4num1/art1.pdf.
- Gutiérrez García, A. G., Granados Ramos D. E. y Landeros Vázquez, M. G. (2011). Indicadores de la trayectoria escolar de los alumnos de psicología de la Universidad Veracruzana. Revista electrónica Actualidades Investigativas en Educación, 11(3), 1-30. https://www.redalyc.org/articulo.oa?id=447/44722178009.
- Loyo, E. y Staples, A. (2010), Fin del siglo y de un régimen. En D. Tanck de Estrada (coord.), La educación en México, Seminario de Historia de la Educación en México (pp. 127-153). El Colegio de México. https://adolfosanpe.files.wordpress.com/2013/03/la-educacion-emn-mexico.pdf.
- Organización para la Cooperación y Desarrollo Económicos (ocde). (2016). Panorama de la educación. Indicadores de la ocde 2016. ocde.
- Pérez, C., Silva, E., Jiménez, G., Cáceres, G., Lagos, J., Loncomilla, L., Bagnara, M., Báez, M., Abarca, M y Ampuero, N. (2011). Análisis y Sistematización de Experiencias de Transición realizadas en universidades del Grupo Operativo por cinda. En El Proceso de Transición entre la Educación Media y Superior. Experiencias Universitarias (pp. 131-163). Centro Interuniversitario de Desarrollo (cinda). https://cutt.ly/okeN3Xz.
- Rodríguez Lagunas, J., Hernández Vázquez, J. M., Mecalco, M., Peralta, G., Ubaldo, K. y Pérez, G. (2005). La Deserción Escolar en la uam-i Informe Final. Investigación Interna de la Universidad Autónoma Metropolitana-Unidad Iztapalapa, pp. 1-110.
- Rodríguez Lagunas, J. y Hernández Vázquez, J. M. (2008). La deserción escolar universitaria en México: la experiencia de la Universidad Autónoma Metropolitana, Campus Iztapalapa. Revista Electrónica Actualidades Investigativas en Educación, 8(1) 1-30. doi: https://doi.org/10.15517/AIE.V8I1.9308.
- Romo López, A., Roa, R., Duarte, M., Cruz, L., González, A. y Cedillo, R. (2007), Retención y deserción en un grupo de instituciones mexicanas de educación superior. anuies.
- Santivago, C., Álvarez Pérez, P., López Aguilar, D., Rubio, V. y Falkin, C. (2015). El rendimiento previo y las expectativas del alumnado: su influencia en la calidad de las trayectorias académicas hacia la universidad [ponencia presentada en la V Conferencia Latinoamericana Sobre el Abandono en la Educación Superior, Talca, Chile]. Ponencias de Congresos clabes. http://revistas.utp.ac.pa/index.php/clabes/article/view/1065.
- Secretaría de Educación Pública (sep). (2016). 4to. Informe de labores, 2015-2016. https://cutt.ly/ikrib1p.
- Tinto, V. (1989). La deserción en la educación superior: síntesis de las bases teóricas de las investigaciones recientes (Carlos María de Allende, Trad.). proides/sep/anuies.
- Universidad Nacional Autónoma de México. (2014). Reglamento de la Escuela Nacional Preparatoria. Recuperado el 23 de agosto de 2018 de https://cutt.ly/dkroazJ.
- Universidad Nacional Autónoma de México. (2014). Reglamento de la Escuela Nacional Colegio de Ciencias y Humanidades. Recuperado el 23 de agosto de 2018 de https://cutt.ly/jkrofBq.
- Valle Gómez-Tagle, R., Rojas Argüelles, G. y Villa Lozano, A. (2001). El análisis de las trayectorias escolares en la unam: Un método de análisis. En R. Chaín Revuelta (Coord.), Deserción, Rezago y Eficiencia Terminal en las ies. Propuesta Metodológica para su Estudio (pp. 51-74). anuies.
- Vásquez, J., Gómez, K., Gallón, S. y Castaño, E. (2009). Deserción estudiantil en la educación superior colombiana. Metodología de seguimiento, diagnóstico y elementos para su prevención. Ministerio de Educación Nacional. https://cutt.ly/Jkro9Ap.
- Vera Noriega, J. A., Ramos Estrada, D. Y., Sotelo Castillo, M. A., Echeverría Castro, S., Serrano Encinas, D. M. y Vales García, J. J. (2012). Factores asociados al rezago en estudiantes de una institución de educación superior en México. Revista Ibero Americana de Educación Superior, iii(7), 41-56. https://www.redalyc.org/articulo.oa?id=299129031003.
Recepción: 17/12/2020. Aprobación: 22/01/2021.






